

(图片来源:Angew. Chem. Int. Ed.)
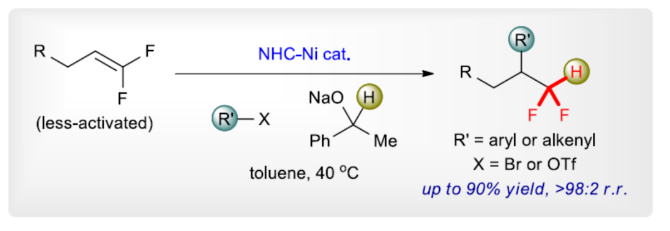
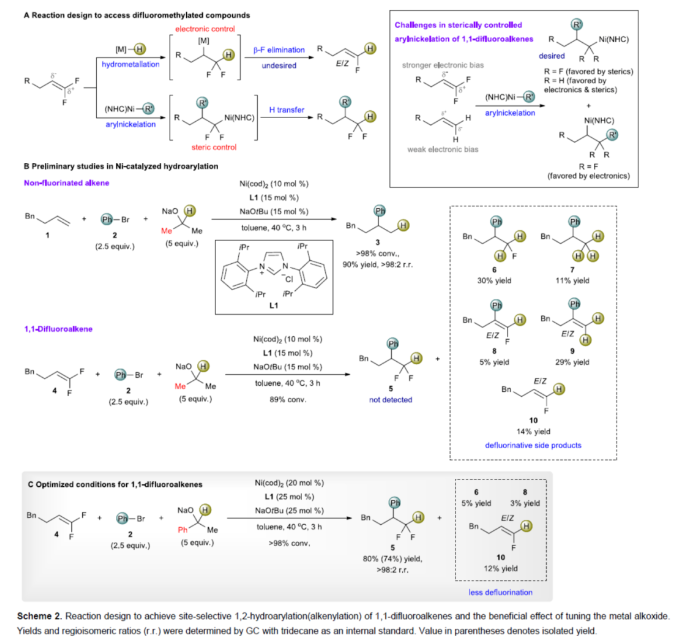
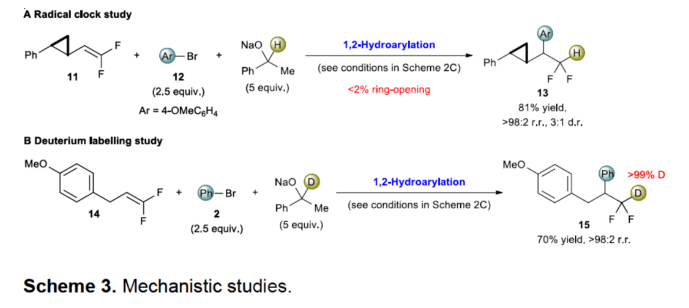
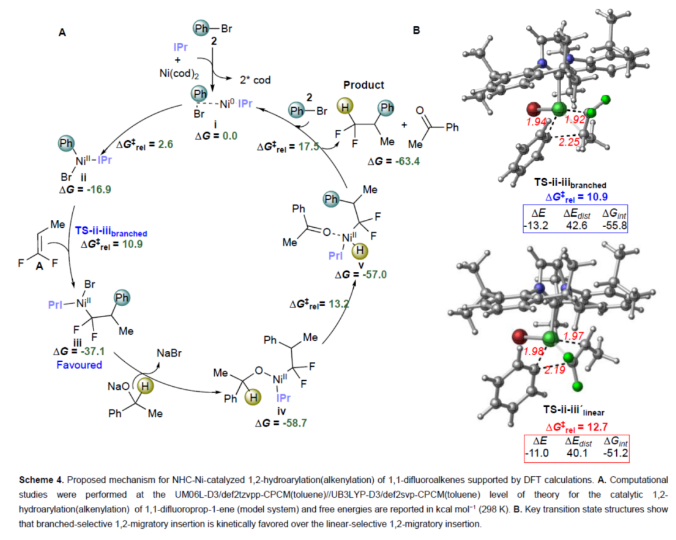
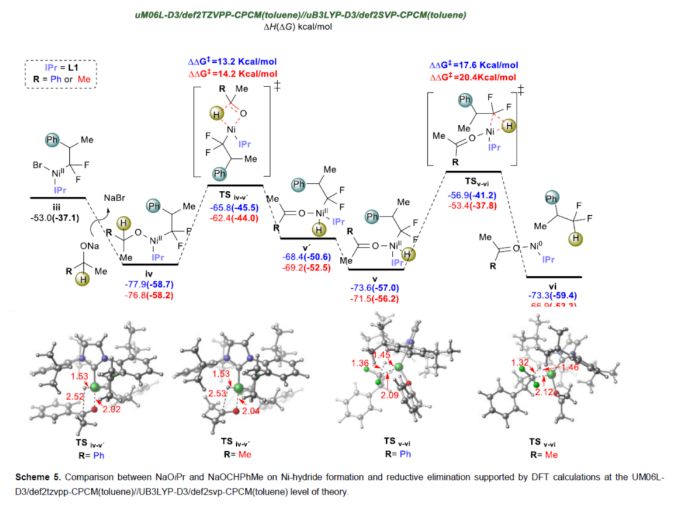
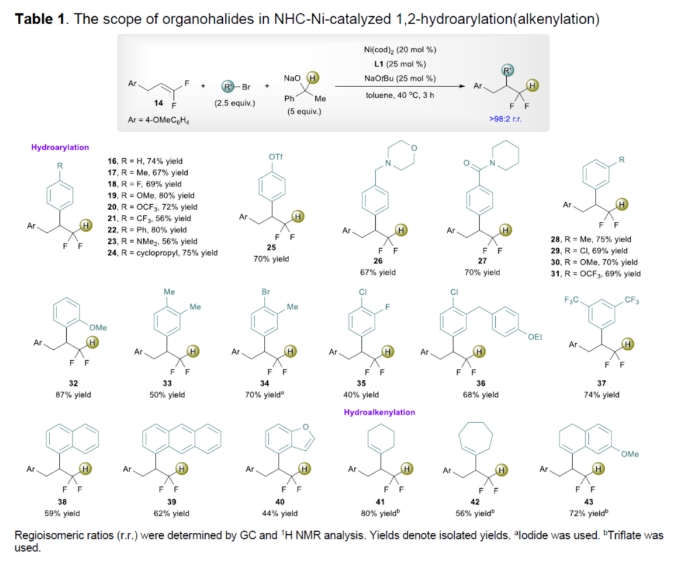
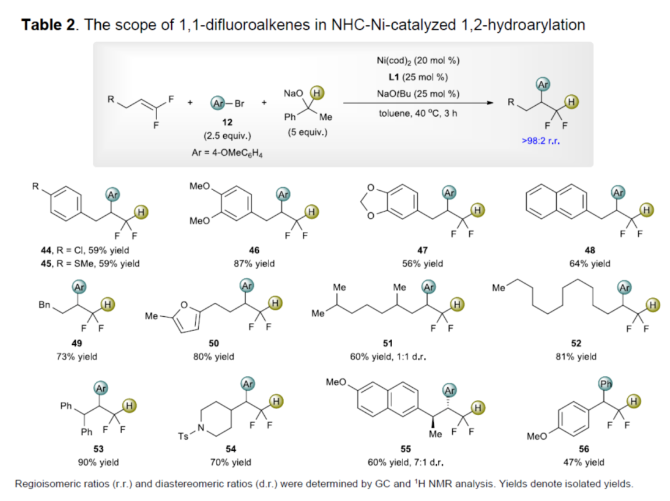
正文 (图片来源:Angew. Chem. Int. Ed.) 前期,在支链选择性加氢芳基化反应中通常涉及催化活性金属氢化物物种的生成,引发烯烃底物的区域选择性加氢金属化,然后进行芳基化反应。然而, 将该反应的底物范围扩展至偕-二氟烯烃具有挑战,主要是由于加氢金属化生成的烷基金属中间体易进行β-F消除(Scheme 2A)。因此,作者设想了一种大小可编程的NHC-镍催化物种在空间控制下诱导位点选择性芳基镍化反应。随后,通过氢转移将C−Ni键转化为C−H键,从而获得所需的二氟甲基化产物。 在最初的镍催化氢芳基化反应的研究中,当使用非氟取代的烯烃作为底物,在Ni(cod)2/L1/NaOtBu条件下进行氢芳基化反应时,可以90%的收率得到产物3,r.r. > 98:2(Scheme 2B)。然而,当使用偕-二氟烯烃4作为底物时,未能生成所需的加氢芳基化产物5,而是生成一系列脱氟副产物6-10。 因此,作者以偕-二氟烯烃4、Ph-Br 2与NaOCHPhMe(作为氢化物供体,用于抑制脱氟副反应)作为模型底物,进行了相关反应条件的筛选(Scheme 2C)。当以Ni(cod)2(20 mol %)作为催化剂,L1(25 mol %)作为配体,NaOtBu(25 mol %)作为碱,在甲苯溶剂中40 oC反应3 h,可以74%的分离收率得到产物5,r.r. > 98:2。 (图片来源:Angew. Chem. Int. Ed.) 紧接着,作者对反应机理进行了进一步的研究(Scheme 3)。首先,自由基钟实验结果表明,反应不太可能涉及自由基的机理,从而与通过金属氢化物氢原子转移促进的烯烃加氢芳基化形成了对比(Scheme 3A)。其次,氘代实验结果表明,NaOCHPhMe在反应过程中起到了氢化物供体的作用(Scheme 3B)。 (图片来源:Angew. Chem. Int. Ed.) 基于上述的研究以及相关DFT计算研究,作者提出了一种合理的催化循环过程(Scheme 4A)。首先,在L1和Ni(cod)2存在下,芳基溴化物经氧化加成,生成中间体ii。其次,中间体ii与偕-二氟烯烃A经支链选择性π-络合/1,2-迁移插入(涉及TS-ii-iii的形成),生成中间体iii。值得注意的是,竞争性的线性选择性迁移插入途径能量上相对不利。形变/相互作用(distortion/interaction)分析表明,与TSii-iiilinear相比,较低的势垒相关TSii´-iiibranched是由于两个片段之间的相互作用能更强(Scheme 4B)。同时,中间体iii与NaOCHPhMe的转移可生成Ni-醇盐配合物iv。随后,配合物iv可与醇盐进行区域选择性的β-H消除,生成中间体v,同时形成实验观察到的苯乙酮副产物。最后,中间体v经还原消除后生成所需的氢芳基化产物,并完成催化循环。 (图片来源:Angew. Chem. Int. Ed.) 同时,作者还通过相关的计算来深入了解氢化物源在促进偕-二氟烯烃的1,2-氢芳基化方面的显著作用(Scheme 5)。研究结果表明,与Ni-OiPr相比,Ni-OCHPhMe通过TSiv-v´消除β-H的速度快10倍,形成Ni-氢化物v,同时形成相应的酮,可能是由于苯乙酮中的苯基与配体片段之间有利的π-π堆积相互作用。其次,在Ni-氢化物形成过程中,导致丙酮(R = Me)作为副产物形成的体系的能障可能比导致苯乙酮(R = Ph)形成的体系的能障高得多,主要是由于苯乙酮稳定镍配合物的能力更大。与TSv-vi(R = Me)相比,从氧的孤对(LP)轨道到TSv-vi(R = Ph)中镍原子上的LP*(反键轨道)的供体-受体相互作用能更有利。 (图片来源:Angew. Chem. Int. Ed.) 此外,作者对有机卤化物底物范围进行了扩展(Table 1)。首先,在邻、间或对位含有富电子或缺电子基团的各种卤代芳烃,均可顺利进行氢芳基化反应,获得相应的产物16-40,收率为59-83%,ee为40-87%。然而,与含吡啶、醛/酮的芳基卤化物以及空间位阻较大的2,6-二取代芳烃,未能有效的进行反应。其次,通过氢烯基化反应,还可合成含有烯丙基-CF2H单元的产物41-43,收率为56-80%。 (图片来源:Angew. Chem. Int. Ed.) 同时,作者还对偕-二氟烯烃底物范围进行了扩展(Table 2)。首先,当偕-二氟烯烃底物中的R为不同取代的芳烃、-Bn、杂芳基与烷基时,均可顺利进行氢芳基化反应,获得相应的产物44-53,收率为56-90%。其次,含有饱和杂环与萘基取代的偕-二氟烯烃,也与体系兼容,获得相应的产物54(收率为70%)和55(收率为60%)。此外,苯乙烯基二氟烯烃,也是合适的底物,可以47%的收率得到产物56。 (图片来源:Angew. Chem. Int. Ed.) 总结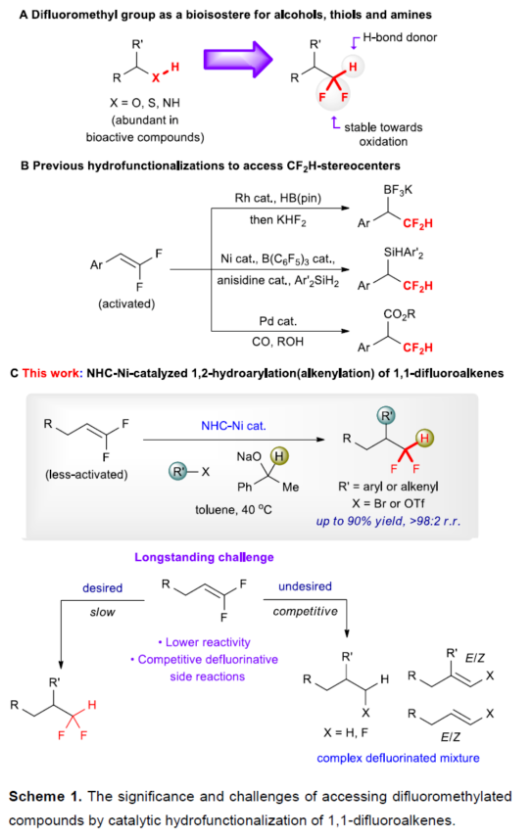
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn