

(图片来源:Nat. Synth.)
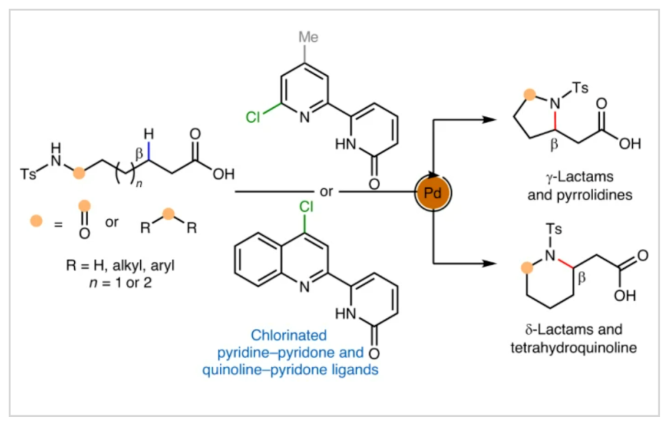
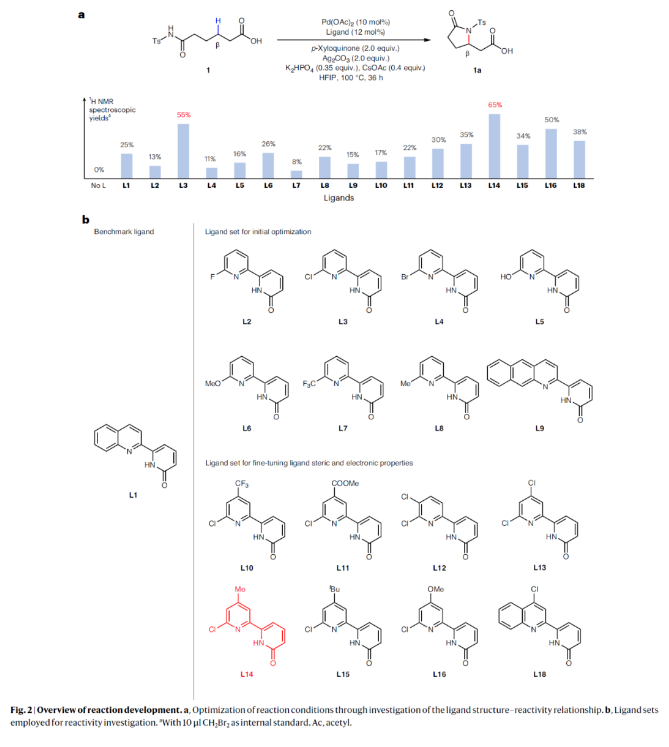
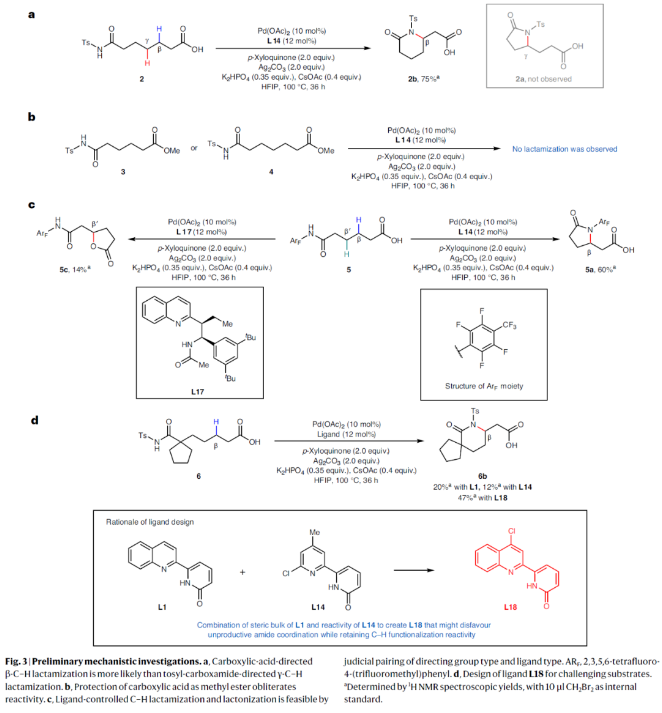
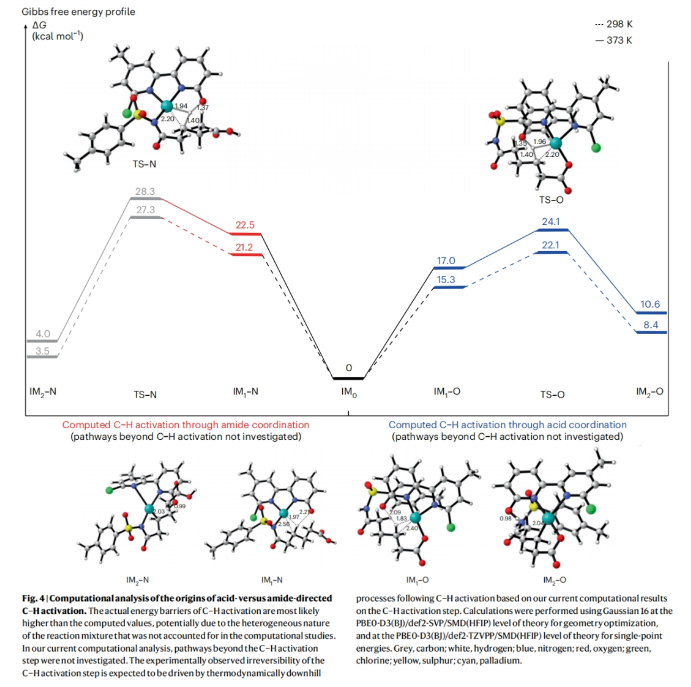
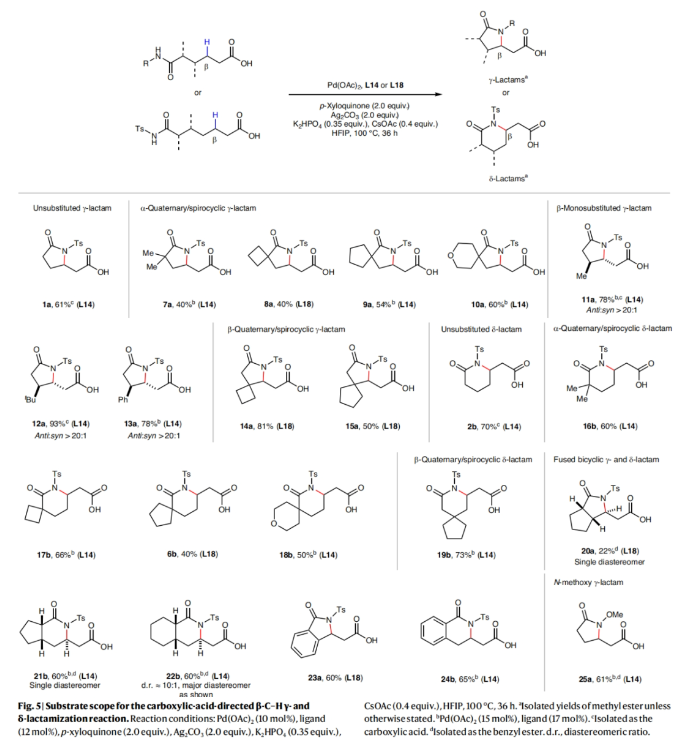
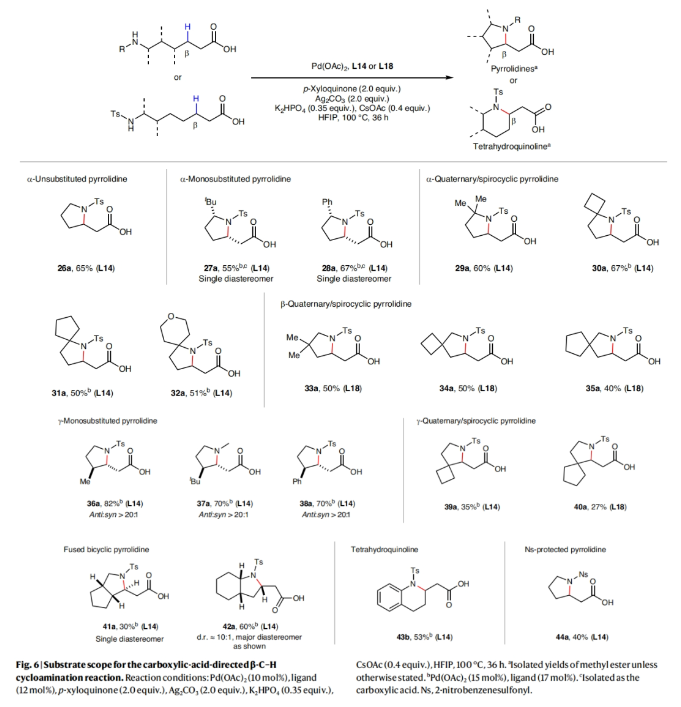
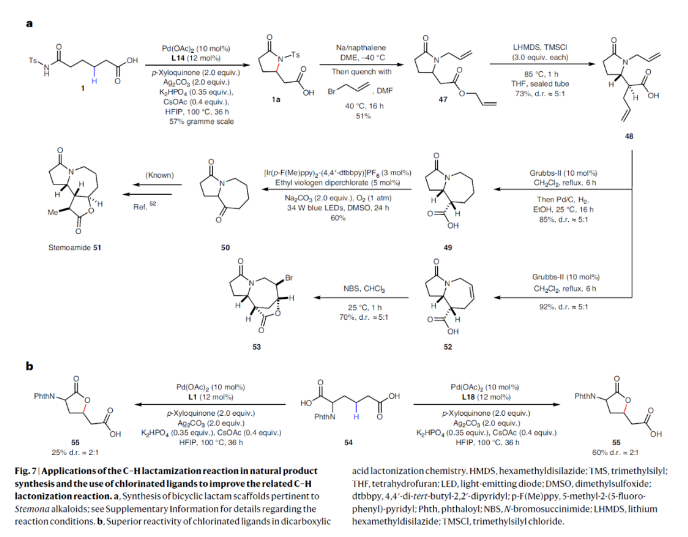
正文 由于内酰胺和环胺骨架普遍存在天然产物和药物中,因此通过C(sp3)-N键的构建来制备饱和杂环的环化反应是现代合成化学的基石之一(Fig. 1a)。C(sp3)-H胺化方法的出现开创了一个新的时代,其可以通过C-H活化直接形成C(sp3)-N键,目前已成为一种重要的合成策略。虽然依赖于乃春、自由基和烯丙基C-H键的活化等策略的C(sp3)-H胺化反应已经取得了巨大进展,但实现普遍存在的非活化亚甲基和甲基的C-H胺化过程仍然很困难。虽然钯催化甲基和亚甲基的C(sp3)-H胺化可以实现这一过程,但通常需要使用导向基团的协助,这限制了其应用。最近,美国斯克里普斯研究所余金权课题组发展了新型氯化吡啶-吡啶酮配体,其可以有效促进N-保护ω-氨基酸的内酰胺化和环胺化反应,构建了一系列具有γ-和δ-内酰胺、吡咯烷和四氢喹啉等骨架的环β-氨基酸类化合物(Fig. 1b)(Fig. 1c)。下载化学加APP到你手机,收获更多商业合作机会。 (图片来源:Nat. Synth.) 首先,作者选择N-保护ω-氨基酸1作为模板底物对反应条件进行了探索(Fig. 2)。通过对一系列吡啶-吡啶酮配体的筛选,作者发现当使用Pd(OAc)2 (10 mol%), L14 (12 mol%), p-Xyloquinone (2.0 equiv), Ag2CO3 (2.0 equiv), K2HPO4 (0.35 equiv), CsOAc (0.4 equiv), 在HFIP中,100 oC反应36小时,可以以65%的核磁产率得到γ-内酰胺产物1a。 (图片来源:Nat. Synth.) 虽然目前可以确定吡啶-吡啶酮配体可以与钯形成五元螯合物,并倾向于经历β-C-H活化,但产物1a的形成是通过羧酸导向的β-C-H γ-内酰胺化过程还是酰胺导向的γ-C-H γ-内酰胺化过程还不清楚。为了区分这两种反应途径,作者研究了底物2的反应性(Fig. 3a)。实验结果表明,2的内酰胺化反应仅以75%的核磁产率得到了δ-内酰胺产物2b,这表明反应倾向于羧酸导向的β-C-H δ-内酰胺化反应途径。鉴于酰胺导向的δ-C-H活化途径能涉及七元环钯中间体,因此可能性较小。此外,由于作者并没有观察到γ-内酰胺产物2a,由此表明所观察到的C-N键形成反应与酰胺导向的反应途径不一致。与这一假设相一致的是,N-保护ω-氨基酸甲酯3和4在相同的反应条件下反应时并没有观察到C-N键形成,这表明底物中羧酸的存在对反应性至关重要(Fig. 3b)。接下来,作者探索了导向基和配体的匹配是否可以作为实现位点选择性转化的策略(Fig. 3c)。初步的研究结果表明,导向基团与配体之间的匹配可以实现位点特异性的C-H官能团化。此外,作者发现4-氯喹啉-吡啶酮配体L18可以有效的改善具有α-螺环酰胺的底物6的环化过程,以47%的产率得到δ-内酰胺产物6b(使用L14时,产率仅为12%)(Fig. 3d)。 (图片来源:Nat. Synth.) 通过DFT计算研究,作者发现使用配体L14时,羧酸导向的C-H活化过程比酰胺取向的C-H活化有优势的本质是立体因素影响的。即五元螯合配体L14在与钯中心配位时会与底物的Ts酰胺部分产生立体排斥,因此羧酸导向的C-H活化过程比酰胺导向的过程更有利(Fig. 4)。 (图片来源:Nat. Synth.) 在得到了最优反应条件后,作者对此γ-和δ-内酰胺化过程的底物范围进行了考察(Fig. 5)。实验结果表明,一系列不同取代的氨基酸衍生物均可顺利实现此转化,以22-93%的产率得到相应的γ-和δ-内酰胺产物1a-25a。此外,此C-N键形成策略还就可以扩展到更具挑战性的C-H环胺化反应。利用此策略,在配体L14或L18的促进下,以27-82%的产率得到相应的环胺产物26a-44a(Fig. 6)。 最后,为了证明此转化的实用性,作者利用此策略实现了Stemona生物碱的形式合成(Fig. 7a)。首先,作者利用1作为起始原料,通过此方法可以以57%的分离产率实现γ-内酰胺1a的克级规模合成。随后,脱去1a的氮-Ts保护基,接着分子发生两次烯丙基化,以51%的产率得到双烯丙基内酰胺47。47经历Ireland–Claisen重排以73%的产率得到双烯丙基羧酸48 (dr = 5:1),其经历连续的关环复分解和氢化以85%的产率得到双环内酰胺羧酸49。49通过光氧化还原脱羧氧化反应以60%的产率得到双环酮内酰胺50,从而实现了消旋Stemona生物碱的形式合成。此外,关环复分解产物52可以通过与NBS经历烯烃的溴代内酯化,以70%的产率得到复杂多环化合物53。总之,从1制备50和53证明了利用此策略构建复杂分子骨架的潜力。值得注意的是,作者发现新设计出的配体也可应用于二羧酸的内酯化(Fig. 7b)。当使用与配体L1最相似的配体L18来实现以前难以实现的N-保护二羧酸底物54的内酯化过程时,可以将反应产率从25%提高到60%。 (图片来源:Nat. Synth.) 总结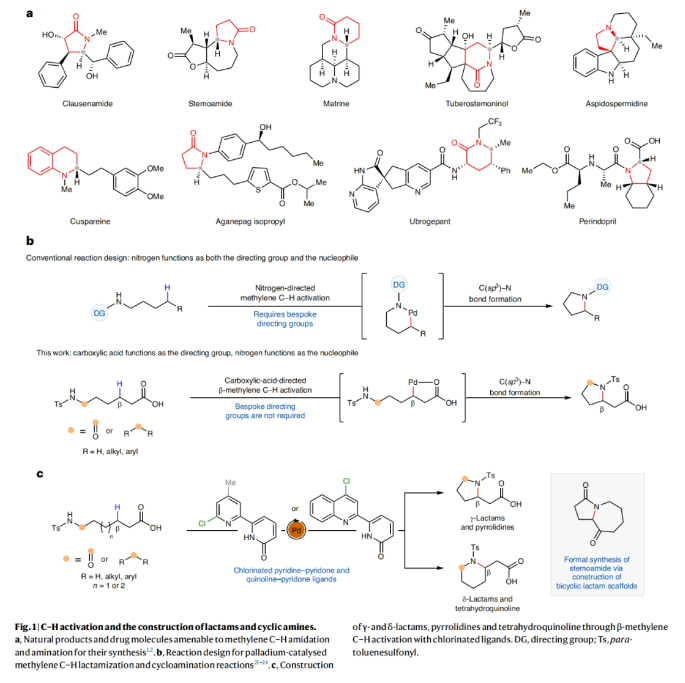
余金权课题组设计了两类新型氯化配体L14和L18,实现了钯催化、羧酸导向的N-保护ω-氨基酸的内酰胺化和环胺化反应。利用此C-N键形成反应可以通过C-H活化来构建具有不同环大小和结构的环内酰胺和胺骨架,且这些结构在化学合成和药物化学中具有重要的应用。值得注意的是,利用此方法还可以实现stemoamide生物碱的形式合成,进一步证明了该方法的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn