

正文
手性1,2-二醇是药物、农用化学品和精细化学品领域中合成多种功能化合物的重要中间体。为此,人们开发了多种合成手性1,2-二醇的方法,包括生物催化和化学催化。化学催化方法包括烯烃的Sharpless双羟基化反应、环氧化合物的水解动力学拆分、1,2-二醇的酰化/烷基化动力学拆分,以及α-羟基酮的不对称硼氢化、硅氢化、转移氢化和氢化反应。其中,不对称氢化因其原子经济性和操作简便性成为最具吸引力的方法(图1a)。
长期以来,不对称氢化领域由钌、铑、钯和铱等贵金属催化剂主导。尽管近年来钌和铱催化剂在合成手性1,2-二醇中取得进展(图1b),但贵金属的不可持续性、高昂成本和潜在环境毒性促使研究者转向锰、铁、钴、镍和铜等丰产金属。然而,丰产金属催化的α-羟基酮不对称氢化合成手性1,2-二醇的研究尚未见报道。
作者所在团队长期致力于丰产金属催化的不对称氢化反应(最新文献:Ni:J. Am. Chem. Soc.2025,147, 342-352;Nat. Commun.2024,15, 5482;Angew. Chem. Int. Ed.2023,62, e202214990;Cu:Angew. Chem. Int. Ed.2025,64, e202416313;Angew. Chem. Int. Ed.2023,62, e202306380;Co:JACS Au.2023,3, 2981;Angew. Chem. Int. Ed.2023,62, e202217871)。此前,作者所在团队已利用手性钴催化剂实现了C=C和C=N键的高效不对称氢化(Org. Lett.2024, 26, 769;Angew. Chem. Int. Ed.2023, 62, e202303488;Angew. Chem. Int. Ed.2023, 62, e202217871;Chem. Eur. J.2022, 28, e202201517)。基于此,团队尝试挑战钴催化C=O键的不对称氢化这一难题(JACS Au.2023,3, 2981)。文献调研表明,钴催化酮的不对称氢化仍处于早期阶段:现有催化体系在同时实现高催化活性和强立体控制上存在不足,反应普适性和催化效率也有限。多齿配体钴催化体系通过“配体促进策略”(如NH效应)可高效氢化简单酮类(图1c左),而双齿配体催化剂则通过“底物促进策略”(如导向基效应),在官能化酮类化合物的氢化中表现更优(图1c中)。例如,双膦配体和氨基导向基的协同作用实现了α-氨基酮的高效氢化。然而,将导向基由氨基替换为羟基时,反应的催化活性和对映选择性都显著下降,这可能是羟基的弱配位能力和较小位阻所致。为此,亟需开发新型促进策略以突破这一局限。
在钴/双膦配合物催化官能化酮的氢化反应的成功案例中,羧酸钴(如乙酸钴和硬脂酸钴)表现出优于其他钴盐的活性和对映选择性(JACS Au.2023,3, 2981;Chem Catal.2024, 4, 100999)。作者推测,羧酸根水解生成的羧酸可能在催化循环的关键过渡态中发挥双重作用:其羰基与底物羟基形成氢键以增强配位,羟基与底物羰基形成氢键以提高还原活性,同时羧酸的引入优化了立体控制环境。基于此,作者提出“添加剂促进策略”(羧酸效应,图1c右),开发了钴/双膦配合物与羧酸添加剂协同的高效催化体系,实现了α-羟基酮的高产率和高对映选择性氢化。
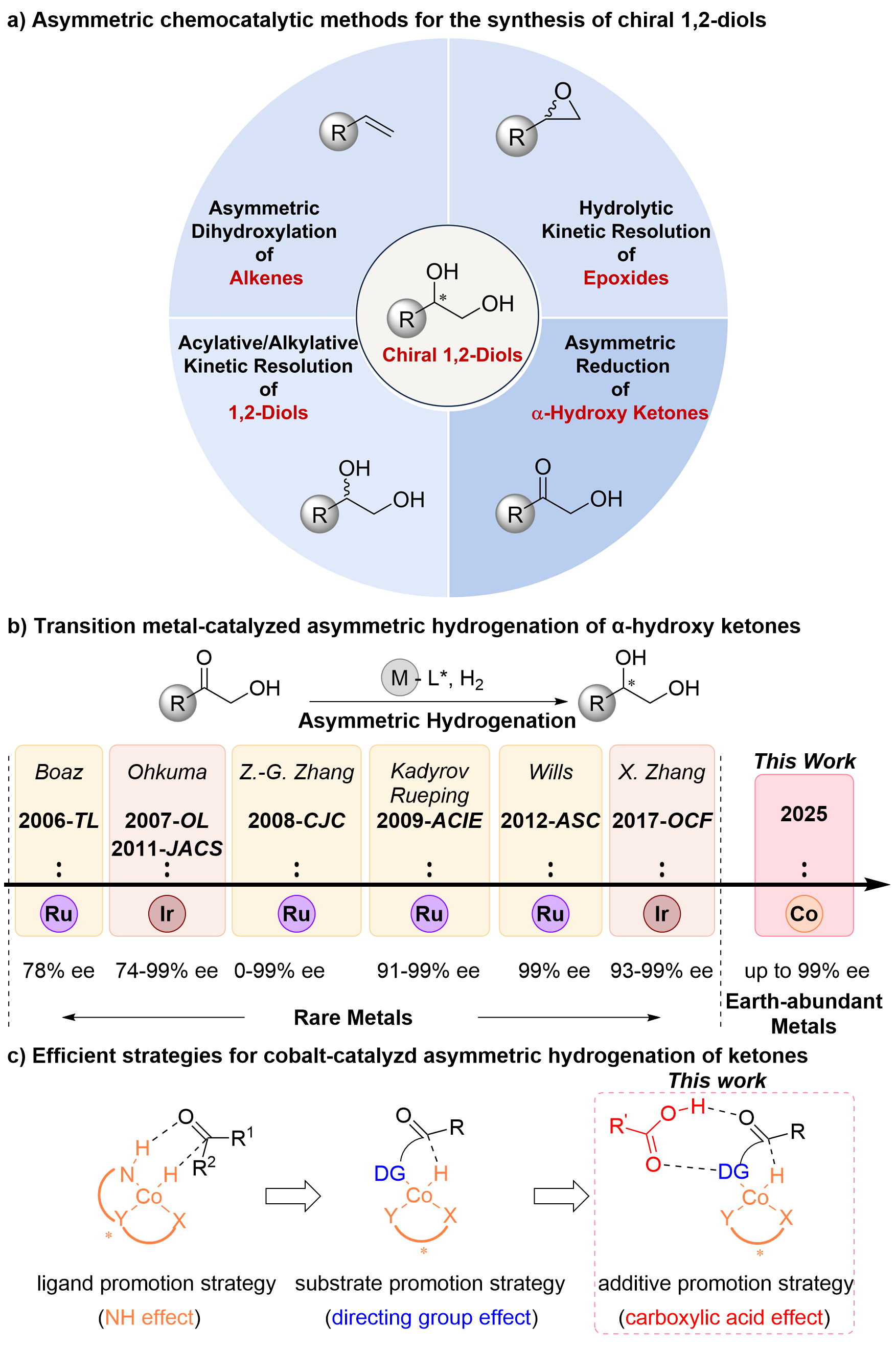
图1. 手性1,2-二醇的化学催化合成
作者研究以α-羟基苯乙酮(1a)为模板底物,筛选了多种钴盐和手性双膦配体。和预期结果相同,醋酸钴为最优钴盐。配体中,(S,S)-Ph-BPE(L2)可提供最高对映选择性(88% ee,图2a)。进一步考察添加剂时发现,羧酸(尤其是苯甲酸衍生物)显著提升了反应效率(图2b)。水杨酸使产物2a的ee值达到98%,略优于苯甲酸(97% ee)。再对其他反应参数如反应溶剂、氢气压力和温度进行了优化,优化后的条件为:乙酸钴(6 mol%)、(S,S)-Ph-BPE(5 mol%)、水杨酸(10 mol%)、氢气(50 bar)、甲苯溶剂、70°C反应。将反应时间延长到48小时,产物2a的转化率>99%,ee值达到98%。

图2. 条件筛选
随后作者考察了α-羟基酮的底物范围(图3)。对位由供电子或吸电子基团取代的底物均能以高收率和高ee值(85–99%)生成产物(2b–2j)。邻位取代芳基底物的对映选择性较低(2k,87% ee),间位取代底物(2l–2o)与对位取代结果类似。双取代底物(2p–2s)则表现良好(收率92–98%,ee值92–99%)。萘环和杂环底物(2t–2w)的氢化同样高效,产物2u的绝对构型经单晶X射线衍射确认为R型。
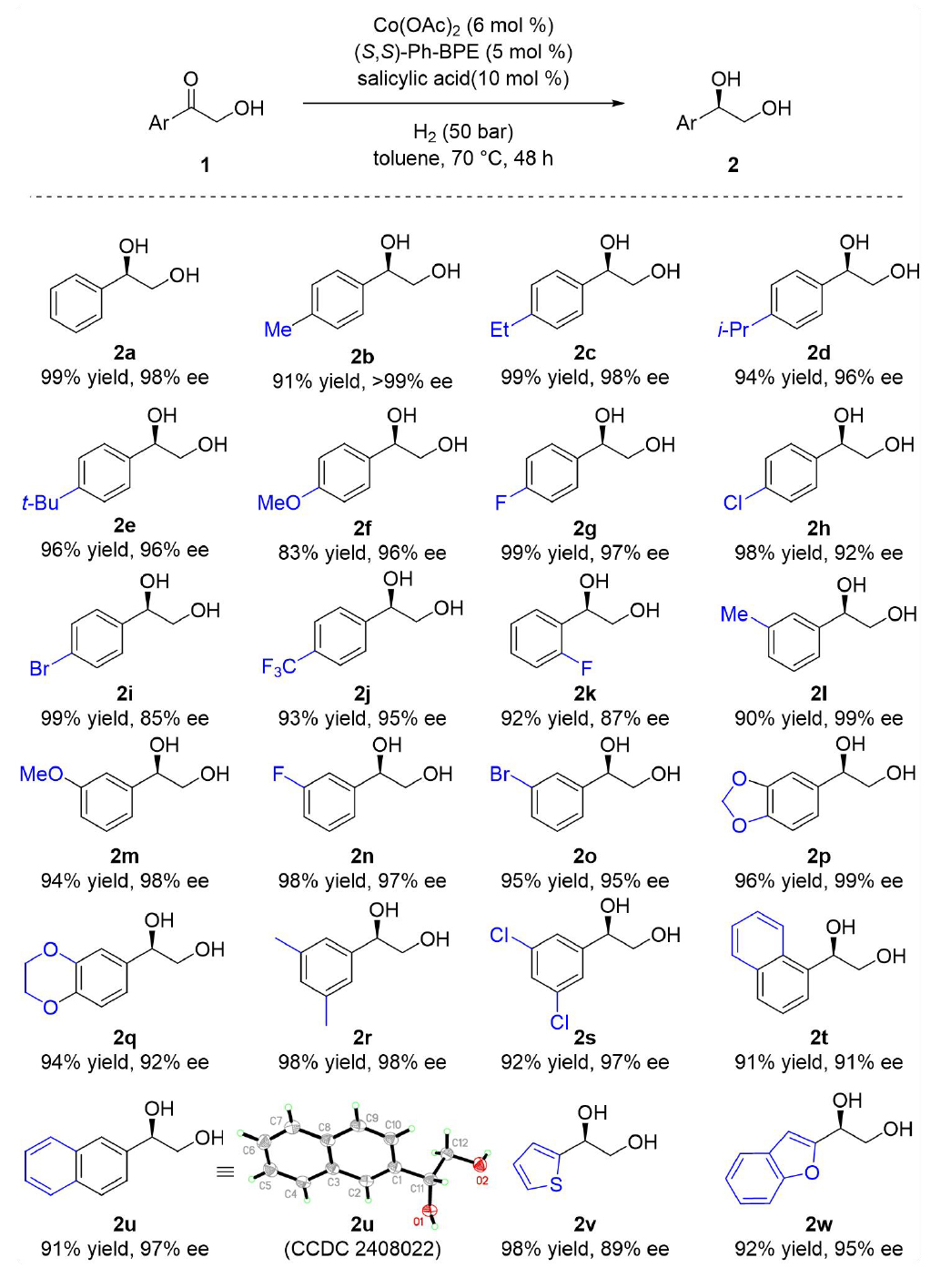
图3. 底物拓展
为证实反应合成应用价值,作者进行了克级规模反应(图4a)和产物衍生化(图4b)。1,2-二醇2a与碳酸二甲酯反应生成3(64%收率,99% ee),与对甲苯磺酰氯保护后得到4(85%收率,98% ee)。4可一步转化为环氧化物5(92%收率,99% ee)和硫醚6(47%收率,98% ee),其中5是治疗膀胱过度活动症药物米拉贝隆的关键中间体。硫醚6可被乙酸酐酯化生成7(89%收率,97% ee),7可作为手性硫醚助剂,在具有潜在治疗效果的1,2-顺式甘露糖的合成中发挥作用。此外,通过磺化、分子内威廉姆森醚化及环氧化物开环胺解等步骤,完成了NMDA受体拮抗剂(R)-(-)-Eliprodil的全合成(产物10,97% ee)。
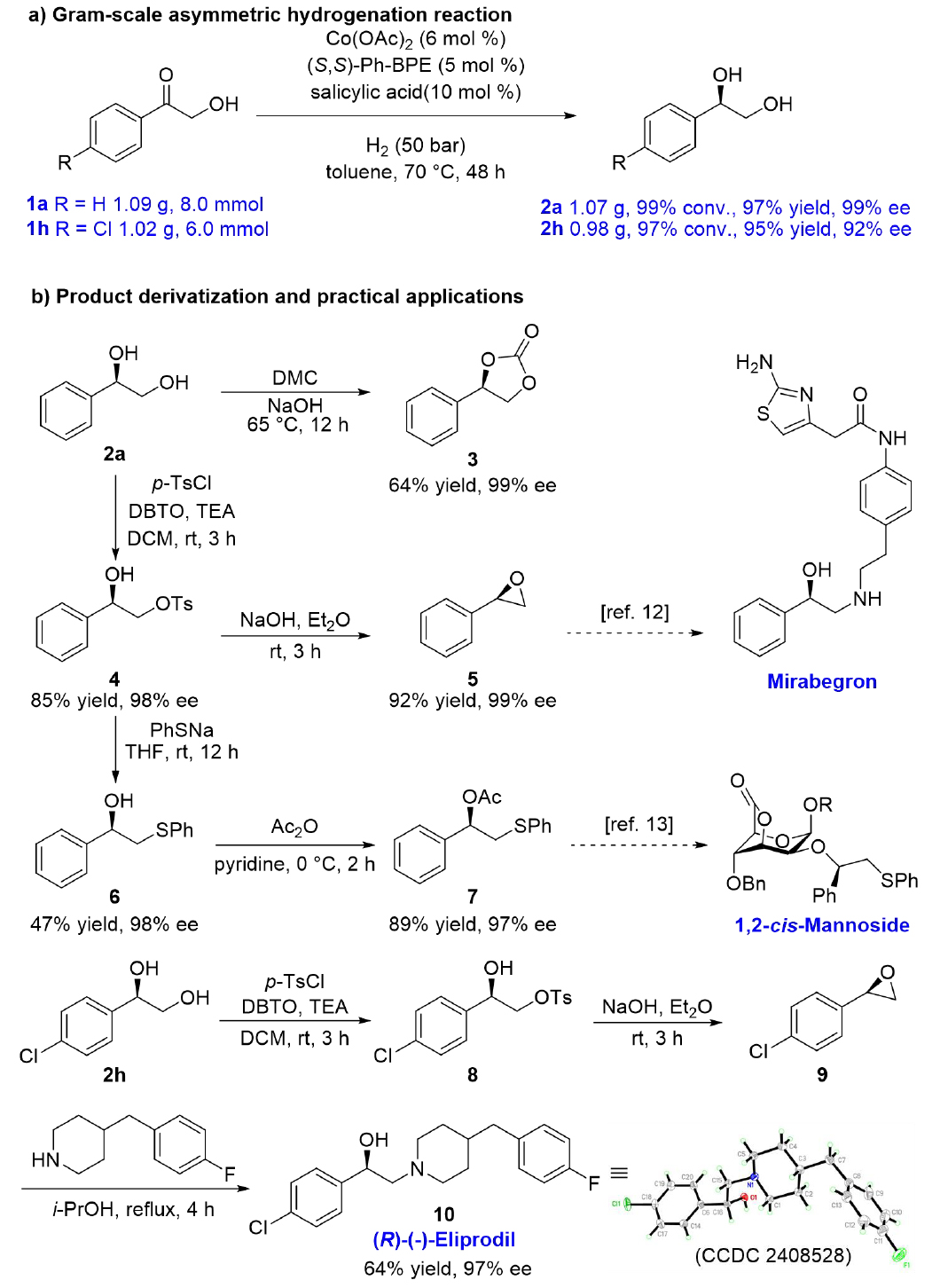
图4. 克级反应、产物衍生化和应用
机理研究表明,底物α-羟基对活性和对映选择性至关重要:酯化或甲基化底物的反应效率显著下降。苯甲酸替换为苯甲酸甲酯时,ee值降至89%,与无添加剂条件(88% ee)接近,表明羧酸的质子对羰基活化和立体控制起关键作用(图5a)。DFT计算支持非氧化还原钴(II)催化循环和羧酸/羟基协同促进的氢化模型(图5b),这与此前作者在α-氨基酮底物的催化机理的发现一致。钴配合物A经历氢解,原位生成活性钴氢物种C。随后负氢转移到1a的羰基碳上,由D经由过渡态TS生成E。E释放优势构型为R的产物2a,并重新生成A。图5c表明在关键过渡态中,水杨酸通过多重氢键与底物和钴氢物种相互作用。两个过渡态的ΔΔG‡为2.0 kcal/mol,R构型因多出一个氢键而具有更低的能垒(图5c和5d)。
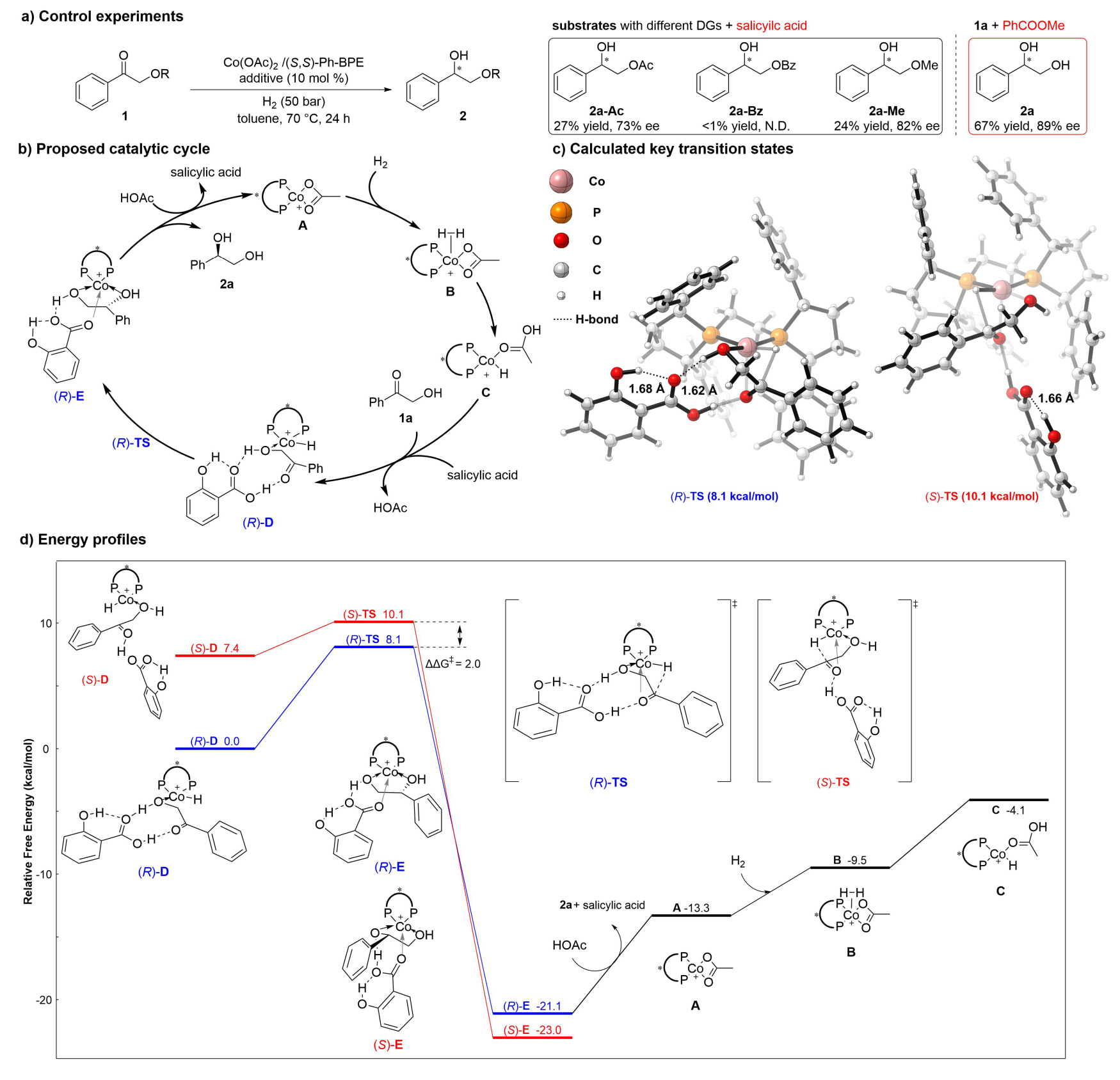
图5. 催化机理
总结
综上所述,张万斌团队开发了首例钴催化α-羟基酮不对称氢化反应,通过羧酸添加剂促进策略高效合成手性1,2-二醇。机理研究表明,羧酸通过双重氢键增强底物配位与羰基活化,并优化立体控制环境。该策略为丰产金属催化不对称氢化提供了新思路。上述研究成果近期发表在Angew. Chem. Int. Ed.上,上海交通大学药学院硕士生宋雨茜和博士生邹雅诗为论文的第一作者,化学化工学院张万斌教授和药学院张振锋研究员为论文的通讯作者。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn