

研究背景
在生命体系中精准可控地操纵无机物的合成与利用,是中心法则无法实现的。细胞具有精细而复杂的代谢网络,合理利用这些天然的生化反应,能在活细胞内合成无机功能纳米晶体并加以利用,例如合成和操纵半导体荧光量子点,尤其是近红外量子点,将为原位标记精细脆弱的细胞组分奠定基础,对于高保真地获取复杂生命过程中的动态信息具有重大意义。同时,将为利用精巧的亚细胞结构构筑新的非天然功能的分子机器体系开辟新的道路。然而,活细胞合成引入的外源试剂及其诱导细胞产生的物质(如活性氧,ROS)常常会导致细胞损伤,进而降低胞内合成效率,极大地阻碍了活细胞精准合成无机物领域的发展。
自2009年起,庞代文研究团队一直致力于无机荧光纳米晶体的活细胞可控合成(Adv. Funct. Mater. 2009, 19 (15), 2359-2364;ACS Nano 2013, 7 (3), 2240-2248;Nat. Protoc. 2025, DOI: 10.1038/s41596-024-01133-5;ACS Nano2014, 8(5), 5116-5124; Natl. Sci. Rev. 2022, 9 (6), nwab162; Natl. Sci. Rev. 2024, 11 (3), nwae021),开创了量子点活细胞合成方法,即通过巧妙地耦合细胞内不可能自然交会的硒代谢途径及金属离子解毒途径,实现了半导体荧光纳米晶体的活细胞合成。最近,该团队以《Making Cells as a "Nirvana Phoenix": Precise Coupling of Precursors Prior to ROS Bursts for Intracellular Synthesis of Quantum Dots》为题在JACS上报道了一种既能合成量子点又可保持细胞活力的调控策略,通过精准耦合低毒性阴阳离子前体,实现了细胞内近红外Ag2Se量子点的合成,既高效合成量子点,也有效维持了细胞活力。
该文亮点
发现了细胞适用的硒代胱氨酸((Cys-Se)2)能被代谢还原为生物相容性的低价态硒前体硒代半胱氨酸(Se-Cys)且不会诱导胞内ROS累积,该活性前体可被及时添加的银-谷胱甘肽(AgSG)捕获,并转化为近红外Ag2Se量子点(Scheme 1)。相比于前期使用SeO32−/Ag+的合成方法,该生物相容性调控策略避免了细胞毒性HSe−的生成和ROS的爆发,使细胞活力从4%提高到80%,同时细胞合成Ag2Se量子点的荧光增强了8.7倍。这种具有稳定的近红外荧光功能的肿瘤细胞(Ag2Se@Cells)仍保持其在活体水平上的增殖、成瘤、侵袭和转移能力,使长期追踪细胞分裂和疾病的发生发展成为可能,也为活细胞原位定点标记及活体组织标记奠定了坚实基础,具有重要的生物医学意义。
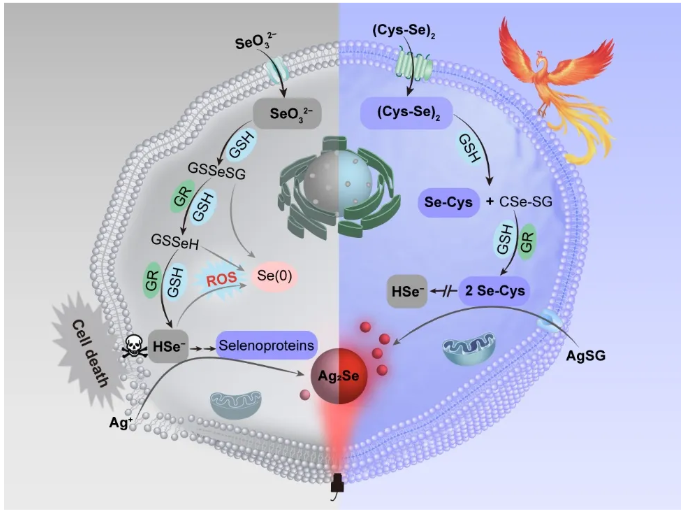
Scheme 1. Illustration of Live-Cell Synthesis of NIR Ag2Se QDs. Reactive Se precursors, such as hydrogen selenide ion (HSe−) and selenocysteine (Se-Cys), are produced through distinct metabolic reduction pathways of selenocystine ((Cys-Se)2) and SeO32−. Precise coupling of low-cytotoxic precursors can effectively maintain cell viability and facilitate QD synthesis. Selenodiglutathione (GSSeSG), glutathioselenol (GSSeH), glutathione (GSH), glutathione reductase (GR), elemental selenium (Se(0)), selenocysteinyl glutathione (CSe-SG), Ag-glutathione (AgSG).
主要内容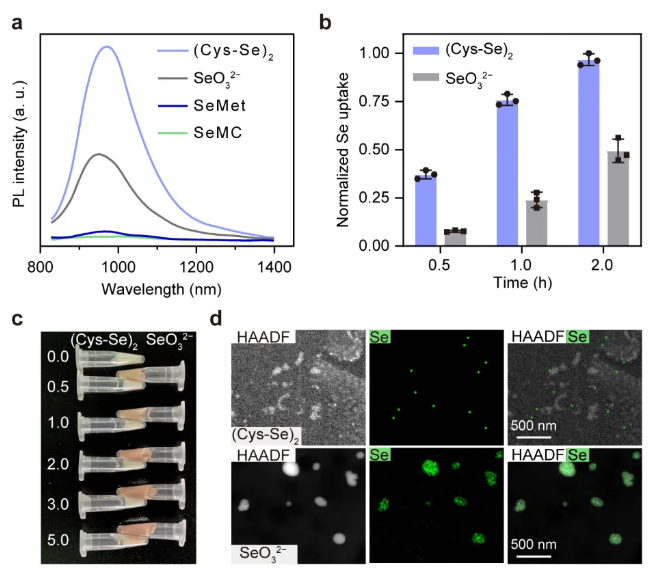
Figure 1. Live-cell synthesis of Ag2Se QDs using (Cys-Se)2 as a Se source. (a) Fluorescence spectra of intracellular synthesized Ag2Se QDs, using (Cys-Se)2, SeMet, SeMC, or SeO32− as Se source, and Ag+ as Ag source. (b) Time-dependent cellular uptake of (Cys-Se)2 and SeO32−. (c) Photograph of cells incubated with (Cys-Se)2 or SeO32−. (d) High-angle annular dark field scanning transmission electron microscopy (HAADF-STEM) images and energy dispersive X-ray spectroscopy (EDS) mapping of Se nanoparticles in cells incubated with (Cys-Se)2 (upper) or SeO32− (lower) for 2 h.
本文基于团队提出的“时-空”耦合策略,在小鼠乳腺癌细胞4T1中实现了Ag2Se量子点的合成。实验结果表明,相较于硒代蛋氨酸(SeMet)和硒(甲基)硒代半胱氨酸(SeMC),采用(Cys-Se)2合成的量子点荧光强度显著提升。该现象源于(Cys-Se)2中Se-Se键的键能(172 kJ/mol)低于SeMet和SeMC中Se-C键的键能(244 kJ/mol),这种键能差异使得(Cys-Se)2更易被代谢还原为活性硒前体,从而促进胞内量子点的合成。此外,与传统合成体系中的SeO32−相比,(Cys-Se)2不仅具有更高的细胞摄取效率,还可避免还可避免硒源因过早形成硒纳米颗粒而导致的利用率降低,最终使细胞合成量子点的荧光提升2.1倍。
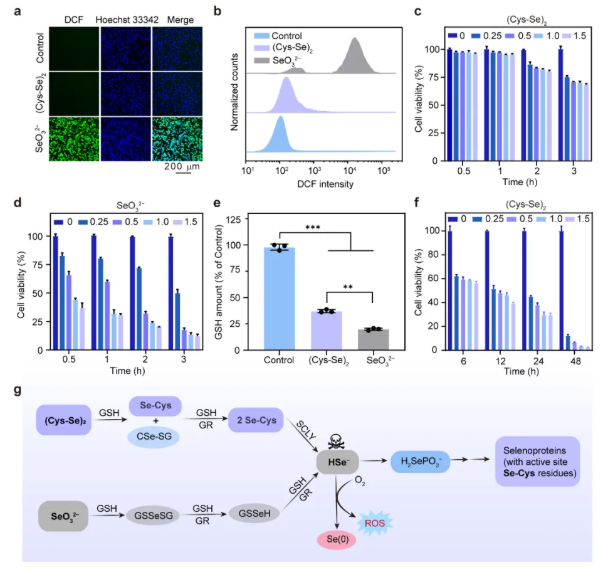
当(Cys-Se)2与细胞孵育2小时后,胞内未检测到ROS特异性荧光信号。在相同孵育时长条件下,(Cys-Se)2的细胞毒性显著低于SeO32−。但值得注意的是,当孵育时间延长至6小时后,(Cys-Se)2同样可引发显著的细胞毒性并伴随硒纳米颗粒生成。这些结果表明,与SeO₃²⁻类似,(Cys-Se)₂也可通过代谢还原生成HSe⁻等细胞毒性中间体。分析其代谢途径可知:(Cys-Se)₂优先被代谢还原为Se-Cys,再转化为HSe⁻。这种时序性代谢特征为精准调控胞内量子点的合成提供了关键窗口期:在(Cys-Se)处理2小时后及时引入银源AgSG,可有效捕获Se-Cys合成Ag2Se量子点,阻断Se-Cys向HSe⁻的转化,进而避免因ROS爆发导致的氧化损伤。
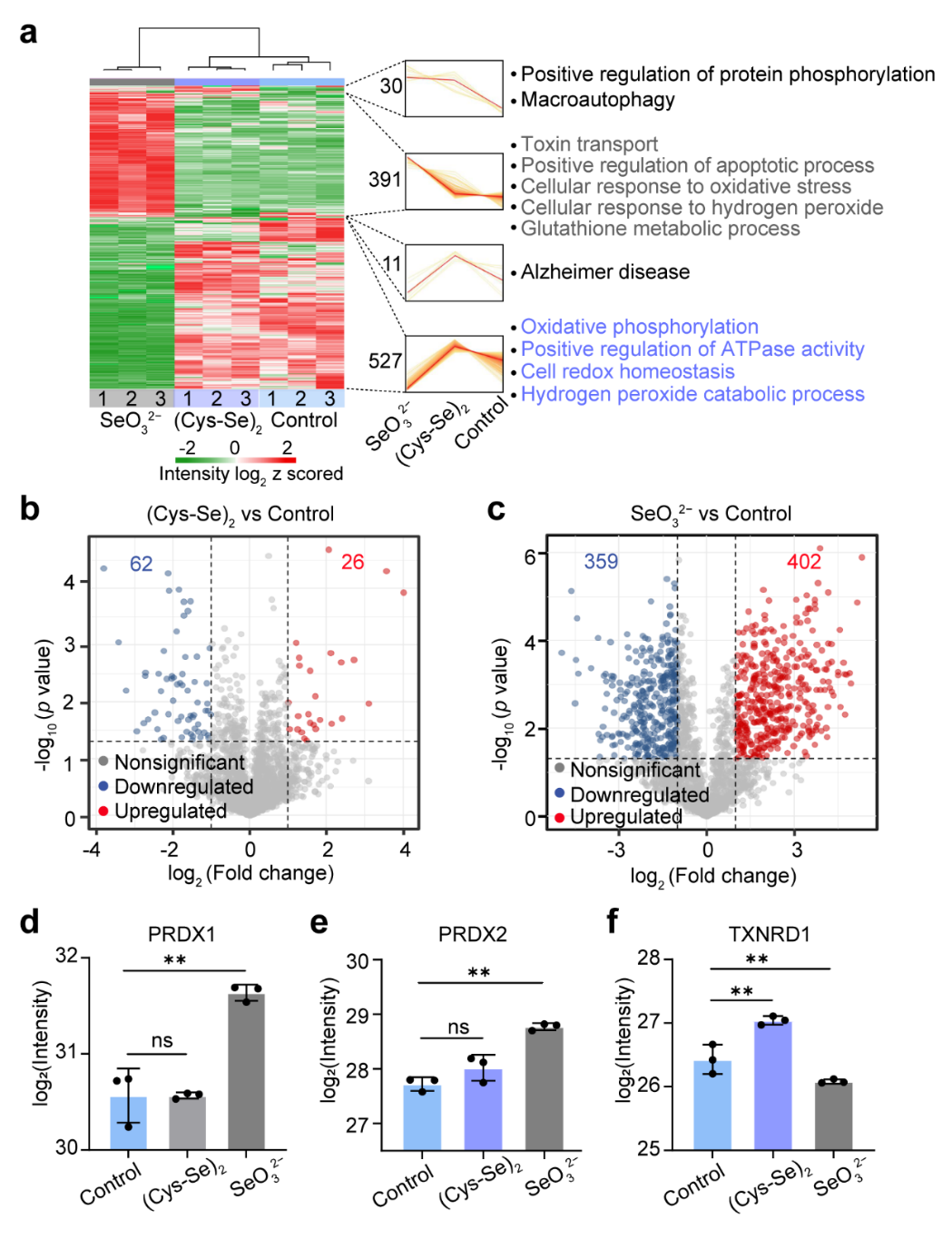
Figure 3. Effect of (Cys-Se)2 and SeO32− on cellular protein expression. (a) Hierarchical clustering of 959 differentially expressed proteins. Protein counts, selected pathways and biological processes were annotated in each cluster. (b,c) Volcano plots comparing protein expression levels between (Cys-Se)2 and control groups (b), and SeO32− and control groups (c). Color-coded dots represent significantly altered proteins (fold change > 2) based on two-sided t-test (adjusted p value < 0.05 by Benjamini-Hochberg method). (d-f) Expression levels of selected proteins associated with oxidation-reduction processes. p values were calculated via Student’s t test: ns (non-significant) = p > 0.05, *p < 0.05, **p < 0.01.
通过蛋白质组学分析了(Cys-Se)₂与SeO₃²⁻代谢过程对细胞蛋白质表达谱的影响。层次聚类分析表明:在2小时孵育条件下,(Cys-Se)₂处理组的蛋白质表达谱较SeO32⁻处理组更为稳定,差异表达蛋白主要富集于与氧化还原调控及能量代谢通路。关键抗氧化蛋白表达分析显示,(Cys-Se)₂处理组中PRDX1, PRDX2, GPX1, SOD2, CAT 和 SELF的表达水平均未发生显著变化,而SeO32⁻处理组则引发上述蛋白的显著上调或下调。值得注意的是,在含Se-Cys活性中心的硒蛋白(TXNRD1、GPX1、SELF)中,仅TXNRD1在(Cys-Se)₂处理后呈现显著上调,而SeO32⁻处理则导致下调。这种差异性表达与细胞内氧化还原稳态的变化相关:(Cys-Se)₂的代谢消耗了细胞内GSH,优先激活了TXNRD1等抗氧化硒蛋白的表达以重建氧化还原稳态;而SeO32⁻处理导致GSH耗竭与ROS爆发,尽管已经上调了过氧化物还原酶PRDX1/PRDX2以发挥抗氧化保护作用,但过量ROS仍可诱导蛋白质降解。该调控机制解释了SeO32⁻处理组中TXNRD1等抗氧化蛋白表达下调的现象。以上实验结果进一步证实,(Cys-Se)₂代谢生成低价态活性硒前体的过程中,能够维持细胞氧化还原稳态,这种稳态的维持将有效促进下一步胞内量子点的合成。
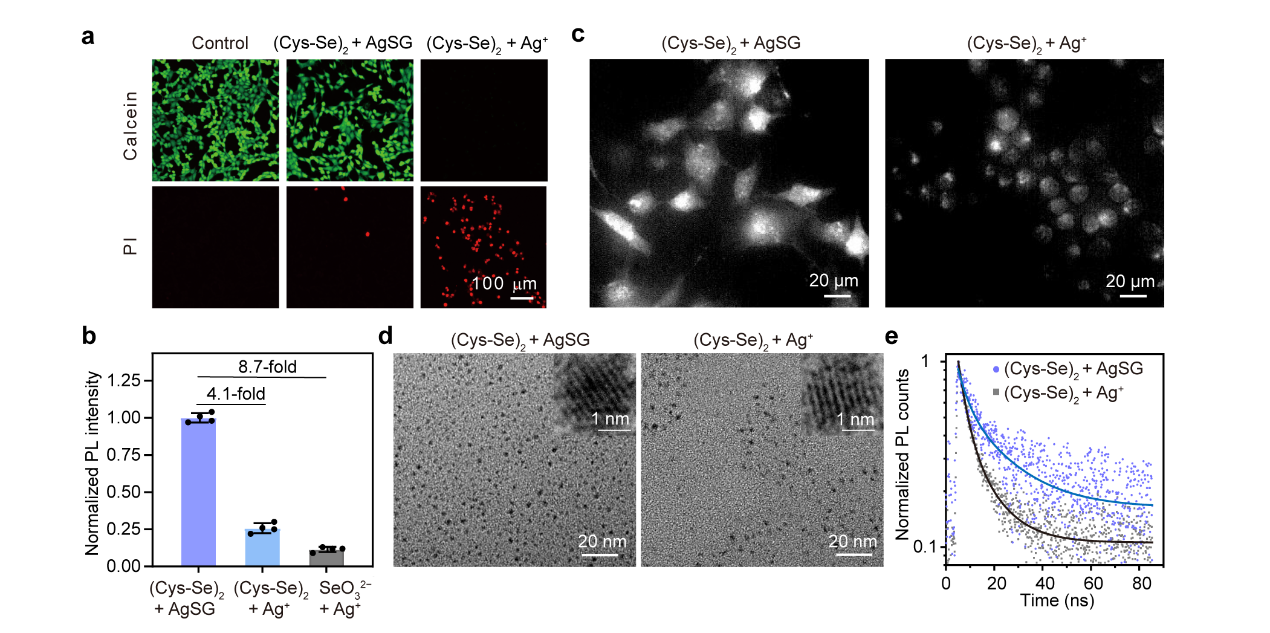
Figure 4. Characterization of Ag2Se@cells and Ag2Se QDs. (a) Fluorescence images of Calcein-AM- and PI-stained Ag2Se@cells or PBS-treated control cells. (b) Fluorescence intensity of Ag2Se@cells. (c) NIR-II fluorescence microscopic imaging of Ag2Se@cells. (d) In-situ TEM and high-resolution TEM (HRTEM) images of Ag2Se QDs in cells. (e) Transient PL spectra of Ag2Se QDs.
游离Ag⁺易与生物分子发生非特异性结合或被还原,进而诱导细胞坏死性死亡。为此,本文通过引入GSH与Ag⁺配位形成AgSG以调控胞内Ag⁺释放。实验表明:在等浓度条件下,AgSG的细胞毒性显著低于游离Ag⁺。将Ag⁺替换为AgSG进行Ag₂Se量子点活细胞合成时,细胞活力从4%提升至80%。以(Cys-Se)₂为硒源,系统优化了GSH/Ag⁺摩尔比发现:当GSH/Ag⁺=1时,细胞荧光强度达到峰值,较(Cys-Se)₂/Ag⁺体系增强4.1倍,较传统SeO₃²⁻/Ag⁺体系增强8.7倍。当GSH/Ag⁺>1时,过量GSH与Ag⁺的强配位作用导致前体反应活性降低,阻碍胞内Ag₂Se量子点的合成。
透射电镜表征显示,采用AgSG和Ag⁺合成的量子点均呈单分散球形(平均粒径2.3 nm),其0.24 nm晶格间距为与β-Ag₂Se正交晶系(013)晶面匹配。吸收光谱表明, AgSG组量子点的吸光度值显著高于Ag⁺组,表明胞内量子点数目增多。另外,时间分辨光致发光光谱分析显示,AgSG组量子点荧光寿命延长且短寿命组分占比降低,推测该现象是由于入胞的GSH作为硫醇配体钝化量子点表面缺陷态,有效抑制了非辐射复合过程。综上,AgSG的引入同步提升了量子点合成效率与发光性能。
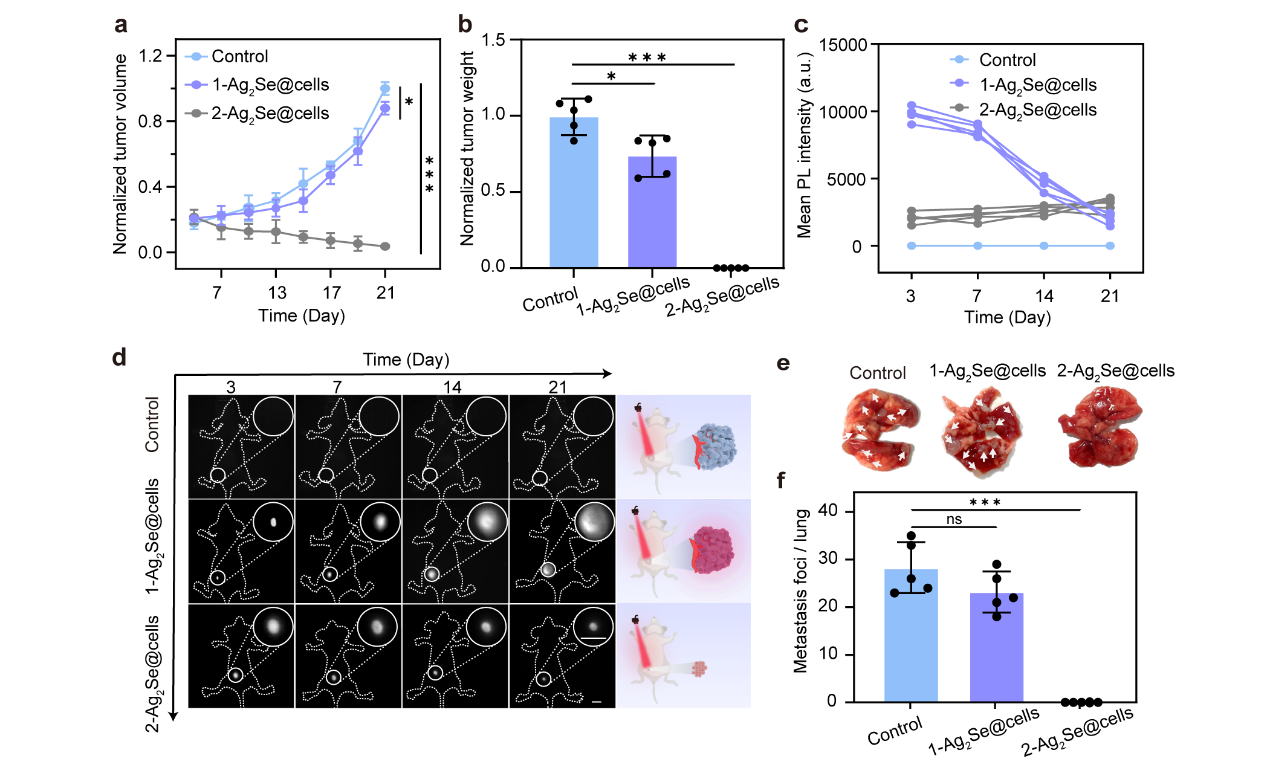
通过构建小鼠乳腺癌活体模型,系统评估了荧光细胞在活体水平的生物学行为。将不同处理的4T1细胞移植于小鼠皮下形成三组实验模型:1-Ag₂Se@cells组((Cys-Se)₂/AgSG体系合成量子点)、2-Ag₂Se@cells组(SeO₃²⁻/Ag⁺体系合成量子点)及PBS处理的对照组。实验结果显示,1-Ag2Se@cells组细胞保持良好的成瘤能力,其肿瘤体积增长速率较对照组略有延迟,而2-Ag2Se@cells组则完全丧失致瘤性。NIR-II荧光监测表明,1-Ag2Se@cells组总荧光强度显著高于2-Ag₂Se@cells组,且荧光信号在21天观察期内保持相对稳定。随着肿瘤细胞的增殖,量子点分布呈现渐进性扩散特征,单个细胞中量子点的密度降低,荧光区域逐渐扩大,表明细胞分裂导致量子点代际稀释。与之形成对比,2-Ag2Se@cells组荧光区域逐渐缩小,提示死亡细胞被巨噬细胞等免疫细胞逐步清除。此外,1-Ag2Se@cells组小鼠肺部可见明显转移结节,而2-Ag2Se@cells组未观察到转移灶。以上结果充分说明,基于(Cys-Se)₂/AgSG体系的生物相容性调控策略,在赋予细胞稳定NIR-II荧光功能的同时,仍保留了肿瘤细胞的增殖、成瘤、侵袭和转移等生物学特性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn