

导师介绍:

陆展,浙江大学教授,有机与药物化学研究所所长。于2008年在浙江大学化学系获得博士学位,随后赴美国威斯康辛大学麦迪逊分校进行博士后研究。2012年底以特聘研究员加入浙江大学化学系,开展独立科研工作,2018年获评教授。陆展教授主要致力于基于配体设计的低价态铁系金属催化剂催化的氢官能团化反应研究和可见光催化反应研究。陆展教授在Nat. Catal, Chem, J. Am. Chem. Soc., Angew. Chem. Int. Ed.,Nat. Commun等国际著名学术期刊上发表论文120余篇,被他引7000余次,撰写英文章节6章,获授权中国发明专利20余项,部分配体已被多家公司商品化,先后获国家高层次人才青年项目、国家基金委优青项目(结题优秀)等资助。曾任或现任中国化学、有机化学、大学化学等编委,兼任中国感光学会、中国化学会、中国化工学会等理事或专业委员会委员。
课题组链接:https://person.zju.edu.cn/lu
浙江大学陆展课题组致力于低价态铁系金属催化的氢官能团化反应研究。近日,该课题组在Nature Communications上报道了铁催化的含硅烷烯烃与炔烃的高区域选择性、对映选择性与非对映选择性的程序化硅氢化反应。
研究背景:“碳硅替代策略”是开发新型材料、药物与农药的创新型策略,近几十年来受到了广泛的关注。四氢萘等苯并五环与六环结构广泛存在于药物与天然产物中,通过“碳硅替代策略”合成苯并硅杂环类的四氢萘硅类似物可能促进生物活性分子的开发。因此建立苯并硅杂环的合成方法学具有较高的研究与应用价值。
挑战性:尽管苯并硅杂环的合成方法丰富多样,但是构建含可进一步衍生化的SiH2结构的苯并硅杂环以及在温和条件下发散性、系统性地构建五元、六元与七元苯并硅杂环仍然存在挑战性:(1)氢化、分子间硅氢化反应和Si–H键的过度氢官能化等副反应会严重影响含有两个Si–H键的苯并硅烷基环的制备。(2)与C–C键相比,C–Si键的键长更长,过渡态更不稳定,这给区分两个对映异构体带来了更多困难。(3)反应需按照一定顺序进行,反应体系中存在多个活性Si–H键和不饱和C–C键,这使得反应面临着兼容性和选择性控制的挑战。
文章亮点: (1)利用铁催化剂通过分子内硅氢化反应构建二氢苯并硅杂环与碳硅双手性苯并硅杂环。(2)通过程序化硅氢化的策略发散性构建苯并硅杂环化合物。(3)通过替换简单易得的炔烃底物,快速构建多样化苯并硅杂环化合物。
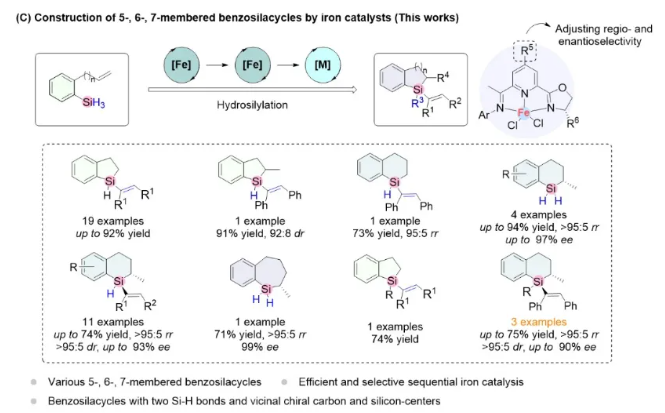
图一:多样化合成苯并硅杂环化合物
这一重要成果近日以“Iron-Catalyzed Sequential Hydrosilylation”为题发表于国际知名期刊Nature Communications。浙江大学化学系王雪博士,赵家金博士为文章共同第一作者。本文的其他作者上海有机所邓亮研究员与王东阳博士参与了衍生化部分的研究。浙江大学陆展教授为文章通讯作者。感谢课题组其他成员对课题开展提供的帮助。感谢上海有机所邓亮研究员与王东阳博士在实验中给予的帮助;分析测试平台的刘继勇老师在X射线晶体分析测试中提供的帮助;吴露玲,刘雅琴在NMR测试中提供的帮助;何巧红,施蒂儿老师在ESI和ICP-MS测试中提供的帮助。该工作得到了国家重点研发计划、国家自然科学基金、浙江省自然科学基金、新疆有机硅功能分子与材料重点实验室等项目的大力支持。
文章链接:https://doi.org/10.1038/s41467-025-59364-3; Nature Communications2025, 16, 4338.
背景介绍
自1899年被发现以来,碳正离子(carbenium ions)因其独特的电子结构和高反应活性一直是有机化学研究的核心课题之一。然而,如何实现对碳正离子参与的化学转化过程中化学选择性,区域选择性和立体选择性的精准调控,一直是该领域颇具挑战性的科学难题。虽然通过共振稳定或杂原子稳定的碳正离子通常可以实现较好的反应选择性,但缺乏此类稳定作用的碳正离子体系,其不对称转化反应仍鲜有报道。近年来,List(图1A)、Jacobsen(图1B)和Nelson等课题组通过调控烯烃质子化和C-X(X = Cl, O)键裂解产生的碳正离子中间体,成功实现了高对映选择性转化。在这些开创性工作中,手性催化剂通过与抗衡阴离子或试剂产生非共价相互作用来创造手性环境,从而实现了亲核试剂对碳正离子的对映选择性进攻。尽管取得了这些突破性进展为碳正离子化学开辟了新方向,但利用简单C(sp3)-H键直接作为碳正离子前体,进行不对称转化的研究仍处于起步阶段,其反应机制和选择性控制策略亟待深入探索。
惰性C(sp3)-H键由于其较高的键解离能(BDE)和较弱的极性特征,导致其活化过程面临巨大挑战。相较于传统的烯烃质子化和C-X键裂解过程,实现其选择性活化并高效转化为碳正离子更为困难。这一科学难题可追溯至1883年Hofmann发现的Hofmann-Löffler-Freytag(HLF)反应,该反应通过1, 5-氢原子转移(HAT)过程实现C(sp3)-H键的选择性活化。近十年来,研究者通过结合HAT和氧化自由基-极性交叉(ORPC)过程来产生碳离子中间体,并实现了C(sp3)-H键的官能团化反应。然而,该领域的发展仍面临显著挑战,特别是在其对映体选择性控制方面(图1C)。主要挑战包括:(1)前手性碳正离子中间体因其平面对称性导致其两个反应面难以有效区分,这降低了反应实现高对映体选择性的可能性;(2)碳正离子的高反应活性使得在无催化剂条件下,亲核进攻也能自发进行,从而产生难以抑制的外消旋背景反应;(3)碳正离子和手性催化剂之间的作用关系难以捉摸,特别是在氧化还原环境中。
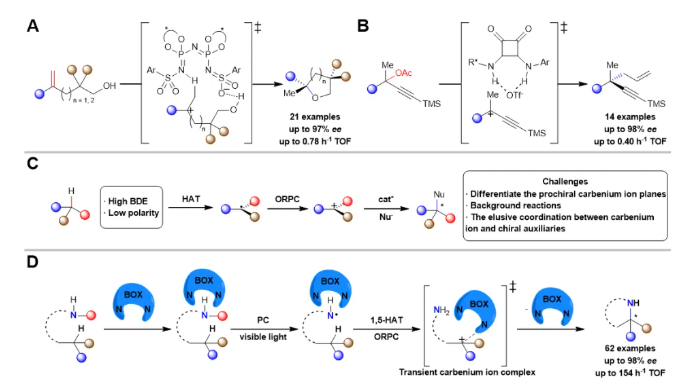
图1 碳离子对映体控制转化的研究进展
文章亮点
针对上述挑战难题,浙江大学陆展团队开发了一种新型的光/有机小分子协同催化不对称HLF型反应,使用手性双噁唑啉(BOX)作为有机催化剂,反应生成了具有优异对映选择性的手性Evans辅基(图1D)。该方案显示出高反应活性和对官能团的广泛容忍性。此外,与洪鑫团队合作进行了深入的机理研究和DFT计算,揭示了双噁唑啉催化剂一方面通过氢键作用活化底物来提升反应速率;另一方面通过与碳正离子中间体的瞬态配位作用来控制反应的对映选择性。
图文解读
在确定了反应最佳条件后,该课题组研究了C(sp3)-H键酰胺化反应的底物范围和局限性(图2)。实验证明,该反应条件与广泛的芳基取代基兼容,包括苯环邻位、间位和对位上的给电子和吸电子基团,以及其他官能团,如受保护的苯酚和茴香基。该反应可扩展到4 mmol,而产率和对映体选择性没有下降。此外,吲哚、噻吩、苯并呋喃等杂环化合物产生了相应的对映选择性良好的产物。最后,尿素衍生物也被证明是一个合适的底物。
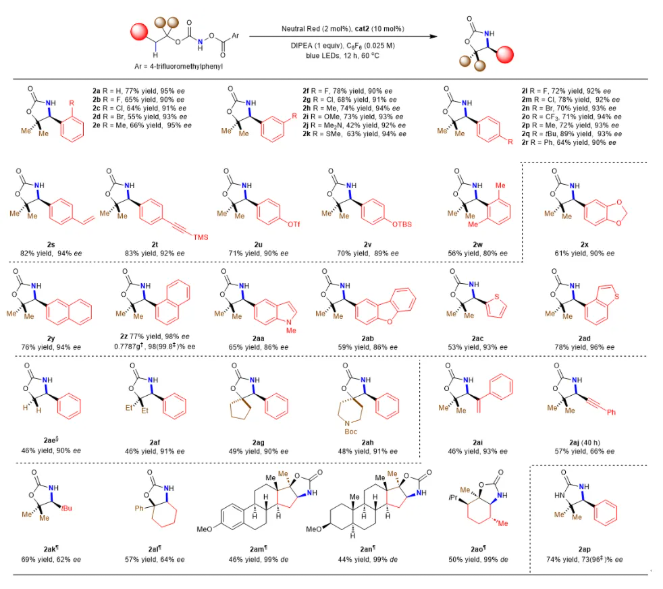
图 2 仲碳(sp3)-氢键的不对称酰胺化反应
通过使用BOX手性臂具有更富电子萘基的催化剂cat4,该方法还可以实现外消旋三级C(sp3)-H键的对映汇聚式酰胺化反应,从而构建季碳手性中心(图3)。当使用不同的给电子和吸电子取代苯基底物,反应也显示出较高的对映选择性。此外,该方法还可以用于构建手性螺环季碳中心。
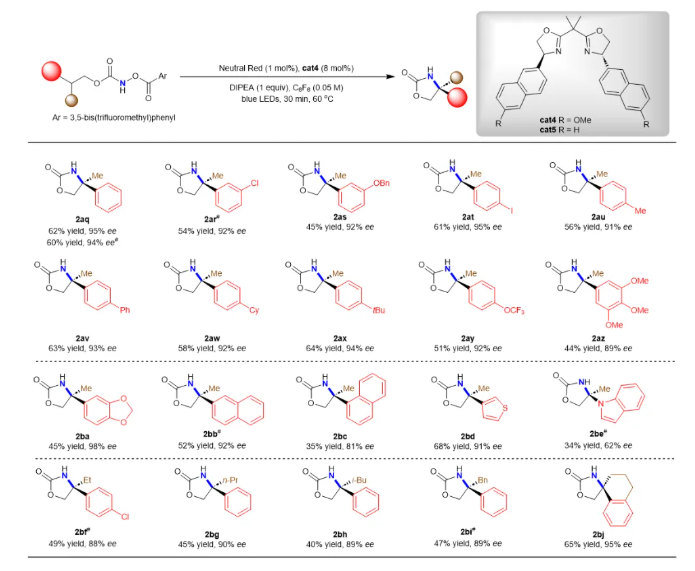
图3 叔碳(sp3)-氢键的对映体汇聚式酰胺化反应
作者将对照实验、同位素实验与DFT理论计算相结合,阐明该反应可能经历的催化循环如图4所示。首先光催化剂(PC)在蓝光照射下被激发为激发态PC*。底物1和cat2可以通过氢键相互作用形成复合物A,该复合物可被PC*物质还原,发生N-O键断裂形成氮自由基B。氮自由基B发生分子内1,5- HAT,产生苄基自由基C。该自由基又很容易被PC+氧化成苄基碳正离子D1。瞬态碳正离子复合物E可能是在BOX对苄位碳正离子中间体的热动力学捕获后生成的。通过DFT计算可以排除碳自由基被BOX捕获的途径。最终,该反应通过E的分子内对映选择性C-N键形成得到2a,并释放BOX。初步的理论研究详见原文。
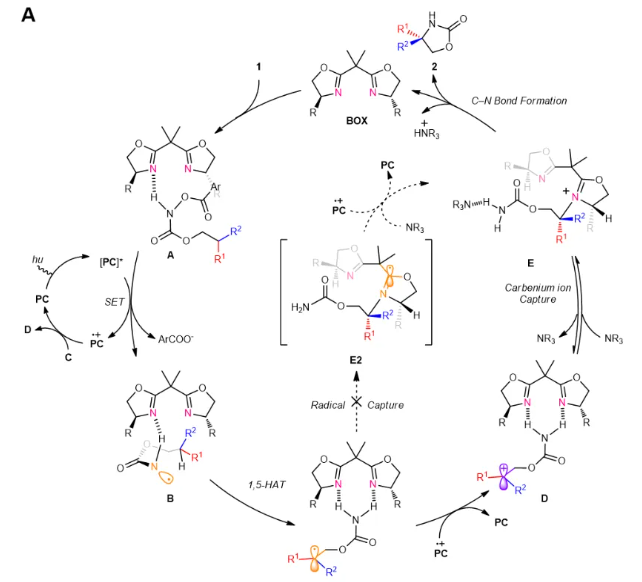
图4 可能机理
总之,陆展团队与洪鑫团队合作实现了可见光/手性双噁唑啉 (Box)协同催化的二级和三级碳氢键不对称酰胺化反应,构建具有重要合成价值的手性Evans辅基类产物,同时也提出了一个有效控制碳正离子不对称转化的催化模型。
这一重要成果近日以“Asymmetric Hofmann-Löffler-Freytag type reaction via a transient carbenium ion complex merging organocatalysis and photocatalysis”为题发表于国际知名期刊Nature Catalysis。浙江大学化学系郭启航博士,毛益辉博士,刘吉人博士为文章共同第一作者。本文的其他作者朱路静硕士也参与了计算化学方面的研究。浙江大学陆展教授、洪鑫教授为文章通讯作者。感谢课题组其他成员对课题开展提供的帮助。感谢分析测试平台的何巧红,蒋艳老师在ESI和ICP-MS测试中提供的帮助。该工作得到了国家重点研发计划、国家自然科学基金、浙江省自然科学基金等项目的大力支持。
文章链接:https://doi.org/10.1038/s41929-025-01329-2
在有机化学与药物化学领域,发展高效合成策略构建含氟季碳手性中心一直是研究热点之一。含氟有机化合物凭借其独特的脂溶特性、代谢稳定性及显著的生物活性,已成为医药研发和农用化学品开发的重要结构单元。尽管不对称催化领域已发展出多种手性烷基氟化物的合成策略,但构建含氟季碳手性中心的方法仍然有限。相较于传统的不对称亲电氟化反应,α-氟代羰基化合物的不对称芳基化反应展现出独特优势,为构筑芳基取代的含氟季碳手性中心提供了新思路。然而,现有方法多集中于环状或双活化α-氟代羰基化合物的转化,相比之下,基于简单底物构建非环状α-氟代羰基化合物的高对映选择性转化体系仍有待突破。2014年美国加州理工学院的Gregory C. Fu教授课题组报道了一例镍催化双噁唑啉配体催化的外消旋非环状α-氟-α-溴代酮的对映汇聚式芳基化反应(J. Am. Chem. Soc.2014, 136, 5520–5524.),首次实现了非环状简单酮类化合物羰基α-位含氟季碳手性中心的构建。尽管不对称镍催化领域已取得显著进展,但脱溴副反应仍严重影响反应产率,且对含有大位阻仲烷基取代基或含杂环结构的α-氟-α-溴代酮的交叉偶联反应,目前尚未建立合适的催化体系。
浙江大学化学系陆展教授课题组一直致力于基于手性配体设计的低价态铁系金属精准催化合成(Acc. Chem. Res. 2021, 54, 2701–2716.)。围绕低价态铁系金属精准催化合成,系统提出了“氧化还原活性、含氮多齿配位、非对称性”的手性配体设计理念,设计并构建了一系列适合铁、钴的新型非C2对称含氮三齿手性配体(Chiral Unsymmetric Tridentate (CUT) NNN ligand)及其钴、铁配合物,实现了一些铁、钴催化不饱和烃类的高选择性反应,并拓展至钴催化不对称偶联反应领域,这些结果为解决丰产金属催化反应的催化效率及选择性控制等关键科学问题提供了一些新思路和新方法。
近日,陆展课题组联合香港大学何健课题组基于此前发展的钴/亚胺苯基噁唑啉苯基胺(IPOPA)配体催化体系(J. Am. Chem. Soc.2023, 145, 24958–24964.),实现了α-溴-α-氟代酮与芳基/烯基锌试剂的不对称Negishi偶联反应,成功构建了含氟季碳手性中心。氟原子的引入显著改变了活性自由基的亲核性导致反应活性及选择性降低。作者通过对CUT配体的位阻效应调控,大幅提升了反应速率并有效抑制脱溴氢化副产物的生成。对照实验和动力学研究表明,与此前α-溴代酮的反应不同,该体系中转金属化是反应的决速步骤。
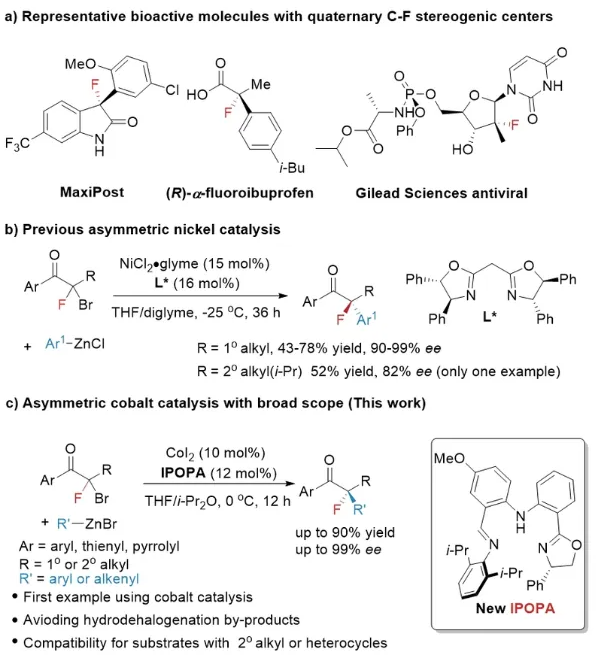
图1研究背景及钴催化α-氟-α-溴代酮的不对称芳基化/烯基化反应
作者首先对IPOPA配体进行了系统筛选,通过对配体空间位阻效应的改造大幅提升了反应的速率及化学选择性,随后经过电子效应修饰,反应的对映选择性进一步提升。在确定最优反应条件后,作者对底物适用范围进行考察,能以46-90%的收率,82-99% ee获得目标化合物。该反应体系有良好的官能团容忍性,能实现羰基β-位含仲烷基取代大位阻底物的高选择性转化,且能容忍噻吩、吡咯等杂环分子与文献报道方法形成互补。此外,作者还使用烯基锌试剂首次实现了α-氟-α-溴代酮的不对称烯基化反应。
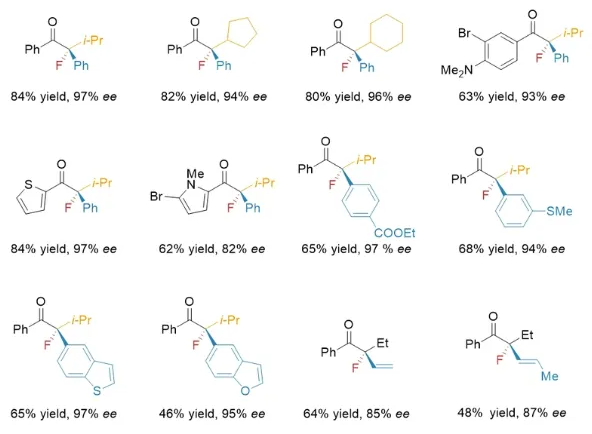
图2代表性底物
该反应可以顺利放大至克级规模,反应产物能转化为手性醇、芳香烃、酯等多类化合物。为验证该方法学的实用性,作者将该方法应用于α-氟代布洛芬的合成中。
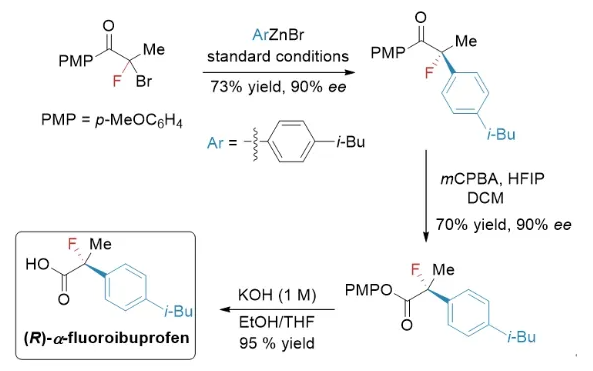
图3方法学应用
该反应的机理实验验证了反应的机制及决速步骤。通过自由基捕获实验验证了自由基中间体的产生,通过动力学实验证实卤化物未参与决速步骤,而催化剂与锌试剂则参与其中。通过系统研究不同配体的反应时间进程曲线(time course),发现随着配体结构位阻效应的减弱,反应速率显著提升。综合实验证据,作者认为转金属化是该反应的决速步骤。
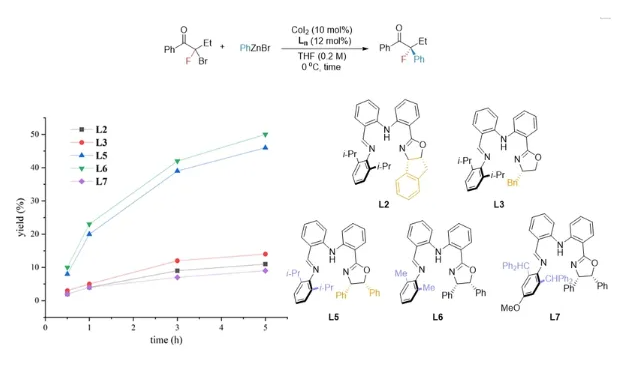
图4配体位阻对反应速率的影响
相关成果近日发表在Journal of the American Chemical Society上。浙江大学化学系博士生王鲸易(23级转博生)为本论文的第一作者,浙江大学陆展教授和香港大学何健教授为本文共同通讯作者。杨进(24级硕士生)完成了部分配体及底物的制备,产物衍生化拓展等工作。感谢课题组其他成员对课题开展提供的帮助。该论文受到了国家重点研发计划、国家自然科学基金和中央高校基本科研业务费等资金支持。
文章链接:https://doi.org/10.1021/jacs.5c03944
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn