


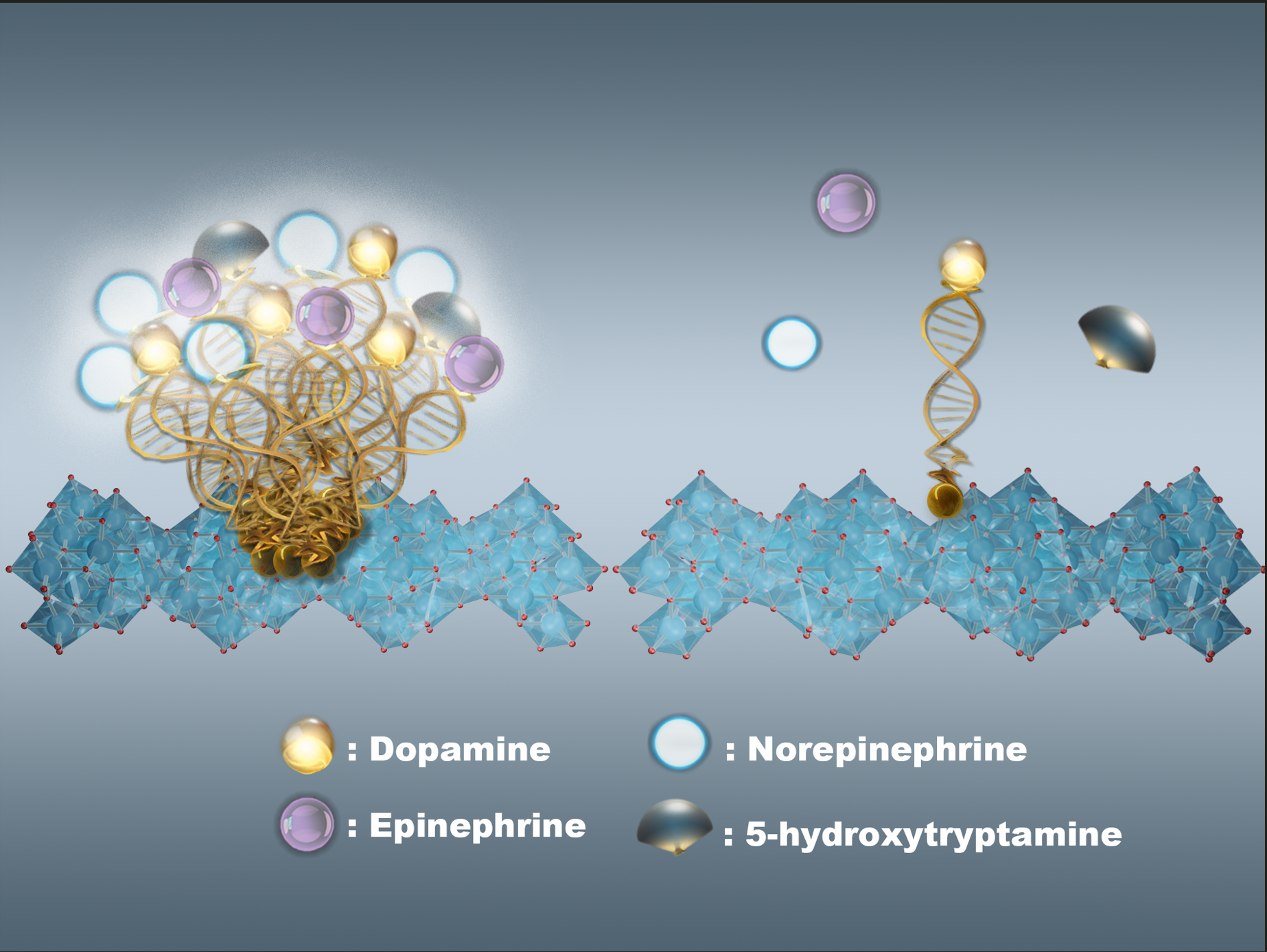
研究背景
传统适配体生物传感器因柔性高、易交联,常在电极表面形成“nano-bushes”结构,导致非特异性吸附,限制了其在结构相似分子(如神经递质)间的选择性识别性能。为打破这一技术瓶颈,研究团队提出:通过单原子级别锚定位点实现适配体单分子分散,提升分子识别的空间分辨率和选择性。
创新策略
研究构建了金单原子修饰的二氧化钛光电电极(Au SA/TiO₂),利用Au–S键连接多巴胺(DA)特异性适配体,从而构建出单分子适配体光电传感器(PEC-sm-aptasensor)。这一策略有效避免了传统金纳米颗粒上适配体交联的问题,实现了适配体的空间单分子化锚定,确保了DA识别的高选择性。
核心成果
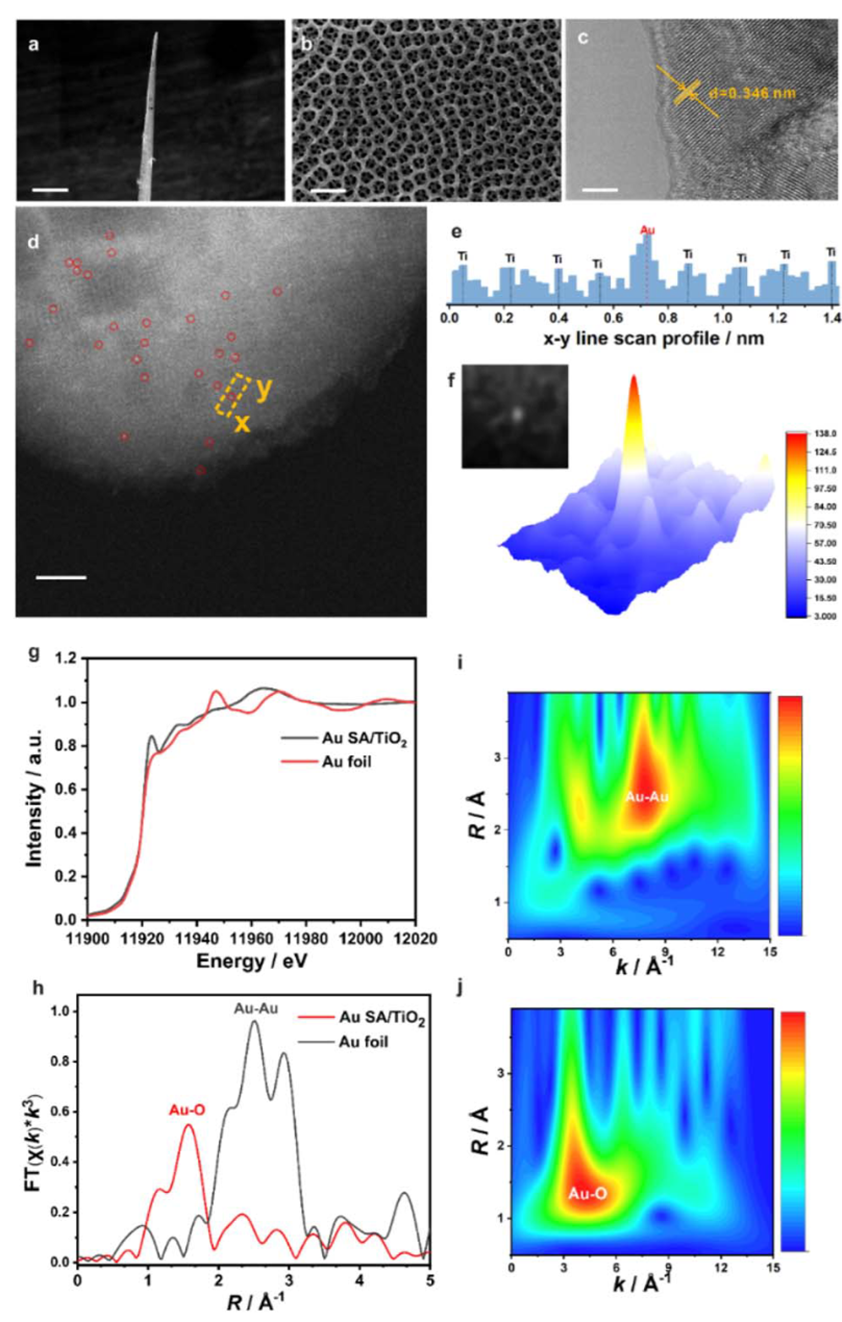
1.结构表征:确认单原子分布与特异性锚定机制
研究通过多种先进表征手段,如HAADF-STEM、XANES 和 EXAFS,系统验证了Au单原子在TiO₂载体上的分散状态。HAADF-STEM图像中清晰可见孤立的高Z值亮点,确认单原子态的存在;XANES白线增强与EXAFS中仅出现Au–O配位峰而无Au–Au信号,进一步排除金簇和纳米粒子的可能性。
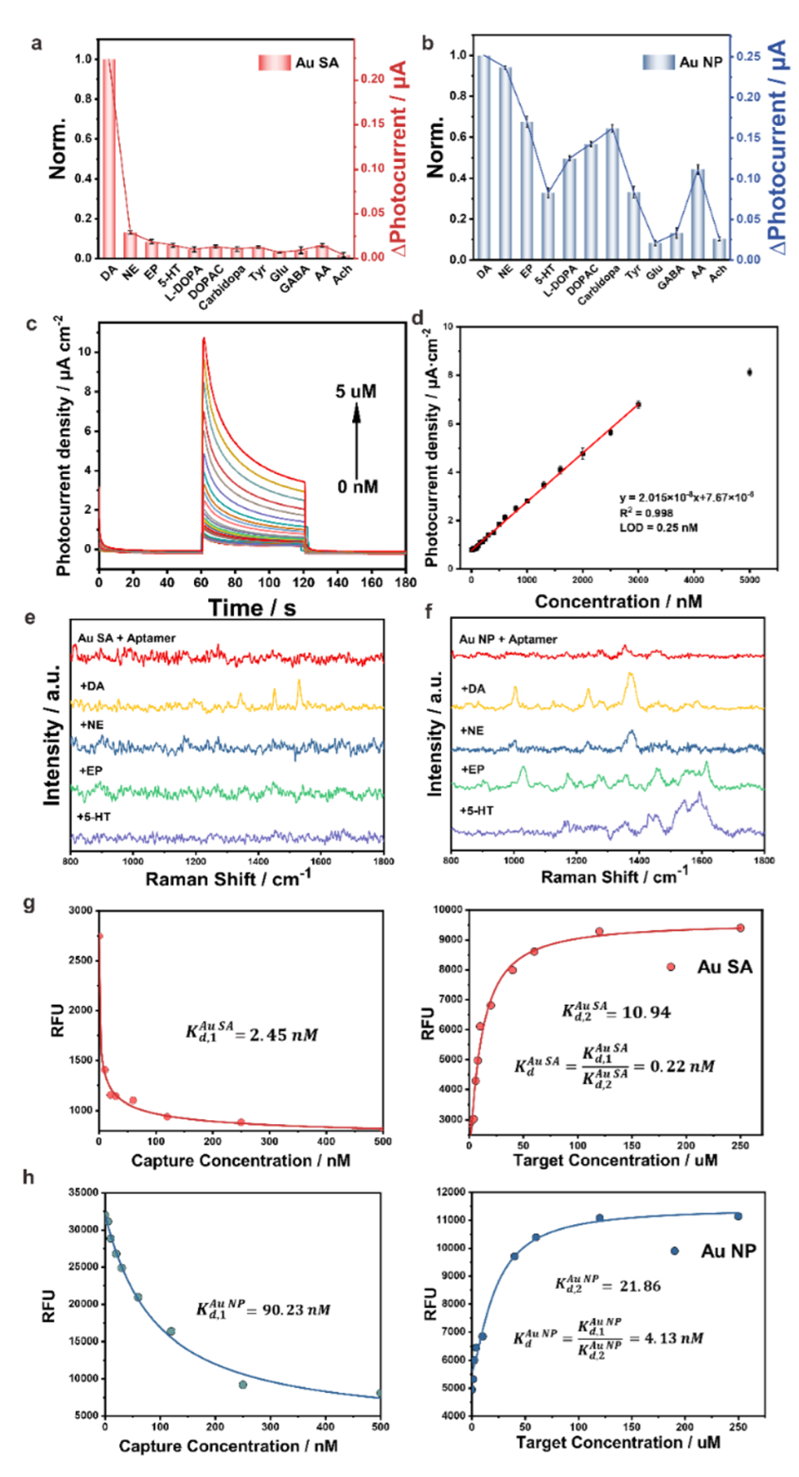
2.性能验证:显著提升选择性与检测灵敏度
该PEC-sm-aptasensor在PBS缓冲液中对多巴胺(DA)显示出良好的线性响应区间(2 nM 至 3 μM)与极低的检测限(LOD = 0.25 nM)。在富含抗坏血酸(AA)、5-HT、NE等干扰物的复杂体系中,也仍保持高信噪比。相比之下,传统Au NP/TiO₂平台因适配体交联形成“nano-bushes”,存在严重的非特异性吸附,导致对DA及其结构类似物无法有效区分。
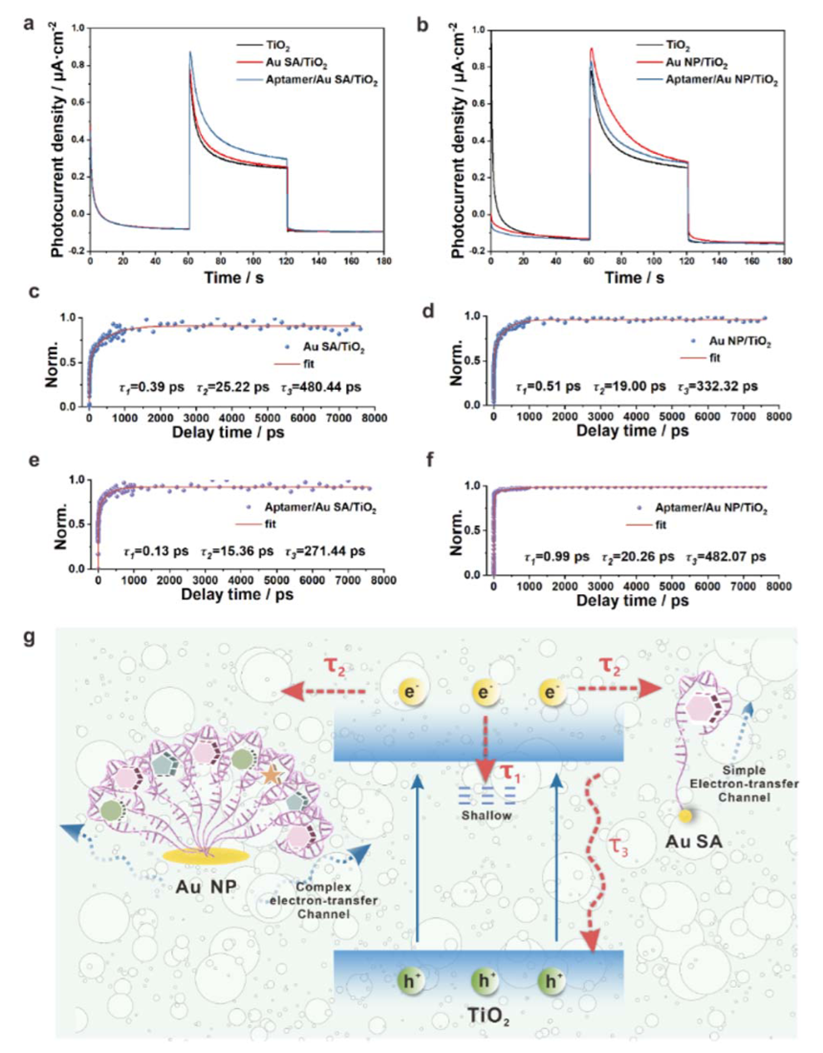
3.机制解析:单分子分布促进电子转移与信号增强
飞秒瞬态吸收光谱(fs-TAS)揭示,Au SA/TiO₂在负载适配体后,电子寿命参数τ₂和τ₃显著缩短,说明电子从TiO₂传递至Au SA再至适配体的通路顺畅,复合几率下降;而Au NP/TiO₂平台因适配体之间形成复杂网络结构,反而拉长电子寿命,表明电荷传输受阻。此外,PEC测试显示Au SA系统在NIR照射下具有更高的光生电流与更长的载流子寿命。该机制证实了“适配体单分子化”不仅提高选择性,也同步优化了检测信号质量。
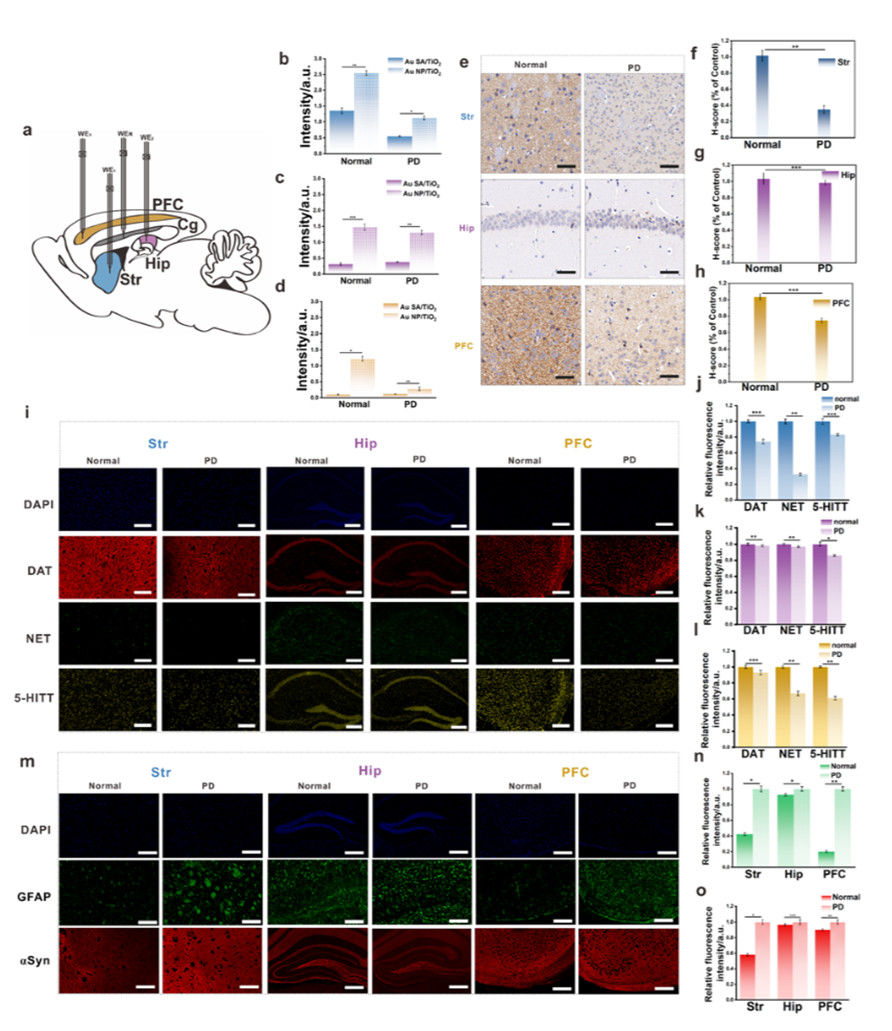
4.活体应用:解码帕金森病模型中DA真实动态
微型PEC传感器被成功植入小鼠不同脑区(Str、Hip、PFC)进行实时DA监测。研究首次揭示:在帕金森病模型小鼠中,尽管总体单胺类递质(包括NE、5-HT等)普遍下降,但前额叶皮层(PFC)中DA浓度却保持相对稳定。该发现颠覆了此前普遍认为“PD小鼠皮层DA显著下降”的观点,提示PD早期认知功能缺失可能并非由于DA下降,而与其他递质(如NE/5-HT)变化更为相关。

5.多实验验证:从组织、分子到行为的全链路证实
为验证PEC检测结果的可靠性,研究同时开展了多项验证实验:
o 免疫组化与免疫荧光:PFC中TH水平轻微下降但非显著,而5-HT转运蛋白(5-HITT)和去甲肾上腺素转运蛋白(NET)下降更为显著,验证PFC中非DA递质变化主导信号下降。
o GFAP和αSyn染色:PD小鼠Str与PFC中出现典型炎症反应与蛋白聚集,Hip区则基本无明显变化,与传感信号趋势高度一致。
o 行为学测试:PD小鼠在开放场实验中表现出典型运动障碍,但在时间顺序识别(PFC功能)与新物识别(Hip功能)实验中表现正常,进一步支持“PFC中DA未变,认知功能未损”的结论。
总结
本研究开创性地将单原子材料引入到适配体传感器构建中,通过单分子锚定策略大幅提升检测的选择性与灵敏度,成功实现多巴胺在复杂脑环境下的活体高保真检测。该策略不仅突破了神经递质检测的技术瓶颈,也为解析神经系统疾病(如帕金森病)中的神经递质动态提供了新的技术手段与认知路径。
作者简介
张中海教授,华东师范大学化学与分子工程学院、绿色化学研究中心,长期从事单原子催化材料与分子识别体系研究。近年来在Nat. Commun., PNAS, Angew. Chem., Adv. Mater., Joule, ACS Nano, Adv. Funct. Mater., Nano Lett., Anal. Chem.等国际著名学术期刊上发表高质量学术论文100余篇。文章他引超过7500次,H-index达到47。
课题组主页:https://faculty.ecnu.edu.cn/_s34/zzh2/main.psp
有博士后与博士研究生招聘计划,欢迎具有化学、材料、分析或生物背景的学生加入团队!
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn