


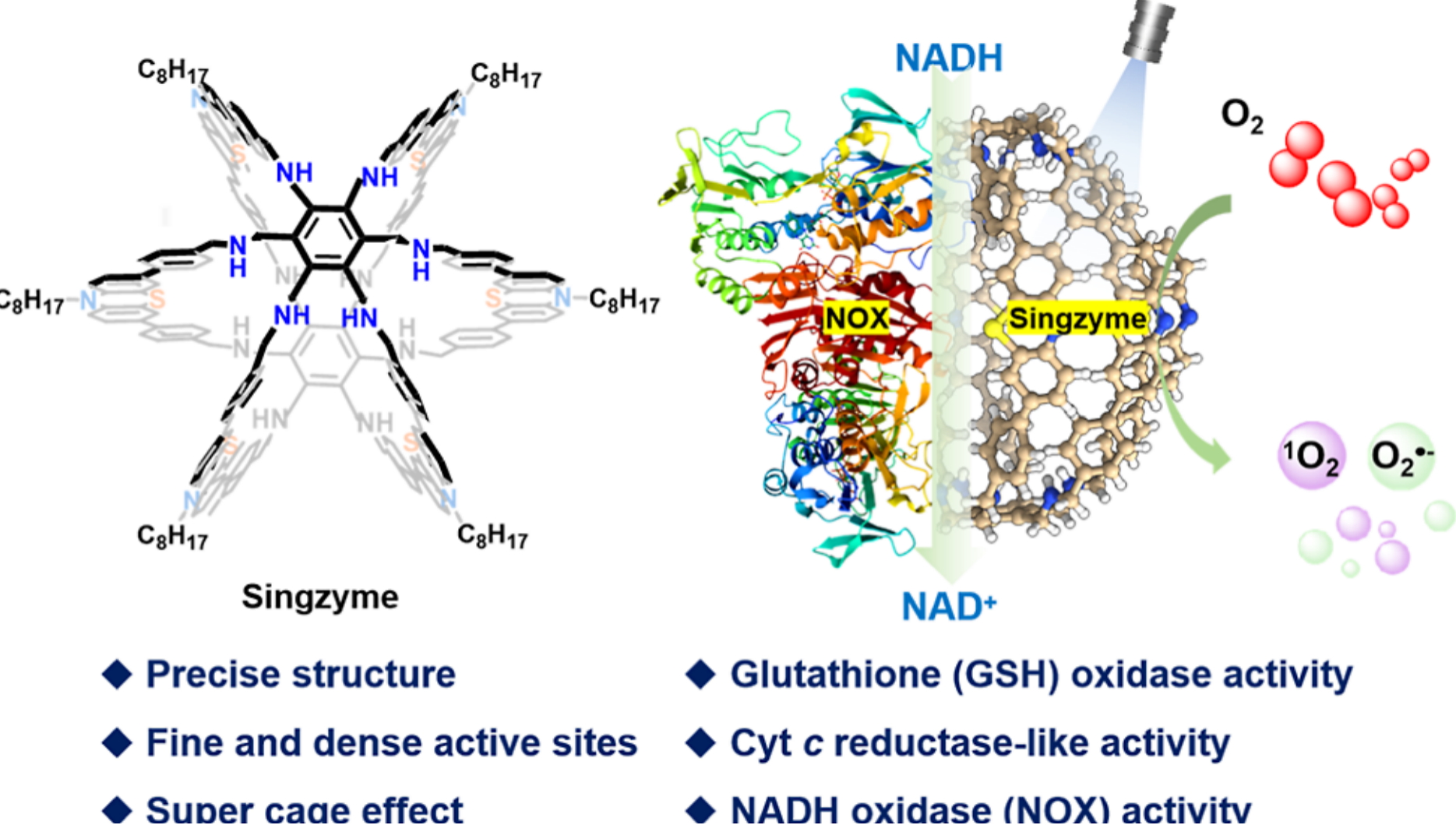

针对上述挑战,近日,湖南大学何清课题组基于超蕃功能分子体系发展了一类人工单分子类酶催化剂(简称单分子酶,Singzyme),实现了多功能酶模拟。在这项工作中,作者设计并合成了光敏超蕃1—一种独特的共价有机笼,其特征在于六个桥接单元连接两个平行苯环形成的笼状结构(图1d)。这种由六个光敏吩噻嗪单元构成的超蕃单分子酶,与吩噻嗪基的对照化合物(笼2、大环3和单体4)相比,表现出显著增强的光吸收能力、优异的光生电子分离能力和转移效率,并显著降低了光生载流子的复合(图2a)。作者将这种特殊的光敏性归因于“超笼效应”或“超蕃效应”,这是一种与已建立的聚合物和大环效应互补的增强机制。功能化后的吩噻嗪单元密集的排列形成了超蕃1的3D纳米级空腔,赋予其类酶行为,使其能够高效且有选择性地光催化氧化有机底物。在间歇性光照下,超蕃1模拟了NADH氧化酶(NOX)和谷胱甘肽氧化酶(GSHox)活性。这种双重类酶活性促进了NADH(一种关键的代谢辅助因子)和谷胱甘肽(癌细胞中的过表达物质)的靶向氧化,从而产生活性氧(ROS)并诱导氧化应激。上述类酶活性通过协同凋亡和铁死亡的途径导致癌细胞死亡,使超蕃1成为具有重要潜力的多功能分子平台,在光催化治疗和基于氧化还原的抗癌策略中具有重要意义。
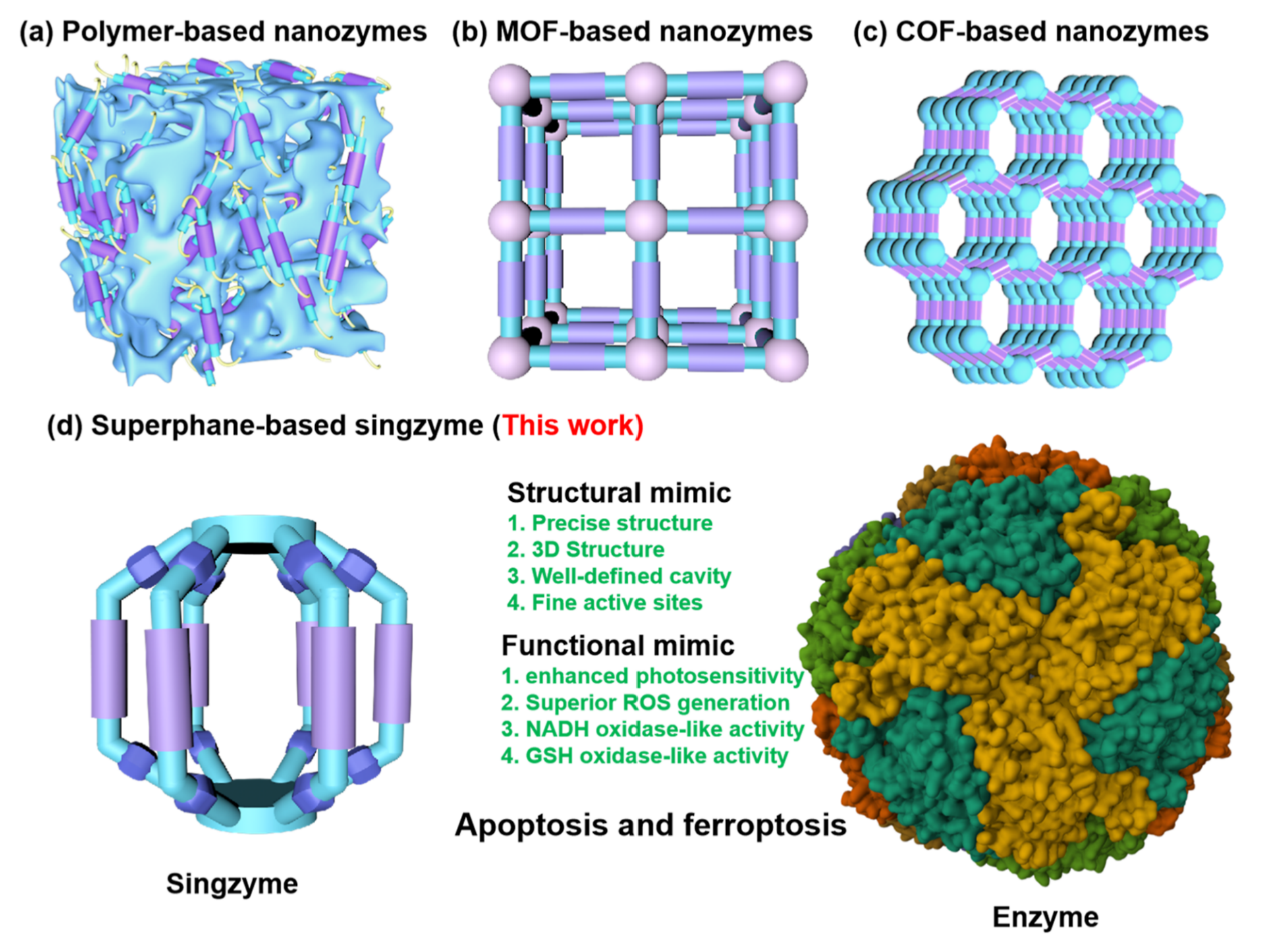
图1:通过将活性位点整合到(a)聚合物;(b)MOFs;(c)COFs中来获得类酶性质的典型策略。(d)基于超蕃的单分子酶的示意图(在本研究中报道)和球形硫加氧酶还原酶的俯视图。
自然界中,许多酶通过蛋白质单体或亚基协同组装形成的准封闭或全封闭空腔结构,实现精确的分子构型与催化功能。受这类结构的启发,作者通过将功能化的吩噻嗪单元引入超分子框架中来精确设计纳米级单分子类酶结构,并命名为“Singzyme”。 超蕃1中每个桥都使用功能化后的吩噻嗪,并添加C8碳链以增强化合物溶解度(图2a)。为了进行比较,作者合成了一系列对照化合物:含有三个吩噻嗪单元的笼2,含有两个吩噻嗪单元的大环3,和含有单个吩噻嗪单元的单体4。此外,X射线单晶衍射表明超蕃1呈灯笼状结构,两个苯环由六个含吩噻嗪的桥连接(图2c)。值得注意的是,该结构类似于球形酶,其核心尺寸高约2.0 nm,直径约1.6 nm。
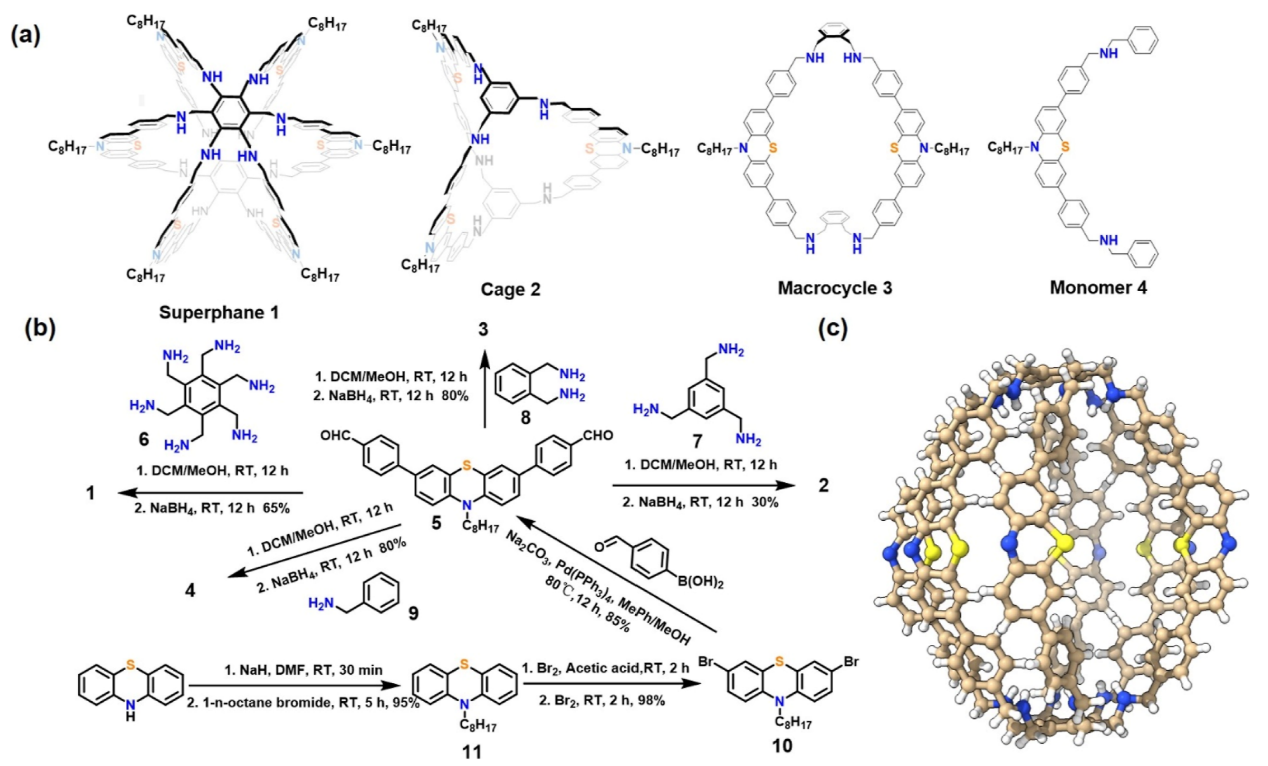
图2:(a)超蕃1和对照化合物笼2、大环3、单体4的结构;(b)超蕃1、笼2和大环3的合成路线;(c)超蕃1的单晶结构。
考虑到光敏吩噻嗪单元在超蕃1的腔周围密集排列,作者接下来研究了其光化学和电化学性质。如图3a所示,超蕃1的UV-Vis漫反射光谱显示出300 - 500 nm之间的吸收带。随着吩噻嗪单元的数目减少,吸收边带的逐渐蓝移。这种趋势表明超蕃1具有最高的光捕获能力。此外,固态颜色从超蕃1中的棕黄色转变为单体4中的浅黄色。
超蕃1的光学带隙(Eg)约为2.45 eV,显著窄于其他三种对照化合物(图3b),表明其具有增强的电子离域性。光致发光光谱(图3c)显示,随着吩噻嗪单体的增加,荧光强度下降,PL发射从480 nm逐渐红移到515 nm,同时谱带变宽。超蕃1的显著红移和增宽可能是由于共轭程度增加和电子相互作用增强。上述结果表明超蕃1可通过系间交叉(ISC)进行光诱导电子转移,这一过程有利于生成生物应用所需的活性氧物种。采用电化学阻抗谱(EIS)和光电流响应测试对超蕃1的电化学性能进行了研究。如图3d,e所示,EIS谱表明,与对照化合物相比,超蕃1最低的电阻值和最高的光电流响应表明其在电荷转移过程中具有最高效的载流子分离和迁移能力。同时超蕃1在六个照射周期内保持稳定的光电流响应,表明其在光照下能连续且稳定的电子-空穴产生。
通过Mott-Schottky曲线分析确定四种化合物均为n-型半导体(图3f)。这些化合物的导带电位与它们的平带电位非常接近。经标准氢电极校准后,超蕃1的导带电位为-0.47 V,笼2为-0.52 V,大环3为-0.53 V,单体4为-0.55 V。计算超蕃1的价带电位约为1.98 V,笼2为2.06 V,大环3为2.09 V,单体4为2.14 V。结果表明,这四种化合物都能够还原O2形成超氧自由基(O2•‑)。为了进一步评估这些光敏剂的ROS生成能力,作者使用DMPO和TEMP分别作为O2•‑和1O2的捕获剂进行ESR测试(图3g,h)。激光照射含有同样吩噻嗪当量的四种化合物的溶液时,由于“超笼效应”,超蕃1表现出最高的O2•‑和1O2产生速率。接着,作者采用循环伏安法,研究了这4种光敏剂的氧化还原性能。如图3i所示,每种光敏剂显示相似的可逆氧化峰,起始氧化电位从单体4到超蕃1逐渐降低,这表明超蕃1的氧化变得更加容易。
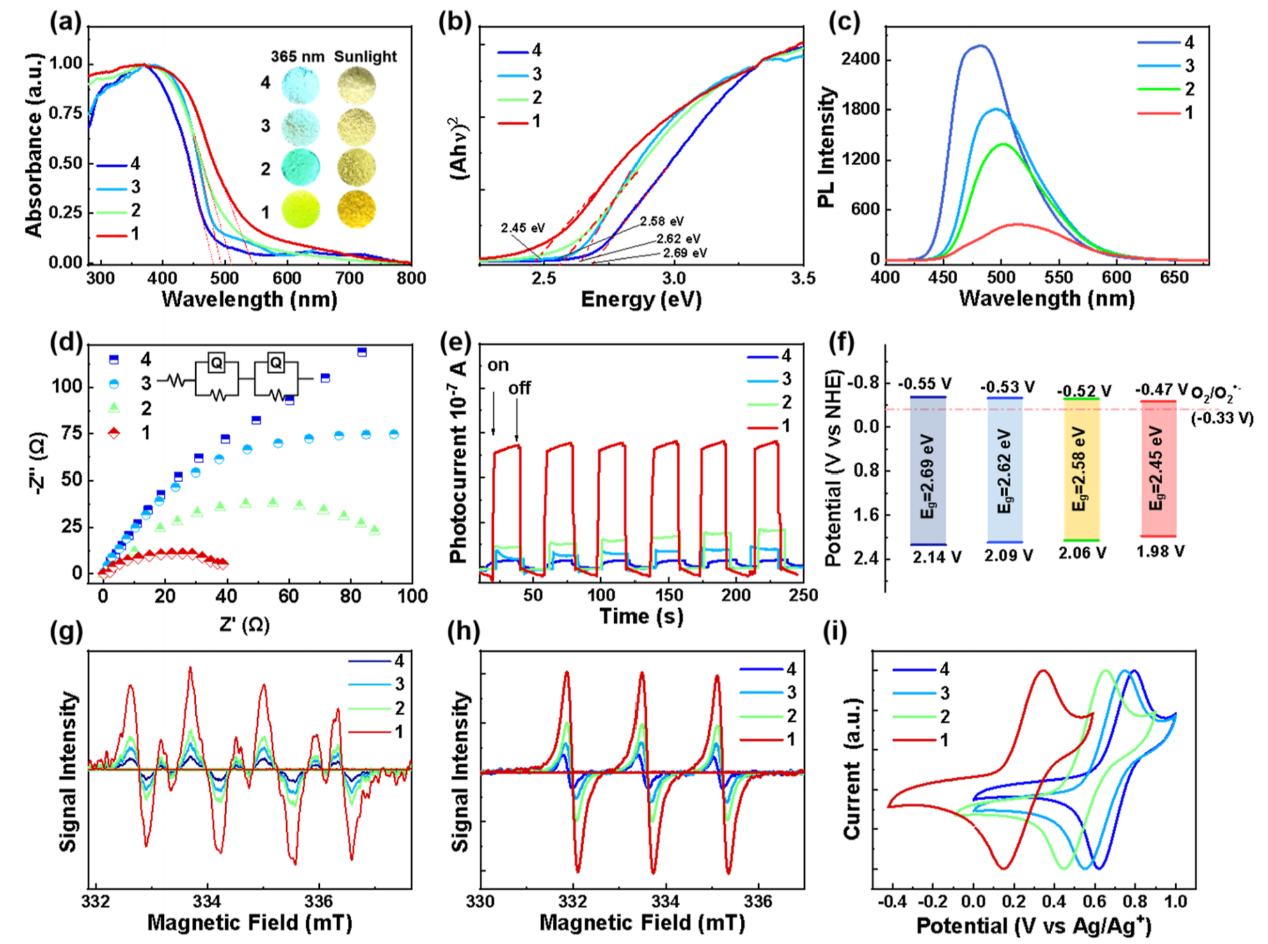
图3:超蕃1、笼2、大环3和单体4的光学和电化学性质。(a)UV-Vis漫反射光谱;(b)用于光学带隙估计的Tauc图;(c)光致发光光谱(Ex: 380 nm,狭缝宽度:5 nm/5 nm);(d)电化学阻抗谱(EIS)Nyquist图;(e)在可见光照射下的光电流测量;(f)经NHE校准后四种化合物的价带导带位置和光学带隙;(g)以DMPO作为捕获剂的ESR谱;(h)以TEMP作为捕获剂的ESR谱;(i)循环伏安图。
基于上述光化学性质,作者接下来探索了超蕃1在可见光驱动的氧化中的催化效率,即苄胺氧化偶联和硫醚氧化(图4a,b)。为了系统地评价“超笼效应”在催化效率中的作用,作者使用苄胺作为模型底物,对四种化合物进行了比较研究。在室温下照射12小时后,只有超蕃1表现出>99%的苄胺转化率(图4c)。超蕃1的周转数(TON)显著提高,分别是笼2、大环3和单体4的3.57倍、10.52倍和33.33倍,表明“超笼效应”在优化光催化效率方面的显著影响。为了阐明这种增强的催化作用的机理,作者使用各种清除剂和牺牲剂进行了一系列抑制实验。结果表明,O2•‑为驱动反应的主要ROS,而1O2起次要作用。这些结果进一步证实了光催化剂,光源和氧是不可缺少的组成部分。此外,作者还拓展了在优化条件下超蕃1对于氧化偶联的底物范围(图4a)。有机硫化物的光氧化是评估O2活化和1O2生成效率的典型模型反应。如图4b所示,在1 atm O2气氛下,用450 nm LED光源照射3 h,超蕃1有效地催化了硫醚氧化为亚砜,证明了其对污染物降解的潜力。相比之下,三种对照化合物的催化效率与苄胺氧化偶联中观察到的趋势一致,催化效率均显著低于超蕃1(图4c)。
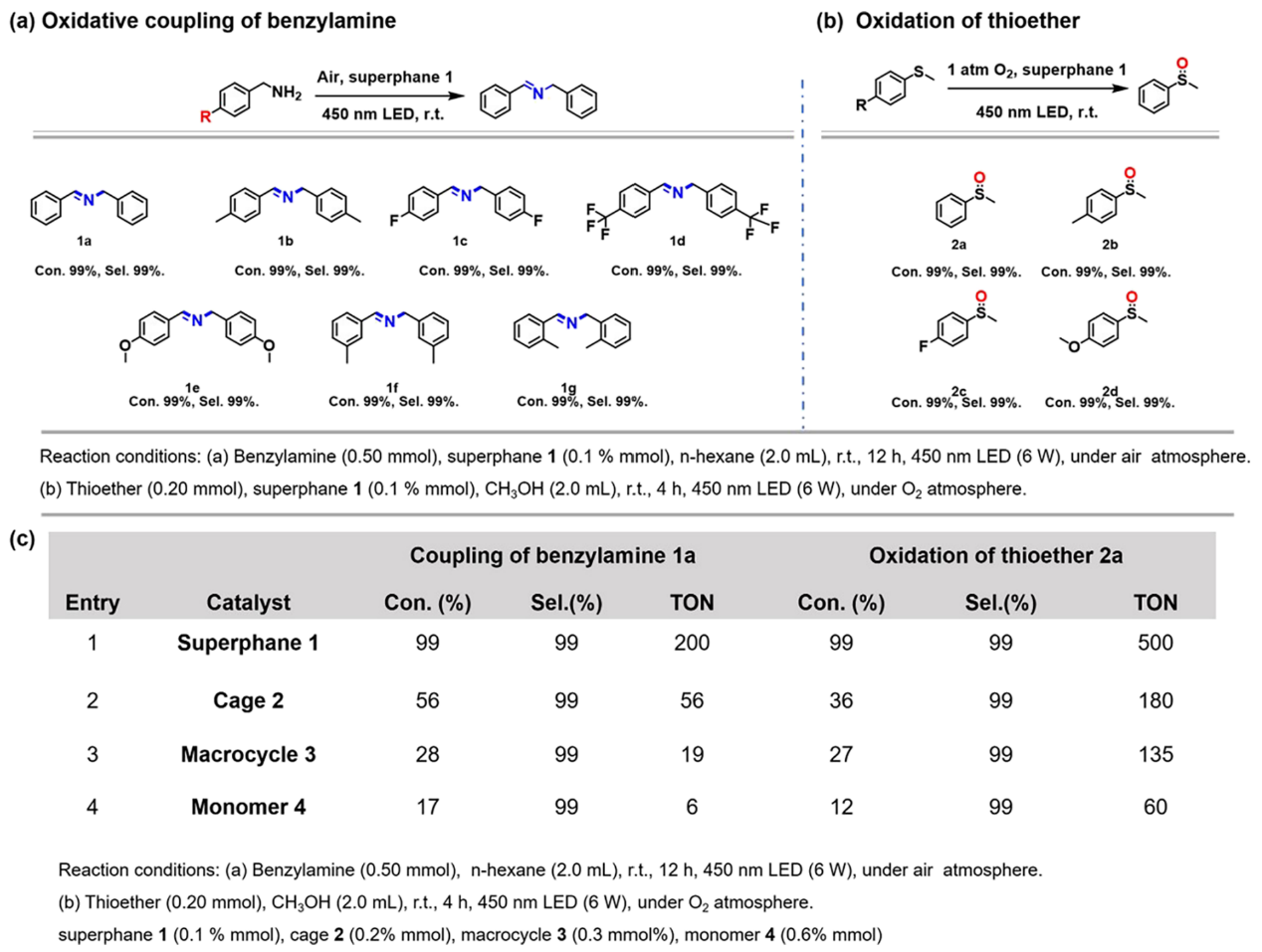
图4:四种化合物催化有机氧化反应的性能。(a)超蕃1对苄胺的光催化氧化偶联反应;(b)超蕃1对硫醚的光催化选择性氧化;(c)四种化合物在苄胺氧化偶联和硫醚氧化有机催化反应中的性能比较。
基于超蕃1在450 nm照射下产生O2•‑和1O2的卓越能力,并形成强氧化性自由基物质(superphane*),作者探索了其超越传统催化剂的更广泛的催化潜力。细胞内关键辅酶NADH和其氧化产物NAD+的平衡具有重要意义。作者探究了超蕃1作为模拟NADH氧化酶(NOX)活性的潜力。结果表明,超蕃1的1O2的产率达到70%,对NADH的氧化能力均显著超越笼2、大环3和单体4,具有优异的NOX活性。
在类NOX研究过程中,作者观察到NADH氧化仅在光照下进行,而在没有光照的情况下几乎无活性(图5a)。因此,作者分析了天然NOX氧化NADH的常见产物,如H2O2和NAD+。在氧化体系中加入乙醇脱氢酶和乙醇后,在340 nm处的紫外吸收在10 min内恢复到90%,证实了反应的主要产物是NAD+而非(NAD)2(图5b)。动力学实验证实了超蕃1显著氧化特性,其中Michaelis−Menten曲线显示Km为70.5 μM,表明与天然NOX(192.9 μM)相比,其对NADH的亲和力较强,Vmax为17.1 μM min−1(图5c、d)。超蕃1和天然NOX的催化常数(Kcat)分别为1.71 min−1和221.4 min−1。催化效率(Kcat/Km)分别为2.43 × 104和114.77 × 104 L mol−1 min−1。这些结果表明,超蕃1有可能取代天然酶,实现高效的酶催化反应。
在线粒体呼吸链中,NOX不仅将电子从NADH转移到O2,还将电子转移到Cyt c,表现出类Cyt-c还原酶的活性。如图5e所示,当照射NADH和超蕃1体系时,随着NADH氧化,Cyt-c被还原,在550 nm处Cyt - c吸收峰增加,并且从409 nm红移到412 nm,表明Cyt - c中的铁转化为亚铁形式。相比之下,超蕃1仅引起轻微的光谱变化,而单独的NADH不诱导任何光谱变化,证实了超蕃1介导从NADH到Cyt-c的电子转移(图5 f)。根据酶动力学,从Michaelis−Menten曲线(图5g,h)推导出Km为40.1 μM,Vmax为3.5 μM min−1。
GSH在调节细胞氧化应激中是必不可少的。作者评估了超蕃1的类GSH氧化酶活性。使用DTNB作为显色剂,在照射30分钟内,观察到超蕃1和GSH溶液的颜色发生了显著的变化,从亮黄色变为无色(图5i)。通过Michaelis−Menten曲线,测定其类GSH氧化酶的Km和Vmax值分别为15.6 μM和4.3 μM min−1,表明其具有较强的类GSHOX活性(图5 j)。
在广泛的TMB/TMBox反应模型研究中,作者观察到652 nm处的吸收强度随着TMB浓度的升高而增加(图5 k)。酶动力学实验得出Km和Vmax值分别为452.4 μM和16 μM min-1(图5l)。考虑到肿瘤微环境的微酸性,作者进一步研究了pH值对超蕃1类酶活性的影响。结果显示,其类酶功能,特别是NADH氧化类酶、GSH氧化类酶和氧化活性,在酸性条件下增强。
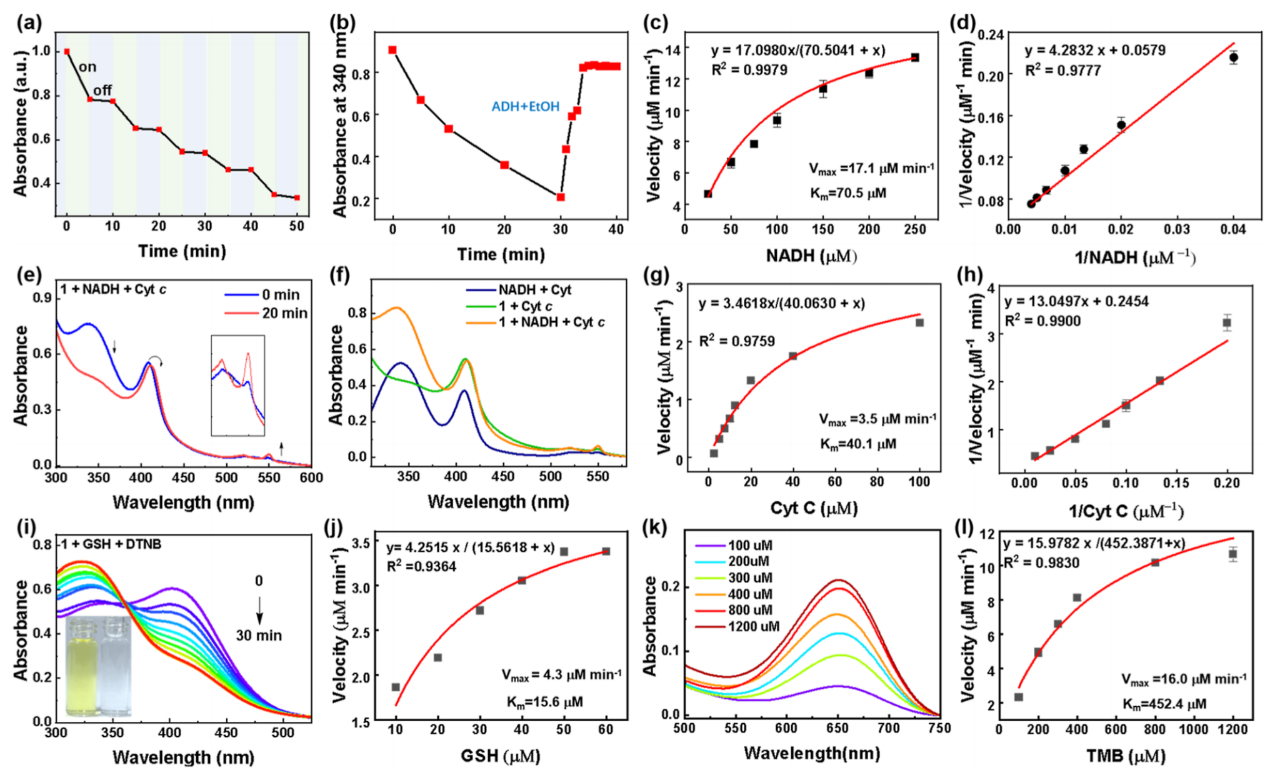
图5:超蕃1的体外类酶活性。(a)超蕃1的光可控NADH氧化活性;(b)分别由超蕃1和ADH催化的NADH消耗和回收;超蕃1的NADH氧化类酶活性的(c)稳态动力学分析和(d)Lineweaver−Burk图;(e)超蕃1的Cyt-c还原类酶活性;(f)反应30分钟后不同溶液的UV−Vis吸收光谱;超蕃1的Cyt-c还原类酶活性的(g)稳态动力学分析和(h)Lineweaver-Burk;(i)超蕃1对GSH的氧化活性;(j)超蕃1的GSH氧化类酶活性的稳态动力学分析;(k)超蕃1的氧化类酶活性;(l)超蕃1的氧化类酶活性的稳态动力学分析。
基于超蕃1的类酶活性,作者进一步研究了其体外催化潜力,重点是其在调节细胞氧化应激中的作用。为了评估生物相容性,作者测试了这四种基于吩噻嗪的光敏剂在四种细胞系(即Hela细胞、MCF−7细胞、Hepa 1−6细胞和3T3细胞)中的细胞毒性。在0-64 μg/ mL浓度范围内孵育12 h后,细胞存活率保持在90%以上,证实了这些光敏剂具有良好生物相容性。
接下来,作者专注于Hepa 1−6细胞系,以评估超蕃1诱导细胞凋亡的潜力。用不同浓度的超蕃1处理Hepa 1−6细胞。与未辐照组相比,辐照组中细胞发生显著诱导凋亡。超蕃1的IC50值4.49 ± 0.53 μg/mL,显著低于其他对照组,突出了其PDT功效。如图6b所示,与超蕃1共孵育后,Hepa 1−6细胞内的NADH水平降低了66%。NADH的降低抑制了细胞的氧化磷酸化(OXPHOS),导致线粒体膜电位活性降低,ATP水平下降50%。此外,超蕃1产生的ROS结合NADH氧化过程中产生的H2O2,促进过表达的GSH氧化为GSSG,使GSH水平降低77%。作为对照组,作者测量了3T3细胞中三种指示剂水平的变化。经NADH水平降低和激光照射后,三种指示剂的水平均略有下降,证实了NADH水平降低有效地破坏了癌细胞的氧化还原稳态,最终诱导细胞凋亡和铁凋亡,同时对正常细胞表现出可忽略的副作用。
接着,作者进一步研究了超蕃1对氧化应激途径的影响。光谱分析证实,超蕃1通过NADH氧化产生大量的ROS(1O2,O2•‑),包括H2O2。这种ROS激增破坏了细胞的氧化还原稳态,引发了“氧爆发”,推动细胞凋亡。使用DCFH-DA(和DHE)染色,作者检测到在450 nm照射下用超蕃1处理的细胞中显著升高的细胞内ROS(图6c)。
此外,超蕃1表现出类似于NADH氧化酶(NOX)的活性,氧化NADH,从而破坏线粒体呼吸链内的电子传递。这降低了线粒体的OXPHOS并减少ATP产生,导致线粒体功能障碍并促进细胞凋亡。为了评估线粒体膜电位(ΔΨm),作者使用JC-1作为荧光探针。如图6d所示,对照细胞显示红色荧光,表明线粒体膜电位完好,而超蕃1处理过的细胞,出现了强烈的绿色荧光,表明ΔΨm减少。随着超蕃1浓度的增加,绿色与红色荧光比率进一步增加,表明线粒体去极化的浓度依赖性。这些发现表明,超蕃1介导的NADH消耗诱导了“多米诺效应”,导致线粒体损伤和细胞凋亡。最后,作者使用AM/PI染色评估了超蕃1的体外光动力治疗效果(图6 e)。对照组几乎所有区域都显示出绿色荧光,表明细胞保持存活。然而在激光照射下,随着超蕃1浓度增加,红色荧光区域及空白区域逐渐扩大,标志着细胞死亡率上升。值得注意的是,当超蕃1浓度达到15μg/mL时,几乎所有细胞均失去活性,这证实了该化合物在光照条件下具有显著的光动力治疗效力。
鉴于光动力疗法展现的良好疗效,作者引入超蕃1作为NADH氧化酶(NOX)模拟物,其设计初衷是与内源性NOX酶竞争NADH氧化过程。这种竞争引发了一系列氧化还原失衡效应:有效降低细胞内NADH水平,损害电子传递链功能,从而抑制ATP合成与线粒体呼吸作用。由此导致的线粒体功能障碍进一步抑制了OXPHOS,最终诱发肿瘤细胞的能量耗竭。除NOX模拟活性外,超蕃1还展现出类GSH氧化酶活性,能加速细胞内GSH的氧化过程,进一步加剧氧化应激反应。作为关键细胞抗氧化剂之一的GSH被耗竭后,细胞中和活性氧ROS的能力显著削弱,导致细胞内爆发性氧化应激。急剧升高的ROS水平不仅引发标志铁死亡的广泛脂质过氧化反应,同时激活了半胱天冬酶介导的凋亡通路。铁死亡与凋亡这两种截然不同的细胞死亡机制协同作用,显著增强了超蕃1在肿瘤微环境中的细胞毒性效应。
这些结果证实超蕃1是一种能精确调控氧化还原稳态、破坏代谢通路的多酶模拟物。通过发挥其作为类NOX和类GSH氧化酶模拟物的双重功能,该化合物形成了一种协同治疗策略——通过放大氧化应激、耗竭ATP及激活程序性细胞死亡等机制选择性靶向肿瘤细胞。这种机制上的多功能性,彰显了其作为新一代超分子抗癌治疗剂的巨大潜力。
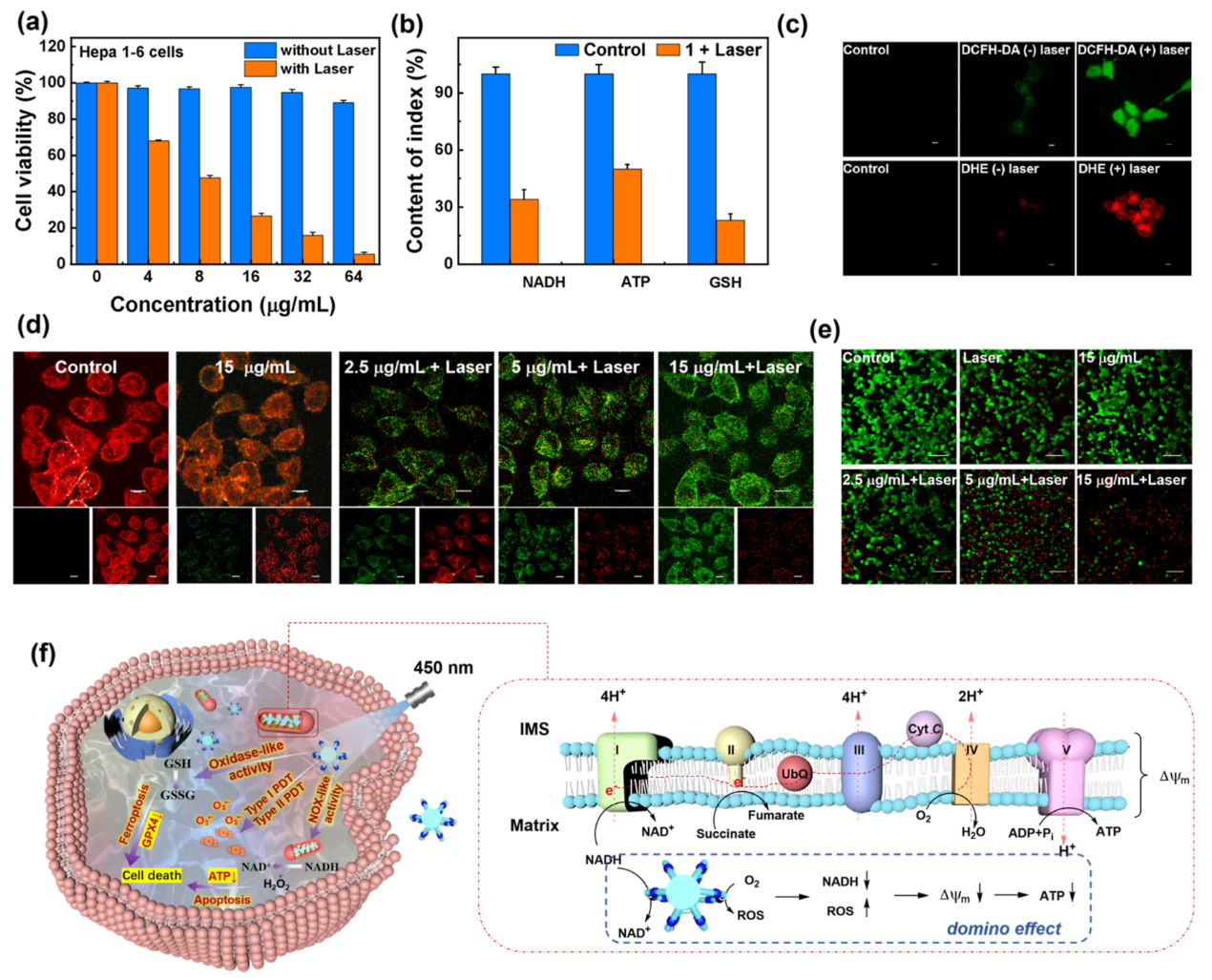
图6:超蕃1的体外治疗作用。(a)超蕃1处理后,有和无激光照射的Hepa 1−6细胞的细胞活力;(b)用15 μg mL−1的超蕃1处理的Hepa 1−6细胞中NADH、ATP和GSH的细胞内水平;(c)超蕃1处理后Hepa 1−6细胞内ROS的荧光图像(15 μg/mL);(d)超蕃1处理后Hepa 1−6细胞线粒体膜电位(Ψm)的变化;(e)不同处理条件下AM/PI染色的Hepa 1−6细胞的CLSM;(f)超蕃1诱导的细胞死亡机制示意图和超蕃1催化的NADH消耗所触发的“多米诺效应”的示意图。
总之,本研究基于“超笼效应”策略设计了超蕃1光敏剂,增强了其光敏性、光催化氧化并赋予癌症治疗等多方面的酶模拟特性。在分子水平优化后,超蕃1表现出显著改善的光吸收、优异的光生电子分离和转移以及在低能光下减少的载流子复合,产生了高ROS产率和光催化氧化。其独特的单分子结构作为单分子酶,展现出类似NADH氧化酶和GSH氧化酶的活性。这使得NADH和GSH能够被选择性地耗尽,破坏细胞的氧化还原平衡,引发线粒体功能障碍。这种“多米诺效应”不仅启动了细胞凋亡和铁死亡途径,还伴随着活性氧积累、氧爆发和GSH耗竭,进一步下调GPX4的表达,加速肿瘤细胞的死亡。值得注意的是,单分子酶1在酸性和中性环境中展现出pH−依赖性的稳定催化活性,这正是肿瘤微环境的特征,突显了其在对健康细胞影响最小的情况下,实现精准且高效抗癌治疗的潜力。这些发现标志着超分子光动力疗法和酶−模拟催化领域的重大突破,确立了超蕃作为多功能“单分子酶”的地位。这些“单分子酶”在生物启发的催化、癌症治疗等方面展现出卓越的能力。此外,单分子酶在氧化还原调节和生化研究中展现出广泛的应用潜力,突显了它们对推动基础科学进步和促进治疗创新的变革性影响。
通讯简介

何清,湖南大学教授、博士生导师、国家海外高层次青年人才。2010年7月于湖南师范大学制药工程系获学士学位;2015年7月于中国科学院化学研究所获得理学博士学位;2015年7月–2019年3月在(美国)德克萨斯大学奥斯汀分校化学系从事博士后研究(合作导师为Jonathan L. Sessler教授);2019年入选国家海外高层次人才青年项目回国工作,任湖南大学化学系教授。主持/承担国家自然科学基金面上项目、青年项目及国家重点研发计划子课题等多项课题。主要研究方向为超分子化学和新型功能材料,包括分子笼化学(超蕃化学与塔笼化学)、新型非共价相互作用力、先进超分子材料(非多孔非晶态超吸附材料、超分子离子传导膜)和超分子分离技术。在Sci. Adv.、Nat. Commun.、Chem.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Sci.、Adv. Energy Mater.、Chem. Rev.、Chem. Soc.Rev.、Acc. Chem. Res.、Coordin. Chem. Rev.、CCS Chem.等国际著名期刊上发表学术论文60余篇,申请/授权专利8项。荣获2025年度“Thieme Chemistry Journals Award”学术奖。目前担任《四面体》(Tetrahedron)和《四面体快报》(Tetrahedron Letters)青年编委、《Tetrahedron Chem》客座编辑。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn