

(图片来源:Org. Lett.)
正文
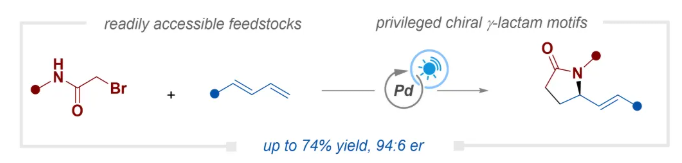
氮杂环是有机化学和药物化学中不可或缺的结构单元。在这些结构单元中,γ-内酰胺在天然产物和药物中广泛存在,并具有多种生物活性(Scheme 1A)。尽管人们已经付出了巨大努力来开发高效且选择性的方法来构建此类结构单元,但γ-内酰胺的对映选择性合成仍然无疑具有挑战性。近年来,一系列直接引入手性中心的不对称方法已被开发出来(Scheme 1B)。代表性例子包括手性选择性原子转移自由基环化、手性选择性分子内C−H酰胺化、不饱和内酰胺的氢化以及烯烃的手性选择性羰基化环化。然而,这些方法主要基于分子内过程,需要在底物中预先引入多个官能团,从而在一定程度上降低了原子经济性和成本效益。这使得难以实现手性内酰胺骨架的复杂性和多样性。过去十年间,烯烃1,2-官能团化已成为直接合成γ-内酰胺的强大创新策略。该方法采用易于获得的2-卤代酰胺作为双官能团试剂,兼具操作简便性和合成效率(Scheme 1B)。然而,快速的分子内环化反应在动力学上对手性控制提出了重大挑战,使得不对称合成在当前阶段难以实现,因此需要开发新的催化体系来实现这种手性选择性转化。针对这一挑战,中南大学阳华课题组受前期工作(ACS Catal. 2025, 15, 4384–4393;ACS Catal. 2024, 14, 3725–3732;Org. Lett.2024, 26, 8762–8767;Org. Lett.2022, 24, 5407–5411;Org. Lett.2022, 24, 924–928)启发,利用可见光诱导的钯催化策略,通过1,3-二烯与2-溴酰胺的对映选择性环化反应,实现了γ-内酰胺的不对称合成,该方法可实现良好的区域选择性和对映选择性(Scheme 1C)。
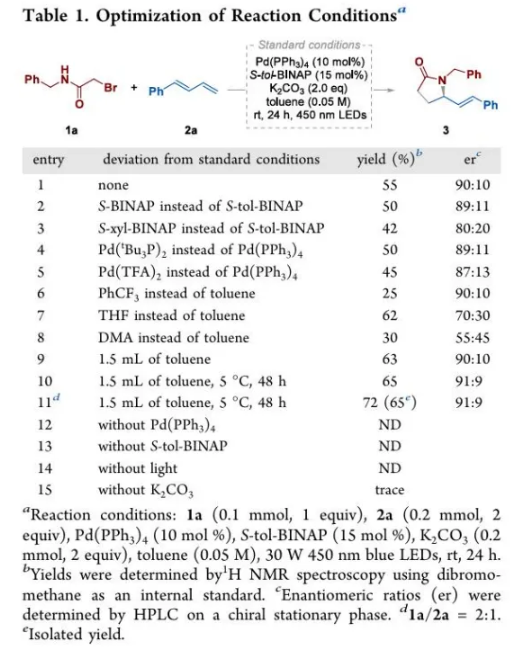
首先,作者以N-苄基-2-溴乙酰胺(1a),1-苯基-1,3-丁二烯(2a)作为模型反应底物进行了相关反应条件的筛选(Table 1),当以Pd(PPh3)4(10 mol%)作为催化剂,S-tol-BINAP(15 mol%)作为配体,K2CO3(2.0 equiv)作为碱,Toluene(1.5 mL)为溶剂,在30 W 450 nm LED照射下,5 ℃反应48小时后,可以65%的分离产率,91:9的er获得了相应手性γ-内酰胺产物3(Table 1, entry 11)。控制实验表明,钯催化剂、配体、碱和光照对该过程均至关重要(Table 1, entry 12-15)。
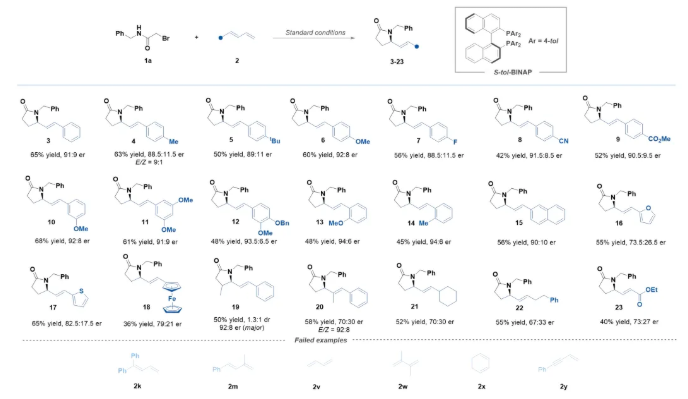
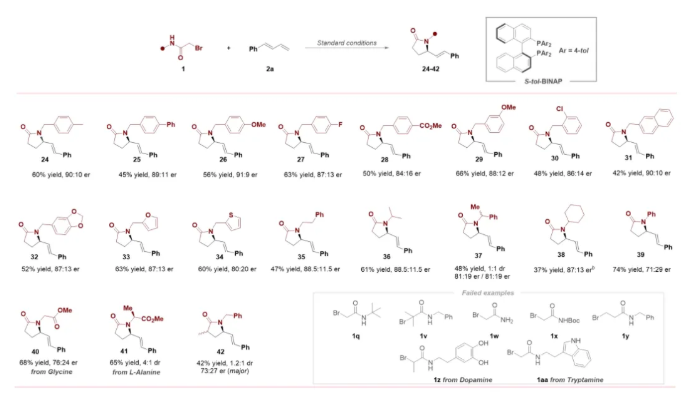
在获得上述最优反应条件后,作者对1,3-二烯的适应性进行了考察(Scheme 2)。结果表明,一系列吸电子、供电子基团取代的1-芳基-1,3-二烯均能有效参与该反应。此外,芳杂环取代的1,3-二烯,也是该转化反应的合适底物。值得注意的是,脂肪族1,3-二烯和缺电子1,3-二烯也能够进行此转化,然而产物的收率以及对映选择性相对较低。大宗化学品1,3-丁二烯和其他常见脂肪族1,3-二烯,如2,3-二甲基丁二烯2w和环己二烯2x不太适用于该体系,表现出较差的对映选择性。
紧接着,作者进一步考察了2-溴酰胺的适用范围(Scheme 3)。结果表明,一系列带有不同电子效应取代基(包括甲氧基、甲基、氟、氯和酯基等)的N-苄基-2-溴乙酰胺化合物,均显示出良好的反应性及对映选择性。将 N-苄基-2-溴乙酰胺化合物的苯环替换为萘环、呋喃环、噻吩环也是可行的。值得注意的是,当氮原子上带有较大位阻取代基如环己基时反应效果较差,收率较低。特别地,对于N-叔丁基取代的2-溴乙酰胺,几乎监测不到目标产物。此外,氨基酸衍生的2-溴酰胺也顺利反应。值得强调的是,2-溴乙酰胺氮原子上的取代基对该反应至关重要,在测试无取代基或吸电子取代基的底物时,几乎无法检测到目标产物。此外,使用3-溴丙酰胺(1y)也未能成功实现手性六元内酰胺的构建。
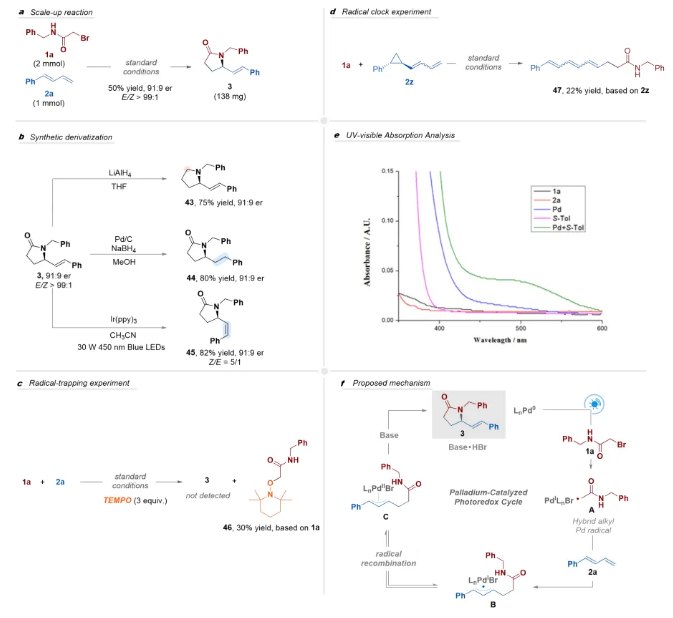
随后,作者开展了反应应用研究及机理实验(Scheme 4)。γ-内酰胺3在氢化铝锂(LiAlH4)的还原下,可以75%的产率获得相应手性吡咯烷产物,对映选择性可以很好的保留;随后作者对γ-内酰胺3结构中双键分别进行了还原、异构化反应,也可以很好地保留其对映选择性,展现了该方法良好的应用前景。自由基捕获实验和自由基钟实验表明反应可能经历自由基途径;开/关灯实验一定程度上排除了自由基链式反应的可能性;当使用S-tol-BINAP作为手性配体时,吸收光谱中观察到明显的红移现象,这表明Pd/S-tol-BINAP复合物在蓝光区域具有增强的光吸收能力。基于以上实验结果和已有的报道,作者提出了可能的反应机理。首先,光激发的LnPd0通过单电子转移(SET)还原N-苄基-2-溴乙酰胺1a,生成杂化烷基钯自由基物种A,自由基A加成至1,3-二烯2a的末端位置,生成相应的杂化烯丙基钯自由基复合物B,随后通过自由基重组形成π-烯丙基钯复合物C。最后,在碱存在下,π-烯丙基钯复合物C进行分子内区域选择性和立体选择性的亲核取代反应,生成手性γ-内酰胺3并再生钯催化剂。
(图片来源:Org. Lett.)
总结
总之,中南大学阳华/陈凯课题组开发了一种光诱导钯催化1,3-二烯与2-溴酰胺的对映选择性和区域选择性级联环化反应,为快速构建结构多样化的手性γ-内酰胺提供了新途径。该研究不仅拓展了光激发钯催化在手性选择性转化中的应用前沿,还显著丰富了手性γ-内酰胺的化学空间。
作者简介

阳华教授,中南大学“升华学者”特聘教授,博士生导师,化学化工学院副院长。1998年获得四川大学有机化学专业硕士学位后,赴美留学深造。2011年回国后加入中南大学化学化工学院制药工程系开展研究工作。多年来,阳华教授一直致力于有机合成,不对称催化,可见光催化及手性药物分子的全合成研究工作,主持国家自然科学基金,湖南省科技厅重点项目,参与多项美国NSF以及NIH的基金研究工作。研发出具有优异性能的有机催化剂“Hua Cat”,通过精细化学品公司-- Sigma-Aldrich公司已实现商品化,在全球销售。近年来,以第一作者/通信作者身份在J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal., Org. Lett., Chem. Comm., J. Org. Chem.等世界一流期刊上发表学术论文100余篇。

陈凯副教授,男,博士,博士生导师。2009年本科毕业于南开大学,2014年博士毕业于北京大学化学与分子工程学院。致力于计算化学与有机化学结合研究催化反应机制及新反应设计,在过渡金属催化烯炔环异构化反应,可见光诱导的胺化、氟化及硼化反应,有机催化环加成反应研究中取得系列进展。近年来先后主持国家自然科学基金面上项目、国家自然科学基金青年项目、湖南省自然科学基金面上项目、广东省自然科学基金博士启动项目、博士后基金面上项目和特殊资助项目等。以第一作者或通讯作者(包括共同通讯)在J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal, Chem, Org. Lett.,《中国科学化学》等期刊发表论文100余篇。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn