

研究背景
二聚环色胺生物碱(Bis(cyclotryptamine))具有多稠合/桥环骨架以及多达四个连续的立体中心,其中包括邻位季碳手性中心。自1888年分离得到腊梅碱至今,人类对于二聚环色胺类生物碱的研究持续了137年之久。这一家族分子结构与活性吸引着全球科学家的广泛关注。Psychotriadine (1) 是其中一类具有哌啶并吲哚啉类别的生物碱(图1a中的A–B–C环系)。2020年,Garg及其同事采用基于对称性的策略,以固相光脱羰反应作为关键步骤,实现了(±)- psychotriadine的15步全合成。然而围绕这一分子仍有以下待为解决的问题:
(a) 天然产物psychotriadine的绝对构型是什么?
(b) 其生源合成推定的类似物tetrahydropsychotriadine是否存在,我们能否在分离之前实现全合成?
(c) 这些化合物具有怎样的生物学功能?
(d) 是否可发展基于非对称设计的合成新策略,对于Psychotriadine具有的相邻全碳季碳手性中心以及两个脒基结构凝聚起来的6/5/6/6/5/6稠环结构实现简洁高效不对称的全合成。

图1 代表性的二聚环色胺生物碱
天然产物(−)-psychotriadine的不对称全合成
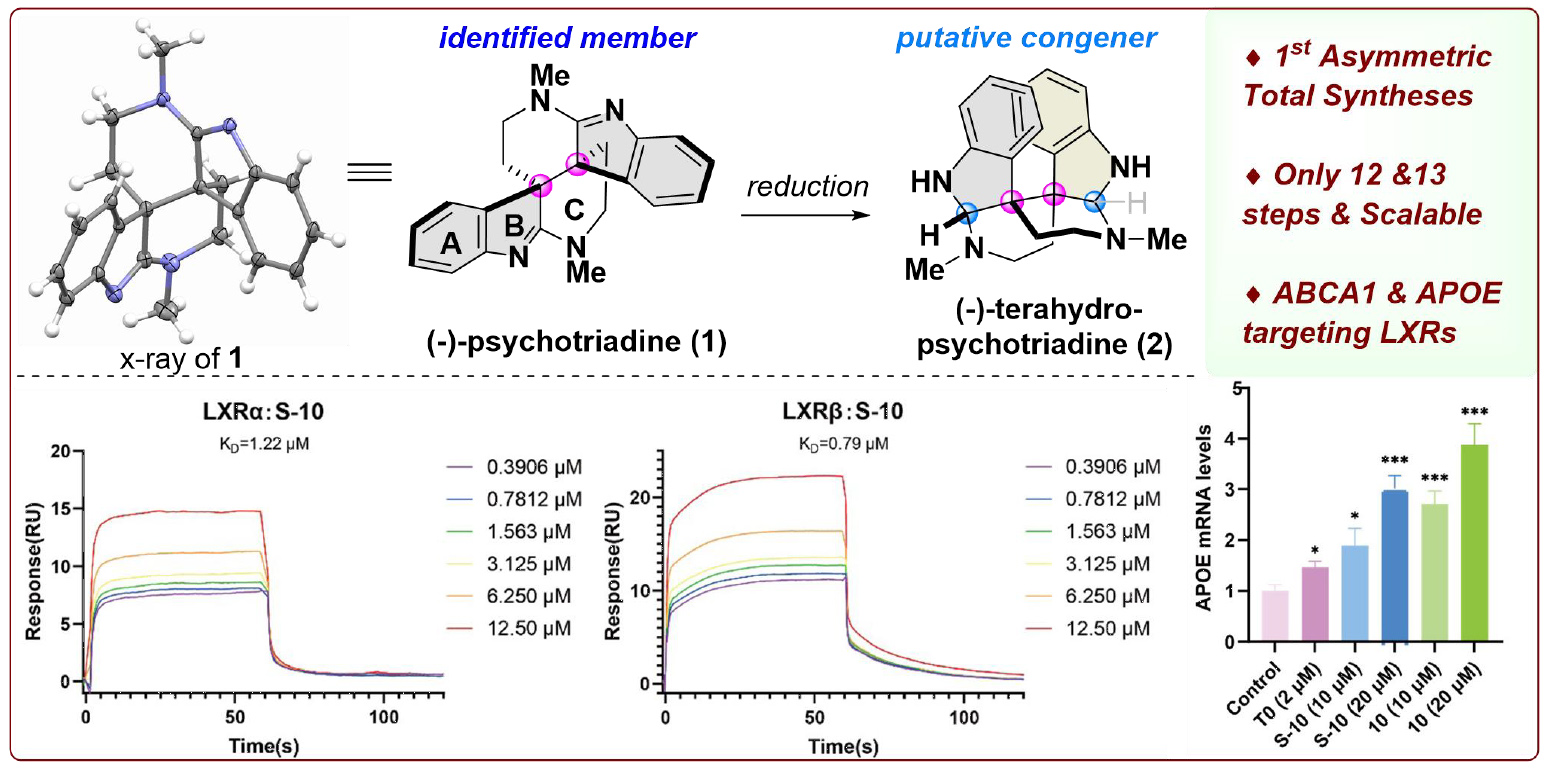
合成从商业可得的化合物6出发,经过不对称的Meerwein-Eschenmoser-Claisen重排(MECR)得到氧化吲哚8,再经脱保护和Ti(IV)介导的亲核环化反应构建目标分子中的A-B-C三环体系得到化合物9。臭氧切断以及随后的Fischer吲哚化/Plancher重排反应转化为所需的五环骨架化合物3。经过简单的三步官能团转化得到五环化合物10。作者实现了一个分子内氯代立体选择性骨架迁移(skeletal hopping)的串联转化。作者推测反应经由形成的11a(作为内部Cl+源)进行吲哚去芳构化得到11b,随后发生质子转移,亚胺被MeNH基团捕获得到11c,最后通过11d进行立体专一性的环收缩,以72%的收率得到产物(-)-psychotriadine (1, 90% ee)。C3和C3'的S,S构型通过X射线晶体学得以验证。至此,作者仅用12步(LLS)即可实现 (–)-psychotriadine (1)的对映选择性全合成(256 mg),为后续的生物学研究奠定了物质基础。
同时,基于生物合成的分析,作者推定tetrahydro-psychotriadine (2) 应该是天然产物1的同系物,并成功利用DIBAL-H还原以39%的收率得到了所需的tetrahydro-psychotriadine (2),其结构也得到了X射线晶体学验证。在此基础上,作者发现化合物2在乙酸水溶液中加热过夜后可转化为 (+)-calycanthine (26),为说明2作为二聚环色胺生物碱家族生物同系物提供了结构转化关联的依据。

Scheme 1 天然产物(−)-psychotriadine的不对称全合成
作用靶点与生物学功能解析
实现天然产物全合成并非研究的终点,作者对这些天然产物及其类似物的生物功能深感兴趣。胆固醇代谢紊乱和神经炎症与阿尔茨海默病(AD)密切相关。LXR-ABCA1/APOE通路是连接AD中胆固醇代谢、Aβ病理和神经炎症的核心枢纽,使得LXR成为AD药物开发的潜在靶点。基于上述机制,作者通过表面等离子共振(SPR)技术筛选了所有合成中间体。其中,化合物10及S-10对两种LXR亚型均表现出最佳的结合能力,对LXRα的KD值分别为1.22 μM (S-10) 和 2.56 μM (10),对LXRβ的KD值分别为0.79 μM (S-10) 和 2.74 μM (10)。此外,荧光素酶报告基因实验表明,这两种化合物能够激活LXRα和LXRβ的转录活性。为评估化合物对AD的潜在治疗作用,作者在小鼠小胶质细胞BV-2细胞中进行了研究。结果表明,化合物S-10和10能显著提高ABCA1和APOE的mRNA和蛋白水平。而且S-10和10对APOE mRNA和蛋白水平的上调作用显著高于阳性对照(T0 = T0901317;见scheme 3E和3F),展现了它们作为先导化合物开发的潜力。
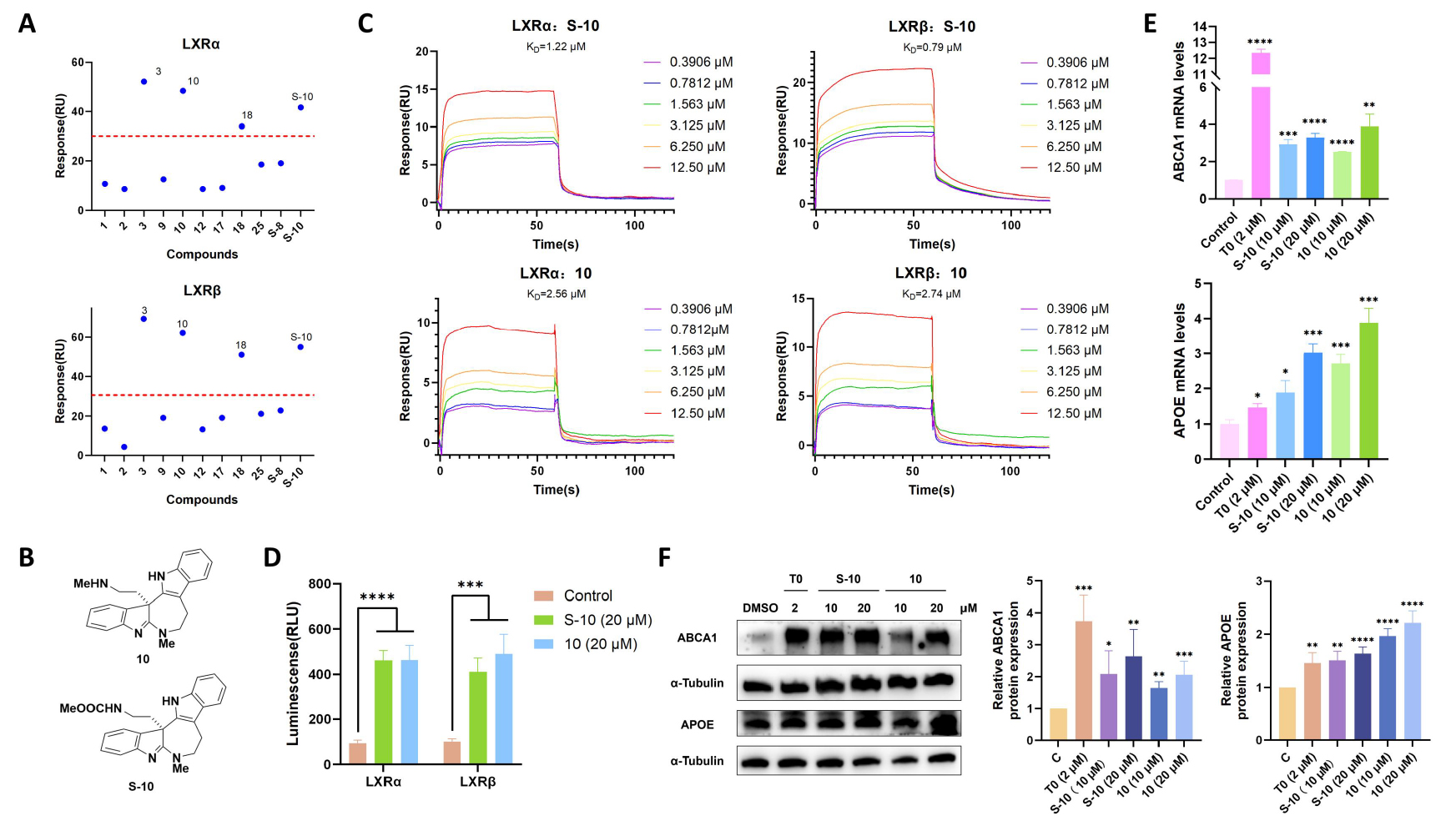
Scheme 2 作用靶点与生物学功能解析
结论
综上所述,作者仅需12步即可高效完成256毫克天然产物(−)-psychotriadine的对映选择性全合成,通过X射线晶体学分析确定了绝对构型,为解析天然psychotriadine的构型提供了关键依据。此外,其研究还进一步通过立体选择性还原合成了生物同源物tetrahydro-psychotriadine,证实了同系物的可及性和生源假说。在尚未被研究过的生物学活性方面,研究发现合成中间体S-10与10能够作为高效的肝X受体(LXRs)激动剂,显著上调ABCA1和APOE的蛋白表达水平,展现出作为阿尔茨海默症治疗药物先导化合物的良好潜力。
本文的第一完成单位是中国海洋大学医药学院,通讯作者徐涛教授是国家“海外高层次人才”,国家优青基金获得者。文章共同第一作者是医药学院博士生杨庆星和欧阳晗依以及医药学院毕业生于海勇博士,硕士生李法顺也参与了论文的相关研究。
课题组主页:https://www.x-mol.com/groups/tao_XU
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn