

Aogacillins A和B是由Shiomi等人于2013年从拟青霉属真菌(Simplicillium sp. FKI-5985)培养液中分离得到的一类天然产物。它们不仅可以克服抗生素阿贝卡星(ABK)对耐甲氧西林金黄色葡萄球菌(MRSA)的耐药性,还可以用来制备治疗肾癌、乳腺癌、阿尔茨海默病和二型糖尿病的药物。在结构上,Aogacillins是一类含有螺环的β-羰基-δ-内酯,它们具有高度密集的官能团,特别是在δ-内酯环上具有连续的高氧化态,这都为其化学合成带来了挑战。其环外的不饱和末端双键也使得该类化合物更加不稳定。(图1)
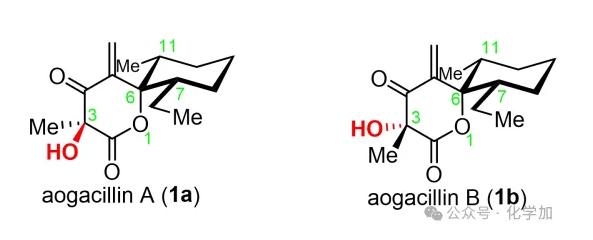
图1. Aogacillins A和B的结构
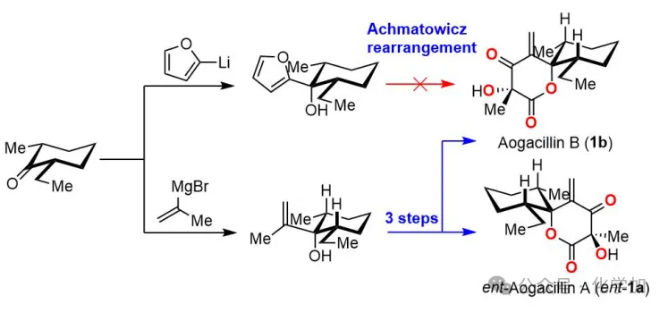
在初始的逆合成分析中,作者提出aogacillins A和B可以由顺-2甲基-6-乙基环己酮III与呋喃的加成物II经Achmatowicz重排所得二氢吡喃酮中间体I的官能化来得到。(图2)
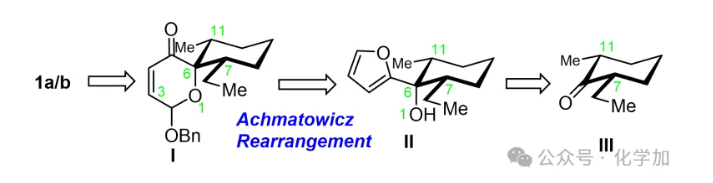
图2. 基于Achmatowicz重排策略对Aogacillins A和B的逆合成分析
基于此策略,作者首先从2-甲基环己酮出发,经克莱森缩合、烯胺化、Benary反应、氢化还原四步合成了顺-2-甲基-6-乙基环己酮(5)。随后经呋喃加成、Achmatowicz重排、苄基保护成功得到了螺环中间体(7),该中间体可以30克的规模放大制备。在有了充足的螺环中间体来源之后,作者开始尝试对二氢吡喃酮的官能化以期得到目标天然产物。首先利用迈克尔加成引入甲基、苯硒基捕获、氧化消除得到了中间体(8)。然后CeCl3介导的1, 2-甲基加成并TMS保护得到两个非对映体(9a)和(9b)。在对双键双羟化、IBX氧化之后,作者对(11b)进行了氢化脱苄基、脱TMS保护、氧化得到内酯(12b)。遗憾的是最后消除成双键未能成功。另外,作者还尝试了将中间体(8)先双羟化、丙叉保护,再将C-5羰基转化为烯烃,但是由于空间位阻的影响也未能成功。(图3)
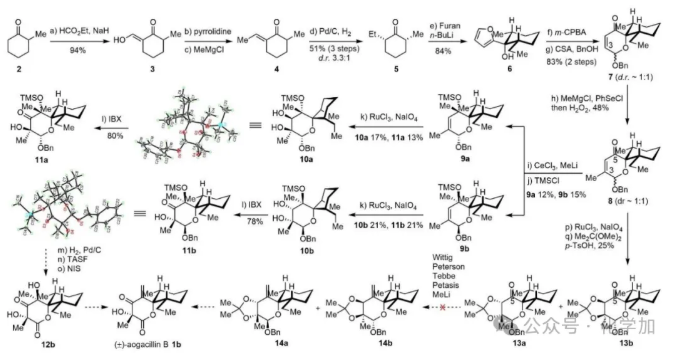
图3. 基于Achmatowicz重排策略对Aogacillins A和B的合成探索
以上基于Achmatowicz重排策略的失败皆是由于C-5位大位阻导致烯烃难以构建,由此作者意识到在早期先引入C-5位烯烃则可以避免该问题。新的合成策略如图4所示。Aogacillins A和B可以由醛VI与乳酸衍生物V的羟醛缩合随后内酯化关环来得到。而醛VI则可以由乙烯基金属试剂对顺-2-甲基-6-乙基环己酮III的加成来得到。
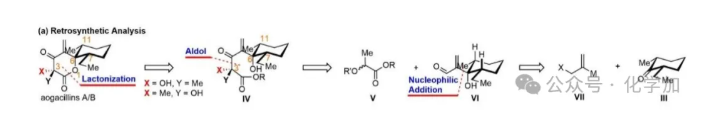
图4. 基于羟醛缩合/内酯化策略对Aogacillins A和B的逆合成分析
基于此策略,作者首先利用异丙烯基格氏试剂对顺-2-甲基-6-乙基环己酮加成,再经烯丙位氧化得到醛(17)。之后再用Seebach-Fráter发展的手性合成子1, 3-二氧戊环-4-酮(18)与醛(17)发生一锅串联的aldol/内酯化反应得到一对非对映体(20a)和(20b)的混合物。最后将其用IBX氧化,再经制备HPLC分离便得到了aogacillin A的对映体和aogacillin B。此外,作者还利用DFT计算分析了aldol反应产物的立体化学(图5)
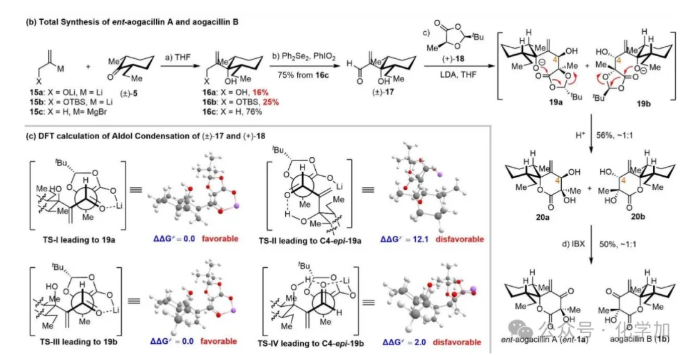
图5. 基于羟醛缩合/内酯化策略对Aogacillins A和B的全合成
由于HPLC的分离效率低导致ent-aogacillin A和aogacillin B的产率都很低。作者又从右旋香芹酮出发,经立体选择性乙基化、1, 4还原、臭氧脱异丙烯基得到手性纯的顺-2-甲基-6-乙基环己酮。再经过与前述相同的烯丙位C-H氧化、与Seebach-Fráter手性1, 3-二氧戊环-4-酮(18)进行aldol/内酯化便得到了手性纯的中间体(20a),并通过NOESY验证了其立体化学,是与DFT计算结果一致的。最后IBX氧化即完成了ent-aogacillin A的不对称全合成。
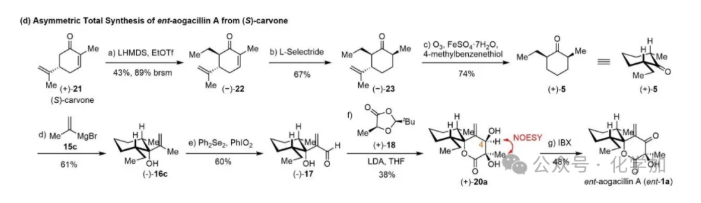
图6. Ent-Aogacillin A的不对称全合成
这一成果最近发表在Chem. Sci.上,河北师范大学张威教授、李晓艳教授以及香港科技大学童荣标教授为该论文的通讯作者,硕士生顾慧星和李紫祎为该论文的共同第一作者。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn