

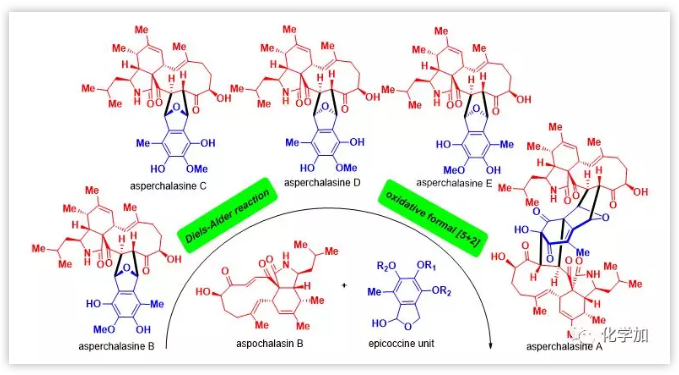
最近,华中科技大学张勇慧教授及其同事从Aspergillusflavipes发酵液中发现了一系列真菌次级代谢产物,统称为merocytochalasans。在结构上,该类分子均由两种亚结构单元组成,即三环cytochalasan和双环epicoccine,如代表性分子1-13所示(Figure 1)。其中,asperchalasinesB-H(1-7)包含由一个cytochalasan单元和一个epicoccine单元组成的T形六环骨架,而asperchalasine A(8)含有更复杂的夹心十二环骨架,由一个epicoccine单元和两个cytochalasan单元组成。其它典型的三聚体还包括asperflavipine B(9),epicochalasines A(10),B(11)以及aspergilasine A(12),这些分子都包括一个cytochalasan单元和两个笼状epicoccine单元。AsperflavipineA(13)是该家族中目前发现的唯一的四聚体,具有极其复杂的哑铃形十四环骨架。从合成的角度来看,这类化合物表现出的多环系、多手心中心和多官能团的特点给合成化学家带来了巨大的挑战。
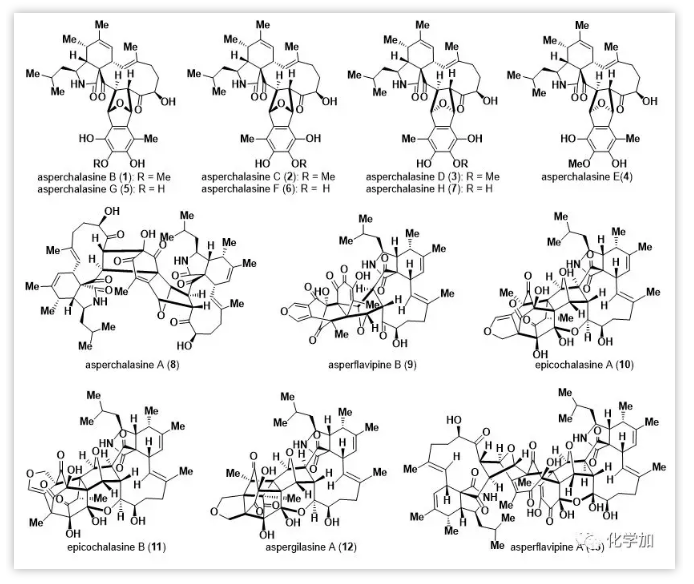
Figure 1.Representative merocytochalasans.
Merocytochalasans家族化合物表现出突出的生物学活性:asperchalasine A(8)可以通过选择性抑制癌细胞中的细胞周期蛋白A,CDK2和CDK6来诱导G1期细胞周期的停滞,而对正常细胞没有明显影响,这凸显了其作为针对癌细胞的选择性细胞周期调节剂的潜力;epicochalasines A(10)和B(11)均可通过caspase-3激活和PARP降解诱导白血病细胞中G2/M期细胞周期停滞和凋亡。
上述分子发现大大丰富了细胞松弛素家族天然产物的化学结构和生物活性多样性,也是近年来天然产物领域的亮点之一。然而,到目前为止,化学家们仍未实现merocytochalasans家族化合物的全合成。出于对该类化合物的挑战以及对cytochalasans家族持续的研究兴趣,清华大学唐叶峰、刘刚教授课题组在Angew. Chem. Int. Ed.上报道了Asperchalasines A-E以及相关同源物的首次全合成(DOI:10.1002/anie.201808249)。
基于生源途径的asperchalasines合成策略(Figure 2):
所有目标产物均源于两种常见的前体aspochalasin B(14)和epicoccine(15),可通过各类异二聚化或-三聚化得到。Epicoccine(15)经氧化产生的邻醌类化合物16a和16b进一步异构化为异苯并呋喃16c,与aspochalasinB(14)进行分子间Diels-Alder反应。由于潜在的内/外型选择性和区域选择性,Diels-Alder反应可以产生四个异二聚体即asperchalasinesF-H(5-7)和17。接下来,5-7和17通过选择性甲基化得到asperchalasines B-E(1-4)。同时,17也可以经氧化得到邻醌类化合物18,然后与14通过串联迈克尔加成/羟醛反应(即形式[5+2]环加成)最终产生异三聚体asperchalasineA(8)。
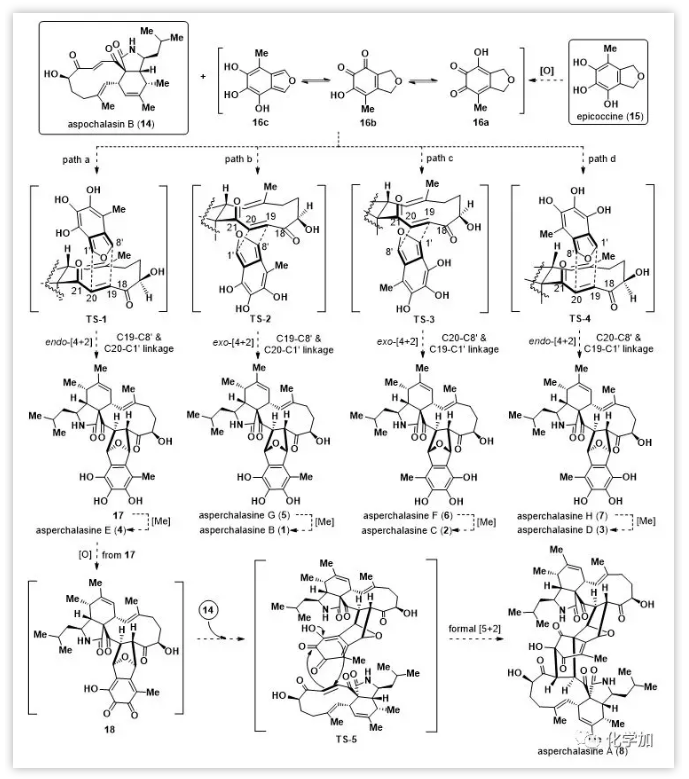
Figure 2.The plausible biosynthetic origin of asperchalasines.
Cytochalasan和epicoccine前体的制备:
Epicoccine及其衍生物可以通过Trauner课题组开发的方法制备。对于[11]-cytochalasans,Trost课题组曾报道了aspochalasin B(14)全合成;此外,其它几个同源物也由Thomas和Vedejs课题组合成。尽管如此,仍需一种更简洁,可扩展和通用的合成路线得到aspochalasin B(14)。作者认为,从共同的三环中间体19出发,经过后期官能团转化可以得到包括14在内的大多数具有11元环的细胞松弛素单体(Figure 3)。而19可以通过两个环构建反应(分子间Diels-Alder反应构建异吲哚酮双环母核和关环复分解反应构建11-元大环)由片段21和22组装起来。
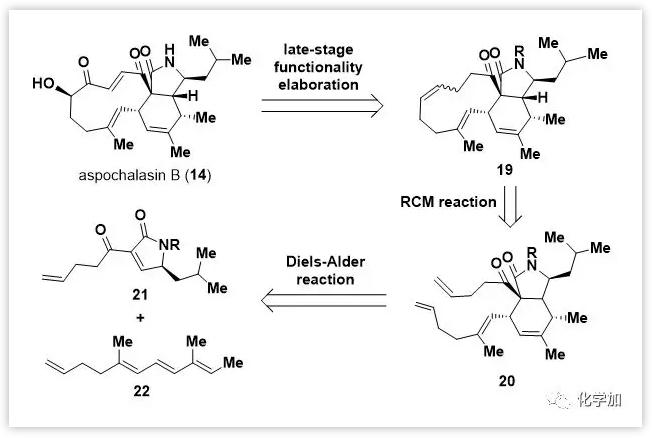
Figure 3.Retrosynthetic analysis of aspochalasin B.
片段21的制备(Scheme 1):
内酰胺23经4-戊烯酰氯(25)酰化、硒化,然后氧化消除得到3-吡咯啉-2-酮21。由于其不稳定,必须在随后的Diels-Alder反应中立即使用。二烯22则由已知的醛28通过Julia烯化一步制备。起初,作者尝试了在热条件下(无溶剂,50 ℃,10 h)进行Diels-Alder反应,并以60%的组合产率得到内型产物20和其外型异构体的混合物(内/外=2/1)。为了优化Diels-Alder反应,作者进行了系统的条件筛选,发现一些路易斯酸可以提高内/外型选择性,其中(CuOTf)2•PhMe效果最好,以63%的产率得到单一加成产物20。
在得到关键双环中间体20后,作者尝试通过关环复分解(RCM)反应构建11-元大环骨架。在Grubb-II催化剂催化下以85%的产率得到三环中间体19,作为单一(E)-异构体。随后经C17=C18的双羟化和水解N-苯甲酰基得到反式二醇31。再经选择性保护17-OH,氧化18-OH和脱保护将31转化为α-羟基酮aspochalasin P(33)。最后,通过硒化和氧化消除引入C19=C20双键得到aspochalasinB(14)。同时,利用Trauner课题组开发的方法制备了epicoccine(15)。在得到两个关键前体后,作者开始尝试仿生Diels-Alder反应。最初,在aspochalasinB(14)存在下用K3Fe(CN)6处理epicoccine(15),假设原位产生的异苯并呋喃16c可以通过Diels-Alder反应被14捕获。然而,实验中并未检测到异二聚体,反而得到epicoccine的同型二聚体作为主要产物,后续尝试通过使用过量的14来改善反应未能如愿。
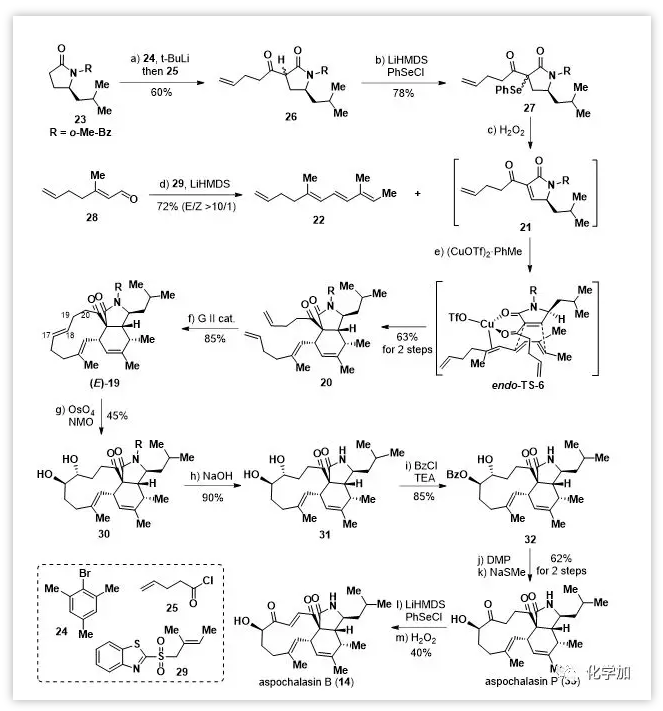
Scheme 1. Total synthesis of aspochalasin B.Reagents and conditions
Asperchalasine B-E及spicarinB的全合成(Scheme 2):
作者尝试另一种策略来实现Diels-Alder反应,设想16c可以由半缩醛前体如34通过脱水产生。随即合成得到34后,在80 ℃甲苯中用CSA处理14和34,结果Diels-Alder反应顺利进行,得到两个异二聚体asperchalasines G(5)和H(7)。由于其不稳定,直接用Ac2O/Et3N乙酰化得到35和36(5:1)。随后,利用单甲基化半缩醛37与14制备得到四种异构二聚体asperchalasinesB-E (1-4) (80%,1:4:2:3=10:2:1:1)。当用全保护的半缩醛38时,仅得到两种内型产物,脱苄基后证实为asperchalasines E (4)和D (3)(57%, 4:3=3:2)。用全保护的39也得到类似结果,产生两种内型产物40和41(80%, 40:41=3:2)。
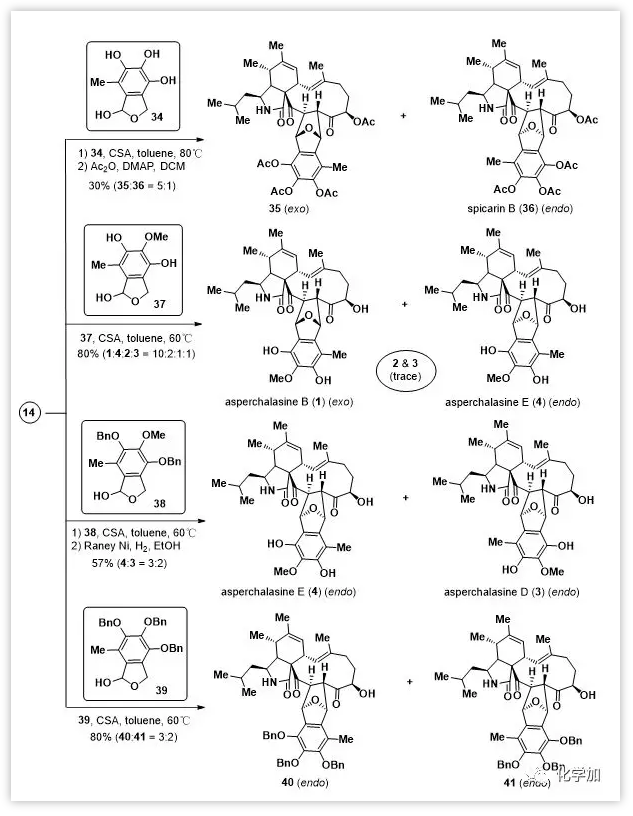
Scheme 2. Total synthesis of asperchalasines B-E andspicarin B.
Asperchalasine A(8)的全合成(Scheme 3):
上述结果表明,异苯并呋喃前体的空间效应在控制Diels-Alder反应的内/外型选择性中起关键作用。游离或部分保护的前体(如34和37)主要得到外型产物,而全保护的前体(如38和39)有利于形成内型产物。作者用Raney-Ni/H2对40进行脱苄基得到17,不经纯化直接与14混合暴露于空气中仿生氧化进行[5+2]-环加成得到asperchalasine A(8),其核磁谱数据与报道的天然样品的数据完全一致。
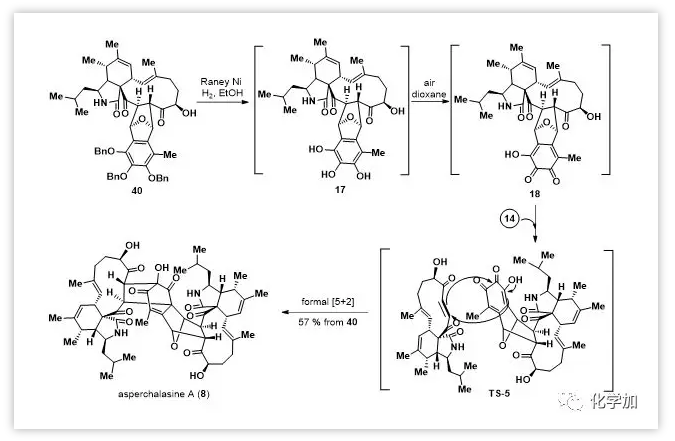
Scheme 3. Total synthesis of asperchalasine A.
小结:清华大学唐叶峰、刘刚教授课题组完成了asperchalasines A-E的首次全合成,所有目标产物都可以从已知片段出发,在最长13步线性步骤内获得。首先通过基于Diels-Alder反应和RCM反应的通用方法完成关键的三环cytochalasan单体aspochalasinB合成,然后系统地探索了cytochalasan与各种epicoccine前体的异二聚化,不仅有助于揭示该类化合物的生源合成途径,还为merocytochalasan家族中其它更具挑战性的同源物的合成铺平了道路。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn