

[3,3]-σ重排反应是一类基本且发展成熟的有机反应。许多人名反应均基于[3,3]-σ重排反应实现。该重排反应受到广泛关注主要是因为其自身通常具有较高的化学、区域和立体选择性。 [5,5]-σ重排反应与[3,3]-σ重排反应一样都遵循伍德沃德-霍夫曼规则,但关于[5,5]-σ重排反应的报道却很少。Claisen型苯基二烯基醚发生重排反应,生成对位官能团化的酚类是一种典型的[5,5]-σ重排反应(Scheme 1a(1))。尽管Naruta课题组报道的该反应具有良好的区域选择性,但却因为底物有限,未能引起研究者太多的关注。联苯胺重排则是另外一种典型的[5,5]-σ重排反应(Scheme 1a(2)),但该反应会生成很多副产物。亚胺苯醌缩酮和苯酚发生加成反应形成远端C-N键也是通过[5,5]-σ重排反应进行的(Scheme 1a(3))。除上述报道以外,目前选择性高且底物适用范围广的[5,5]-σ重排反应还未见报道。
最近,作者报道了芳基亚砜的邻位C-H键发生氰基烷基化反应(Scheme 1b)。该反应经历了[3,3]-σ重排反应生成邻氰基烷基化产物。受到该成功报道的启发,作者希望借助“组装/脱质子”策略,构建乙烯基烯酮亚胺亚硫鎓盐中间体,进而通过[5,5]-σ重排反应,实现芳基亚砜的对位C-H键官能团化(Scheme 1c)。
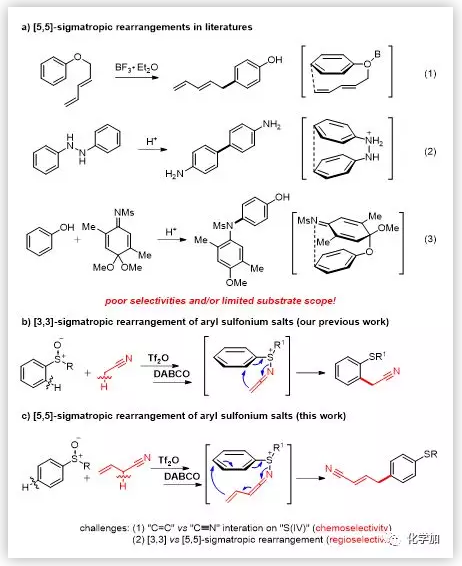
(图片来源:Angew. Chem. Int. Ed.)
作者首先以二苯基亚砜1a与烯丙基腈2a为模板底物,反应条件与之前报道的芳基亚砜发生邻氰基烷基化反应的反应条件相同(entry1,Table 1),结果发现不仅可以得到邻氰基烷基化产物(收率为12%),而且可以得到主产物对烷基芳基硫醚4aa(收率为39%)。优化反应条件后,作者发现通过降低温度同时延长反应时间(Tf2O,-60 ℃,18 h; DABCO,-100 °C,0.5 h)可以显著的提高4aa的收率(从39%提高到84%)。经过一系列条件优化,发现采用相对较低的温度和延长反应时间可以显著提高对位重排的产物4aa。另外值得注意的是碱的选择对反应的选择性至关重要。DABCO要优于其它的碱,但目前碱影响区域选择性的原因还不清楚。
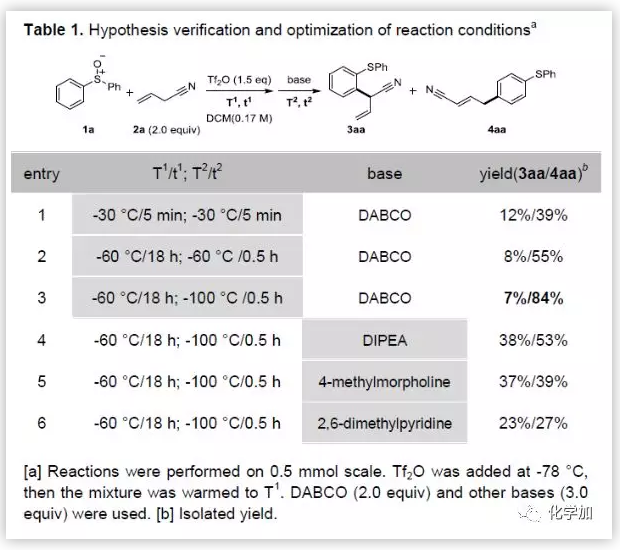
(图片来源:Angew. Chem. Int. Ed.)
在最优反应条件下,作者考察了对位C-H键氰基烷基化反应的底物范围。值得高兴的是,不论何种取代的烯丙基腈均能耐受该反应条件,且都能以较高收率得到目标产物(Scheme 2)。改变烯丙基腈γ-位上的烷基链(2b-2f)对反应结果没有明显的影响。但γ-位上换成位阻更大的仲烷基链2g,则产物的收率会适当的降低,同时有明显的副产物生成。当γ-位上取代基为环戊烷时,可以观察到少量副产物的生成,但无法得到纯的副产物。值得一提的是,高度亲电的官能团如不饱和酯(4aq)和苯甲酰氯(4as)也具有很好的兼容性。然而,β-取代烯丙基腈(2a',2b')得到的产物收率非常低。紧接着,作者用各种取代的芳基亚砜来探索该反应的普遍性(Scheme 2)。带吸电子基团(Cl,Br,COOMe)的二芳基亚砜(1b,1c,1e-1g)能很好的适应反应条件,以良好的收率得到产物。如果取代基换成给电子基(1d,1h),则不能得到产物或产物收率很低。这些结果表明该反应受电子效应影响很大。给电子的甲基苯基亚砜1i也不能得到目标产物。但值得高兴的是,氯甲基亚砜1j和正丁基亚砜1k可以得到收率较低的目标产物。若将碱由DBACO改为DIPEA可显著提高4ja和4ka的收率(分别为72%和66%)。然而,即使采用DIPEA作为碱,1i也不能得到目标产物。作者推测可能是因为1i的伯烷基容易在碱性作用下发生去质子化作用。此外,间位取代和邻位取代的烷基芳基亚砜均能较好的生成目标产物,而对位取代的芳基亚砜1q和1r只能得到复杂的混合物。
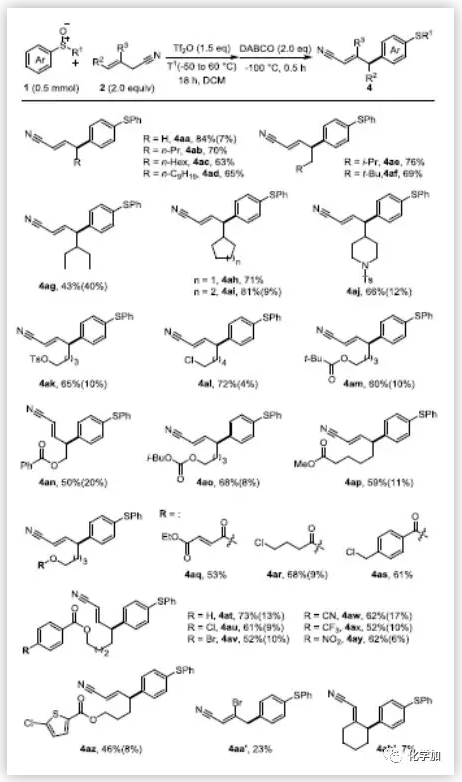
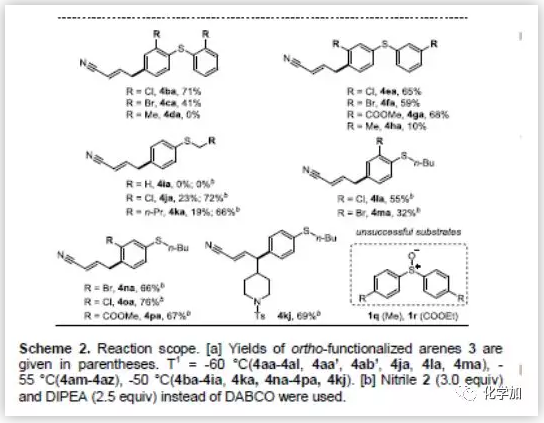
(图片来源:Angew. Chem. Int. Ed.)
为了阐明反应机制,作者进行了密度泛函理论(DFT)研究(Figure 1)。Figure 1中详细的描述了完整的反应途径。沿着黑色路径前进,首先是Tf2O激活1a产生离子对,然后离子对与2a作用形成更稳定的三元中间体IM1。紧接着,IM1中间体受到腈基的亲核进攻经历TS1过渡态,最终生成IM2中间体。末端烯基也可进攻IM1中间体,形成的TS1a过渡态不如TS1中间体稳定,可能是因为烯基的亲核性不如腈基强。此外,与末端烯基相比,暴露的腈基能够提供Sδ+和Oδ-Tf之间所需的静电吸引力,而TS1a过渡态中不存在这种静电吸引力。为了证明计算结果的准确性,作者进一步进行了在线核磁研究。NMR显示:标准条件下,不加入DABCO,IM2中间体依旧会生成。IM2中间体生成后,DABCO活化IM2中间体发生去质子化作用形成过渡态TS2,进而发生E1cB消除反应,最终生成乙烯基酮亚胺锍中间体IM3。IM3中间体既可发生[5,5]-σ重排反应又可发生[3,3] -σ重排反应。而TS3过渡态发生[5,5]-σ重排反应所需的能量比TS3a过渡态发生[3,3]-σ重排反应所需的能量低。其次,六元环的环张力不利于[3,3]-σ重排反应。所以,最终TS3过渡态发生[5,5]-σ重排反应生成IM4中间体,IM4中间体脱芳基化最终生成产物4aa。
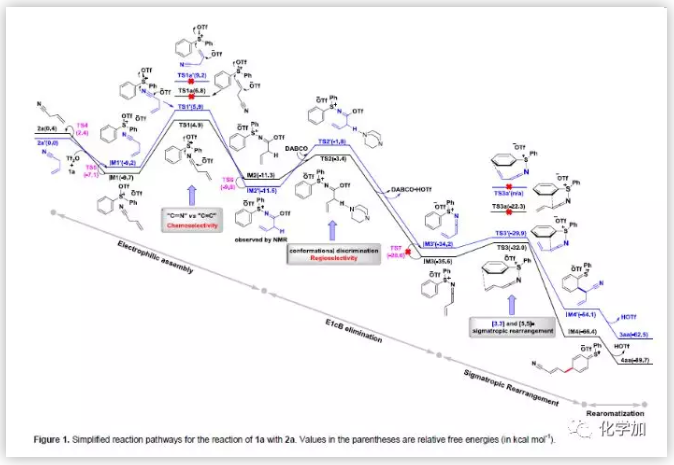
(图片来源:Angew. Chem. Int. Ed.)
为了证明产物的应用潜力,作者又对目标产物进行了一系列的衍生反应和克级反应(Scheme 3)。作者充分利用每个官能团进行衍生反应,包括还原、氢化、脱硫、氧化等均能得到良好到优秀的产率。同时,作者还做了克级规模反应,能以良好的收率制备10克以上的化合物4aa。
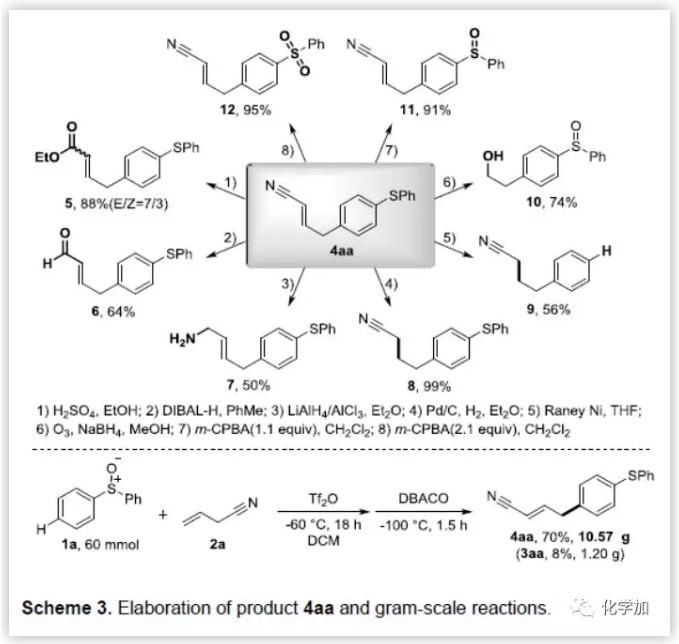
(图片来源:Angew. Chem. Int. Ed.)
小结:借助“组装/脱质子”策略,彭勃课题组与汪志祥课题组合作,发展了芳基亚砜与烯丙基腈的高选择性[5,5]-σ重排。该反应克服了[5,5]-σ重排反应中经常出现的一些问题,表现出优良的化学和区域选择性,良好的官能团兼容性和广泛的底物范围。本文的研究为[5,5]-σ重排反应的发展提供了新思路。
撰稿人:暖冬
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn