

据统计,预计到2030年,胰腺癌将成为美国癌症相关死亡的第二大疾病。而死亡的主要原因之一是肿瘤转移。因此,在药物发展中急需能够阻止肿瘤转移的新方法以及新药物。
关键膜受体的分布和降解在肿瘤细胞的侵袭和转移中起着至关重要的作用。肌纤维素(MYOF)是一种内吞和囊泡转运相关的膜蛋白,在胰腺癌、乳腺癌、细胞淋巴瘤和肺癌中有明显的高表达,而在正常组织中不表达。有文献表明,MYOF通过调节转移相关蛋白如表皮生长因子受体(EGFR),血管内皮生长因子受体2(VEGFR 2)和基质金属蛋白酶(MMPs)的活性参与癌细胞的迁移和侵袭。此外,MYOF是维持胰管腺癌线粒体分支结构和高氧化磷酸化活性所必需的,影响胰腺癌细胞的能量代谢。因此,应用新型MYOF调节剂治疗转移性胰腺癌是一种很具吸引力的治疗方法。
华东师范大学陈益华、易正芳、刘明耀课题组报导了一系列的1,5-二芳基-1,2,4-三唑衍生物,活性测试表明,先导化合物6y在体内外均显示出有效的抗胰腺癌活性。相关研究表明,6y可能与新型抗肿瘤转移靶点肌铁蛋白(MYOF)结合,调控囊泡转运和转移相关蛋白。机制研究表明,6y通过逆转上皮间充质转移,抑制基质金属蛋白酶分泌,阻断受体酪氨酸激酶,抑制胰腺癌转移。
在该课题组以往的研究基础上,作者将2,3-二芳基-4-噻唑啉酮类化合物2a作为先导化合物进行结构修饰。作者将母核结构换为三氮唑,增加抗转移活性;将二芳基换为亲水性杂环芳香类结构以改善其理化性质,对卤代苯乙基侧链也进行了优化(Figure 2)。
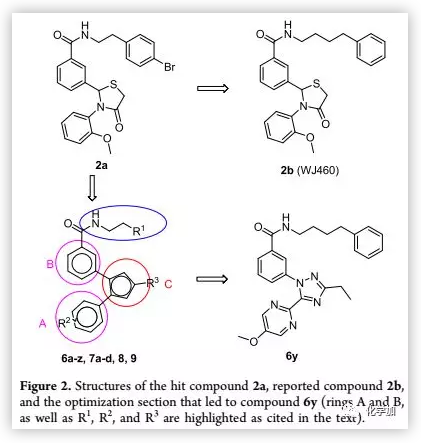
(来源:J. Med. Chem.)
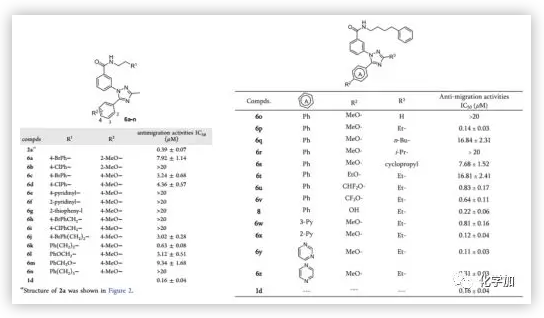
通过对所有设计的化合物进行抗转移活性测试,作者发现化合物6y(IC50 = 0.11 μM)表现出与阳性对照1d(IC50 = 0.16 μM)相当的抗迁移活性。
(来源:J. Med. Chem.)
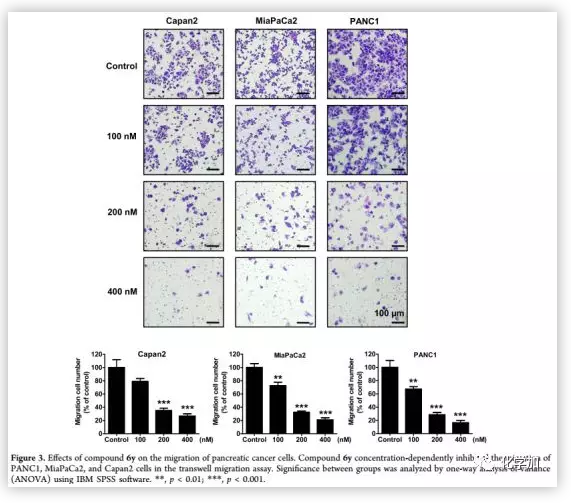
为了进一步验证6y的抗迁移活性,作者选择了另外两个胰腺癌细胞系MiaPaCa 2和Capan 2进行细胞迁移实验(Figure 3)。结果表明,6y浓度依赖性地减少了MiaPaCa 2和Capan 2细胞迁移的细胞数,表明其对胰腺癌细胞的运动有较强的抑制作用。
(来源:J. Med. Chem.)
由于化合物6y具有潜在的抗转移、抗入侵活性及良好的理化性质,因此,作者在细胞模型的基础上对其毒性进行考察。作者利用MTS法对人胰腺癌细胞系(MiaPaCa 2和PANC1细胞)和正常人细胞系(HPED6-C7, HAF和MCF-10A)测定半数最大抑制浓度(IC50)(Table 5)。结果表明,化合物6y对3株胰腺癌细胞的IC50值为2.85−0.84 μm,在3株正常人细胞系的IC50值为8.54−27.56 μm。为了排除6y的细胞毒性导致抑制细胞迁移的可能性,作者用不同浓度(0.1,0.3,1.0μm)的6y对PANC1进行了额外的实验(Figure S1)。结果表明,化合物6y对PANC1的细胞毒性不影响其抗肿瘤作用。
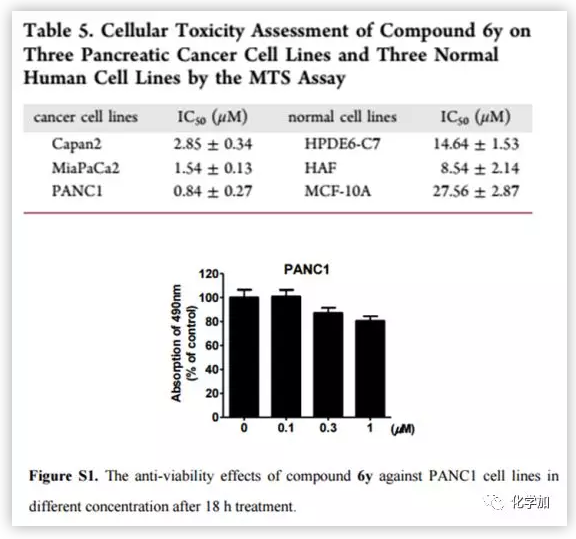
(来源:J. Med. Chem.)
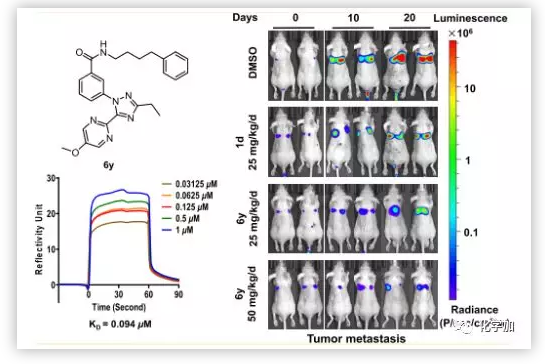
作者为了探讨本系列化合物的可能靶点, 采用SPR生物传感器对肌C2D结构域与3种代表性化合物(6p,6k,6y)的相互作用进行了研究。6k是最先被测定出在PANC1细胞抗转移活性测试中IC50值低于1 μm的化合物,6p由于C环中乙基的取代使生物活性增加了大约4倍(6p vs 6k),因此可用于观察相应的结合亲和力变化。6y具有最佳的抗菌、抗入侵活性和最优良的理化性能。结果显示 ,化合物6y与肌球蛋白C2D蛋白呈浓度依赖性和可逆性结合,Kd值为0.094 μm(Figure 4)。
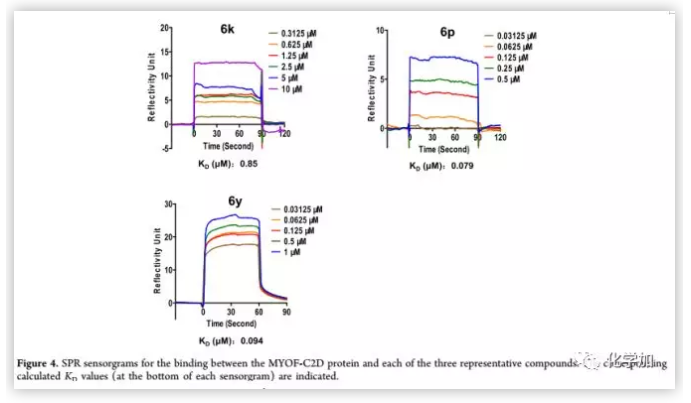
(来源:J. Med. Chem.)
STD是研究配体−受体相互作用的最有力的核磁共振技术之一。作者利用STD-NMR技术,观察了化合物6y与MYOF的直接结合(Figure 5)。与SPR实验结果一致,在STD谱中观察到6y与MYOF的直接结合。嘧啶和甲氧基的SDD信号较弱,表明嘧啶(环A)和甲氧基基团比环B更易溶于溶剂。相反,位于N取代侧链尾部的苯环上的质子1和环C上乙基取代处的质子表现出最强的STD信号,表明这些质子被掩埋在蛋白质中。
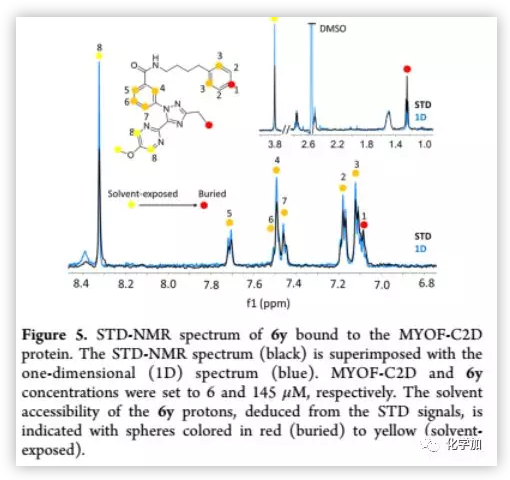
(来源:J. Med. Chem.)
化合物6y通过SPR和STD-MR实验证明与MYOF结合,且具有良好的生物活性和理化性质。为了确定6y的生物学效应是否与MYOF有关,作者对MYOF基因敲除细胞和MYOF过表达细胞进行了6y敏感性试验(Figure 6)。结果表明,MYOF基因敲除的PANC 1细胞减少了迁移,显示出MYOF在迁移中的关键作用。PANC 1细胞株对MYOF的基因消融导致细胞对6y的敏感性降低。基因拯救表达MYOF恢复化合物6y的抗移植物活性,表明6y通过与MYOF作用,抑制了癌细胞迁移。
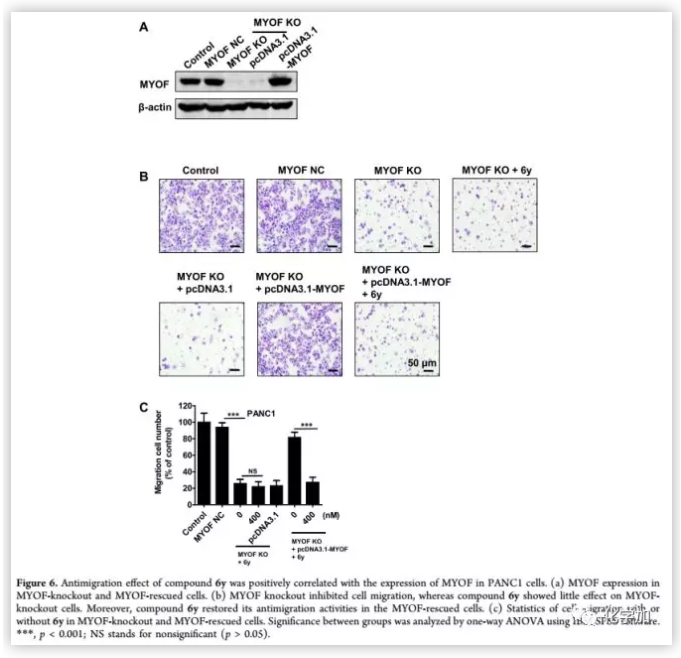
(来源:J. Med. Chem.)
因为6y能够明显的抑制胰腺癌的转移和增殖,并且对MYOF有结合作用,作者在基于荧光素酶的动物生物发光成像技术基础上,以BALB/c裸鼠胰腺癌肺转移模型测试了6y的抗转移活性(Figure 7)。结果显示,6y呈剂量依赖性抑制胰腺癌肺转移,且抗肿瘤转移活性优于同剂量阳性对照组。在第20天,处理组的平均发光下降约3倍和5倍(分别为25和50 mg/(kg·d))。表明肺转移负担明显减轻。3周后存活率分别为25%(阴性对照)、60%(阳性对照)、75%(6y,25 mg/(kg·d))和87.5%(6y,50 mg/(kg·d)。证明化合物6y显著延长了整体存活时间。
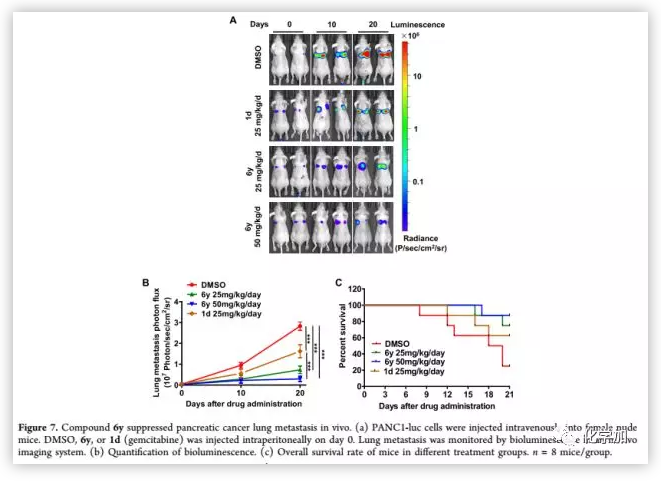
(来源:J. Med. Chem.)
最后,作者对化合物6y抗肿瘤转移的可能机制进行了研究。EMT是细胞极性丧失、间充质和迁移表型产生的过程,促使肿瘤细胞向侵袭性表型转移。因有报道称MYOF基因消融可逆转乳腺癌细胞的EMT,作者探讨了PANC 1细胞的EMT过程是否受6y的影响。Western blot结果显示,6y可以逆转胰腺癌细胞进入上皮状态。在肿瘤转移过程中,癌细胞会分泌多种MMPs降解细胞外基质和基底膜来促进肿瘤转移和侵袭。作者对经6y处理的PANC 1细胞的培养基进行收集浓缩,发现6y梯度依赖性抑制PANC 1细胞中MMP1和MMP2的分泌。
MYOF是RTK循环的关键调节因子,而VEGFR和EGFR是胰腺癌临床治疗的两个主要的RTK药物靶点。因此作者检测了6y对VEGFR和EGFR的影响。Western blot分析显示,6y可降低PANC 1细胞中VEGFR 2和EGFR 2的水平。6y处理PANC1细胞可引起EGFR在10 ng/ml EGF刺激下的持续磷酸化,阻断EGFR信号通路。这些结果表明,6y通过VEGFR 2和EGFR 2通路以剂量依赖的方式抑制肿瘤转移。
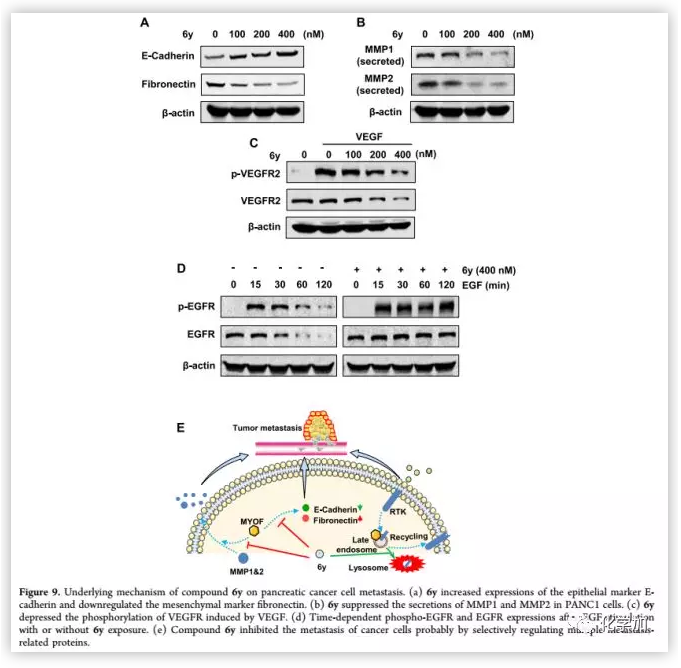
(来源:J. Med. Chem.)
总结:华东师范大学陈益华、易正芳、刘明耀课题组报导了一种新的预防胰腺癌转移的治疗策略。通过对一系列二芳基1,2,4-三唑衍生物进行筛选,作者发现化合物6y以纳摩尔的IC50值抑制胰腺癌转移和增殖,SPR分析表明,6y与MYOF-C2D具有纳摩尔级的亲和力。STD-NMR实验表明,芳香尾链是该抑制剂最隐蔽的区域,而A环则是该化合物中溶剂暴露程度最高的部分。化合物6y对MYOF基因敲除细胞没有明显的抑制作用,并恢复了对MYOF基因敲除细胞的活性。更重要的是,化合物6y能有效地阻断PANC 1在体内的转移,而没有表现出明显的毒性。MYOF抑制剂可能通过逆转EMT,抑制MMP1和MMP2的分泌,同时影响VEGFR 2和EGFR的磷酸化而发挥其作用。
撰稿人:安fen
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn