


1,2,3-三唑是广泛应用于药物化学和材料科学中的氮杂芳烃,是有机合成中进行各种重要转化的关键中间体。因此,开发高度官能团化的1,2,3-三唑的有效合成方法引起了化学家们极大的兴趣,而反应的区域选择性控制备受关注。过渡金属如铜催化的叠氮化物-炔烃环加成(CuAAC)效果很好,并且已经进行了广泛的研究。然而,由于底物限制和过渡金属在化学生物学中的潜在毒性,1,2,3-三唑的非金属合成方法急需开发。
目前,已报道的方法包括张力促进的叠氮化物-烯烃环加成、Ramachary-Bressy-Wang环加成、烯醇化物介导的叠氮化物-炔烃环加成、非叠氮化物反应和其他反应,但关于1,4-二取代和1,4,5-三取代1,2,3-三唑的合成鲜有报道。其中,仅三种相关的合成方法:1)2014年,Ramachary等人利用可烯醇化的醛合成了1,4-二取代三唑(Scheme 1aI),其后续又将该方法扩展到三取代三唑的合成(Scheme 1aII)。然而,在两种情况下,叠氮化物都限于芳基,后一种情况下,R2基团限于芳基;2)同年,汪舰等人以α,β-不饱和酯为底物在DBU催化下合成了1,4,5-三取代的三唑(Scheme 1b)。然而,当用β-甲氧基-α,β-不饱和酯时,产物是1,4-二取代的三唑(Scheme 1bII);3)2017年,汪舰等人利用β-取代的丙烯醛与烷基/芳基叠氮化物进行NHC-催化的交叉偶联得到了具有高度区域选择性的三唑(Scheme 1c)。然而,两种催化体系均需要高温条件。鉴于1,2,3-三唑的广泛应用性(特别是在生物化学研究中),开发一种底物适用范围广、与水和室温条件相容的非催化版本是非常可取的。
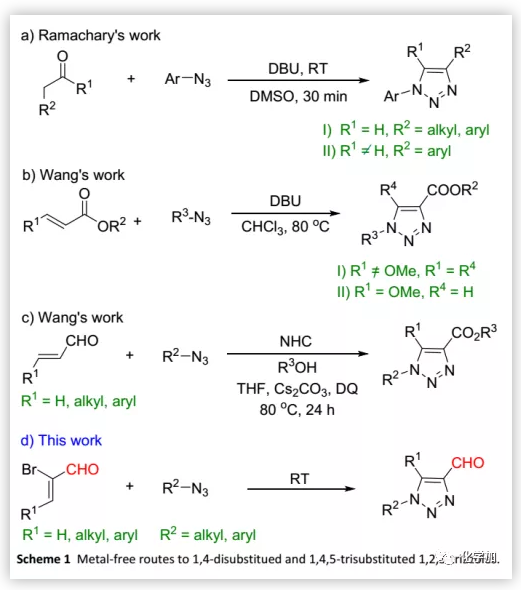
(图片来源:Green Chem.)
通过叠氮化物和烯烃之间的1,3-偶极环加成及后续消除是合成1,2,3-三唑的途径之一,但烯烃的弱反应性使该方法未深入开发,仅有少数非金属催化的区域选择性实例报道。此外,甲酰基三唑是进行化学转化的重要中间体,也是构建许多生物活性化合物的关键中间体,但甲酰基三唑的区域选择性合成仍然具有挑战性。在活性化合物的全合成中,甲酰基三唑一般由炔丙醇与叠氮化物通过CuAAC反应制备得到羟甲基化的三唑再氧化产生,或者由α,β-炔基醛与叠氮化钠进行环加成产生,均没有区域选择性。鉴于甲酰基三唑在生物化学方面具有广泛的合成潜力,近日,华侨大学高利柱课题组首次报道了非金属催化的区域选择性合成1,4-二取代和1,4,5-三取代的甲酰基-1,2,3-三唑的通用合成方法(Scheme 1d),该成果近期发表于Green Chem.(DOI: 10.1039/C9GC01129C)。
首先,作者以α-溴代丙烯醛和苯乙基叠氮化物作为模型底物开展研究,反应36 h后分离得到甲酰基三唑(54%)。在相同反应条件下,作者筛选了多种反应溶剂如甲苯、DMF、乙腈和其他溶剂,发现在DMSO中反应收率更高(86%)。令人欣喜的是在室温下,于H2O中反应36 h可以70%的分离收率得到甲酰基三唑;加入10 mol% TBAB作为相转移催化剂可以将收率提高至78%。为了进一步提高收率,作者在DMSO/H2O(7:3,v/v)混合溶剂中测试了反应,并将分离收率提高至95%。在相同反应条件下,用α-溴代丙烯醛作为受限制的反应物时收率降低至71%,原因可能在于α-溴代丙烯醛的沸点较低且易聚合。作者尝试在不同比例DMSO/H2O中进行反应时,收率也降低。随后,作者考察了卤素取代基对反应的影响。α-氯代丙烯醛和α-吲哚丙烯醛均反应良好,但收率均低于α-溴代丙烯醛。最后,作者确定DMSO/H2O(7:3,v/v)混合溶剂作为最佳介质、α-溴代丙烯醛作为最佳转化底物时,收率很高。此外,在所有情况下,根据粗品NMR分析,可以区域选择性仅得到产物1。
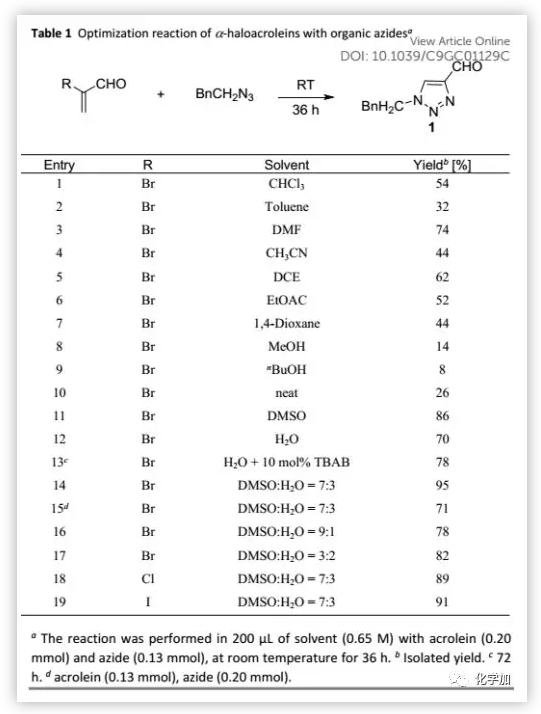
(图片来源:Green Chem.)
在确定最佳反应条件后,作者将该方法用于1,4-二取代1,2,3-三唑的合成(Scheme 2),利用多种叠氮化物均可以优异的收率(82%~99%)得到相应的三唑。化合物1可以克级规模制备,收率高达89%。其中,产物5的构型通过单晶-X射线衍射分析确证(Figure 1)。苯环上含强吸电子基的苄基叠氮化物可以较低的收率(84%~88%)得到相应的产物;二级叠氮化物(尤其是环戊基叠氮化物和环己基叠氮化物)也可以良好的收率(77%~90%)得到相应的产物。在标准反应条件下,含有各种官能团如酯基和羟基的叠氮化物均具有良好的耐受性(收率,60%~91%)。该方法还成功地用于双官能团化的合成砌块,以83%的收率得到柔性双(三唑)21。此外,由于芳香叠氮化物反应性低,在高温下也难以反应;然而,通过该方法直接实现了高生物活性分子的简短合成(22-24)。
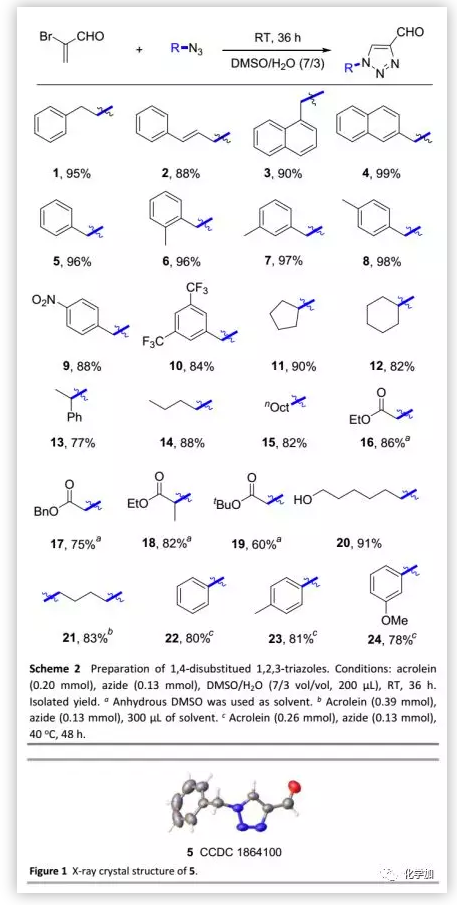
(图片来源:Green Chem.)
随后,作者将该合成方法用于1,4,5-三取代1,2,3-三唑的合成(Scheme 3)。室温下,将α-溴-β-乙基丙烯醛在DMSO/H2O中反应48 h后,仅以的21%分离收率得到25。然而,将溶剂替换为氯仿后,可以显著提高25的分离收率。在优化的条件下,β-甲基、长链正庚基和具有空间位阻的环己基叠氮化物均可以良好的收率(60%-78%)得到相应产物。接下来,作者又尝试了α-溴-β-苯基丙烯醛。由于其具有共轭体系,可以在温和加热条件下进行环加成。对于α-溴-β-苯基丙烯醛,无论在邻位、间位和对位存在何种给电子或吸电子基团,都可以产生预期产物(29-35)。有趣的是,通过NMR分析确定化合物30中每个-CH2-上的两个质子均是磁不等价的。
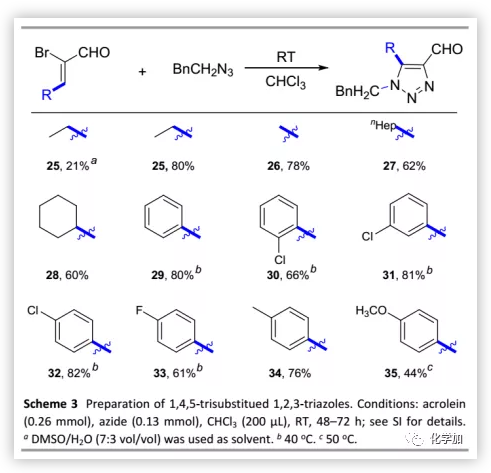
(图片来源:Green Chem.)
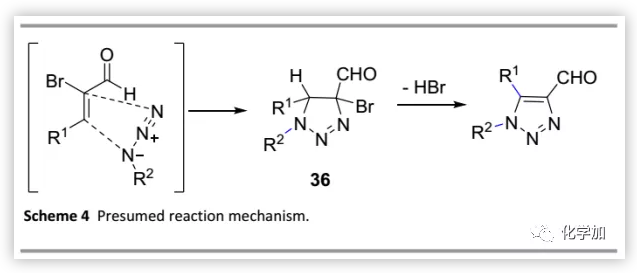
作者推测的反应机制(Scheme 4),与于先前的报道类似。首先,在吸电性溴原子存在下,丙烯醛被活化并且LUMO能量降低,从而促进其与有机叠氮化物的环加成以区域选择性得到中间体36。然后,消除一分子HBr得到目标产物。
(图片来源:Green Chem.)
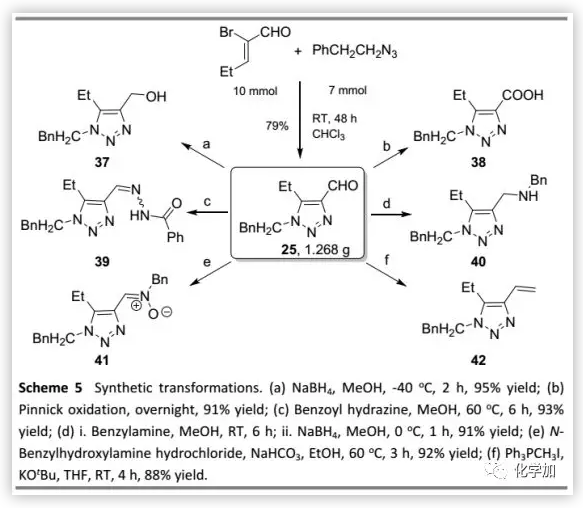
为了进一步证明这种方法的实用性,作者以克级规模制备得到25(注意:反应是放热的!应该将叠氮化物缓慢加入丙烯醛溶液中),然后用其进行衍生化(Scheme 5)。三唑25分别经还原和氧化以高收率得到醇37和酸38,它也可以在60 ℃甲醇中转化为腙39(E/Z异构体,2.3:1);与苄胺反应后,经还原得到β-苄基氨基三唑40;在乙醇中与N-苄基羟胺盐酸盐缩合得到N-苄基硝酮衍生物41;在室温下发生Wittig反应得到端烯42。
(图片来源:Green Chem.)
总结:华侨大学高利柱课题组开发了一种非金属区域选择性合成路线用于1,4-二取代和1,4,5-三取代1,2,3-三唑的合成,该反应具有广泛的底物适用范围并且可以在室温DMSO/H2O混合溶剂中合成1,4-二取代的三唑。此外,该反应还同时在1,2,3-三唑的C4位引入醛基,为后续进行各种衍生化提供了“把手”。可以预见,作者开发的1,4-二取代和1,4,5-三取代1,2,3-三唑的合成方法在各个领域都将具有很高的应用价值。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn