

近年来,一类以动力学过程为主导的基因表达调控元件引起人们的关注。此类元件对下游报告基因的表达调控主要由动力学过程实现,其对目标配体的响应过程通常在几秒内发生。响应过程中没有明显的稳定平衡状态,调控元件的转录和翻译过程持续发生,过程中各生物大分子(RNA聚合酶、核糖体、转录终止因子等)之间的动态配合决定了下游被调控基因的表达水平。一些代表性的调控元件包括核糖开关、原核生物中的前导肽以及真核生物中的上游开放读码框(uORF,upstream Open Reading Frame)。在天然状态下,这些调控元件主要参与到生物体内多种重要的信号通路,如细菌的环境压力响应、植物的养分感知、人类疾病相关基因的调控。对此类元件作用机制的深入探究一方面能够提升对相关信号通路调控网络的认知水平,为微生物耐药性、作物培育、人类基因相关疾病的研究提供理论指导;另一方面,在明确其调控原理的基础上,有可能将其改造为代谢物生物传感器。由于这类调控元件以动力学过程为主导的特点,相比于传统蛋白质调控类的传感器,此类传感器在响应配体分子的响应速度方面具有独特优势。
然而由于这些调控元件发挥功能时的动力学过程变化迅速,导致对于其动力学机制的理解十分困难。基于零散突变分析,结构解析和体外生化等传统手段, 只能对动力学过程中一些较为稳定的中间状态进行研究,无法提供元件整体及其连续动态的作用机理。对于此类动力学过程主导的响应元件,如果能够通过高通量的表征手段获取其响应过程的分子机制(如元件所有位点所有突变类型对其响应性能的影响),结合已有的静态研究结果,就可以建立该元件响应过程的动力学模型,进而从动态的角度来对调控元件进行机理分析,在进一步理解其机制的基础上,为代谢物生物传感器的改造提供方法基础。
论文选取这类调控元件中重要的TnaC前导肽为研究体系。TnaC前导肽是核糖体阻滞肽(ribosome-arrest peptide)的一种,通过协调RNA聚合酶、核糖体和Rho转录终止因子三种大分子机器在转录翻译tnaC过程中的动力学行为,可以对一定浓度范围的胞内色氨酸产生响应,调节重要的种间信号分子吲哚的合成。论文首先建立了基于流式分选-测序(FACS-seq)高通量分析的完整实验操作流程和数据分析框架,在该框架下对包含1450个成员的tnaC突变文库在多个色氨酸浓度下的响应特性进行了测量。根据FACS-seq分析结果绘制出了tnaC传感器的“序列-性能”图谱,该图谱的深度分析结果,除了能够验证已报道的tnaC功能外,还发现了其响应过程中诸多未知的重要中间状态,并结合文献调研与实验验证提出了这些新发现背后可能存在的动力学机制。
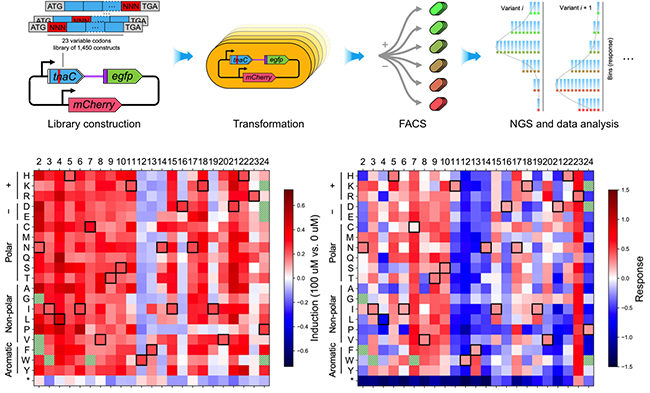
图1. 本论文建立的FACS-seq高通量分析流程及TnaC深度突变扫描图谱
在此基础上,为了回答FACS-seq分析是否完整捕获了全部重要的响应中间状态,以及这些动力学中间态如何相互协调影响tnaC响应性能这一基本科学问题,论文以新发现的tnaC响应过程关键节点为基础,建立了描述其协调RNA聚合酶、核糖体和Rho转录终止因子三种大分子机器动力学行为的随机过程模型,该模型能够准确预测不同突变体的响应性能,对于tnaC基础响应和诱导相应之间的平衡关系给出了定量的机制性理解。最后该模型为改造tnaC传感器的性能指标提供了指导方案,据此获得了检测范围有明显扩展的tnaC传感器突变体。
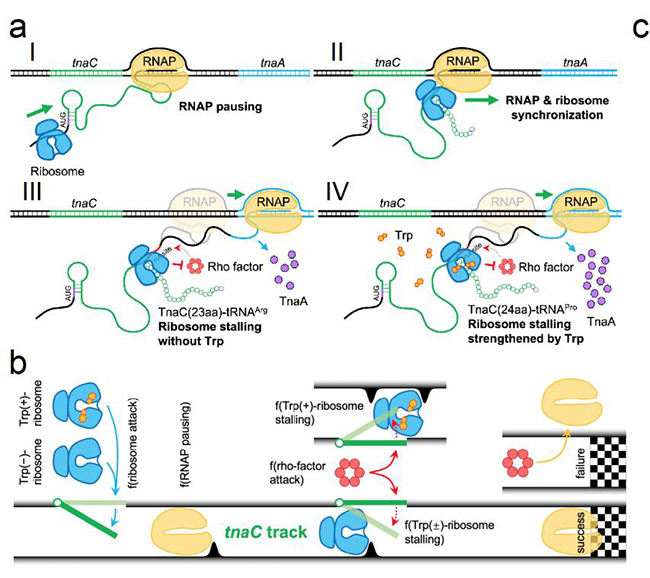
图2. TnaC动态响应机制及其动力学随机过程模型
此外,根据上述分析,本论文还提出了tnaC功能模块化的观点:以其中的色氨酸残基为分水岭,仅仅75个核苷酸组成的tnaC基因的上下游两部分分别在mRNA和肽水平上独立控制其动力学过程的几个关键参数。系统发育分析揭示了模型预测的tnaC基因功能模块化现象在肠道细菌中的普遍存在性。由于吲哚生物合成的调控在这些肠道细菌演化历程中受到了严格的选择压力,这进一步反映了吲哚信号分子在肠道菌群中的重要潜在功能。tnaC关系到重要信号分子吲哚的合成与运输,该发现对研究吲哚信号通路和压力因子耐受性具有重要意义。
化工系张翀副教授和王天民博士(现为清华大学医学院博士后)为本文通讯作者,生物育种技术与装备团队首席邢新会教授为本文共同作者,他们均为清华大学合成与系统生物学研究中心核心成员。王天民博士和清华大学化工系已毕业博士研究生郑翔为本文的共同第一作者。该成果得到了国家自然科学基金委重点仪器研发项目、面上项目的资助。
论文链接:
https://www.nature.com/articles/s41589-019-0430-3
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn