

文 | 徐佳琳 毕业于加拿大英属哥伦比亚大学;
马培敏 毕业于美国普度大学。
两位均供职于某药企临床药理部门。本文仅代表个人观点,与所在公司无关。
太长不看版:
瑞德西韦治疗新冠病毒的临床试验已经启动。
在当前缺药的情况下,重新启动瑞德西韦这样的药物是紧急情况下“老药新用”的合理尝试,但面临巨大挑战和风险。
临床试验设计中的瑞德西韦剂量已经接近安全剂量的上限,但能达到的体内浓度依然低于体外测试时抑制病毒所需浓度。
战略性储备尽量多的广谱抗病毒药物,才可能避免在未来疫情中再次陷入目前无药可用的困境。
自新冠肺炎爆发以来,“药物临床试验”这个名词频频进入公众的视野。从1月底到2月10日,中国研究者们已注册了81项相关的临床试验,各式各样的都有。
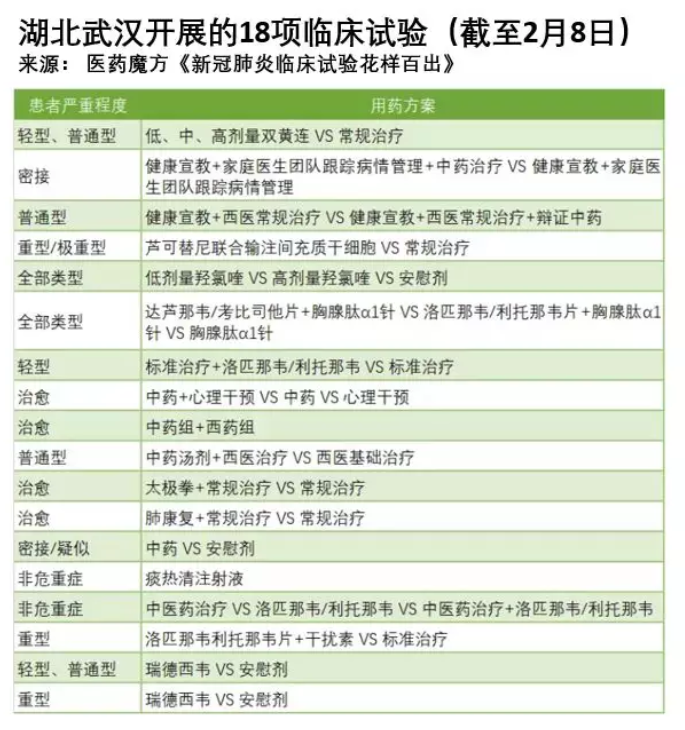
图片来自与网页截图
在各类药物和疗法信息中,以瑞德西韦最为耀眼,被不少媒体和公众号誉为“特效药”、“神药”。
瑞德西韦治疗新冠病毒感染的临床试验,已于2月5 日启动(ClinicalTrials.gov编号:NCT04252664及NCT04257656)。大家可能知道,这个药物几年前在抗埃博拉病毒的临床试验中失败了,那这次它有多大希望成功呢?
每个人都有自己的看法,我们想从临床药理学角度,解析和讨论使用瑞德西韦治疗新冠肺炎临床试验的可能理由及用药方案。
临床药理学:连接临床前体外实验、动物实验和人体临床确证性试验的专门学科,也是制订和指导药物的临床用法用量的主要工具。
瑞德西韦能抑制新冠病毒么?
2017年,吉利德公司的科学家们发现,他们正在开发的抗埃博拉病毒药物瑞德西韦对包括SARS、MERS等人类冠状病毒以及多种蝙蝠携带的冠状病毒都具有活性。
在用人类呼吸道上皮细胞做的体外实验中,瑞德西韦对SARS和MERS病毒的EC50分别为0.069和0.074μM(微摩尔每升)。
EC50是衡量药物抑制病毒活性的一个浓度指标,一般来讲,这个数值越小,说明抑制病毒的能力越强。
在这个基础上,中科院武汉病毒所对新冠病毒做了类似研究:在来源于肾脏的上皮细胞中,瑞德西韦对新冠病毒的EC50为0.77μM,数值看起来比抑制SARS等病毒的能力低了近10倍。
诚然,两次试验结果不能直接比较,因为来自不同实验室,试验用了不同类型细胞(人类呼吸道vs 猿猴肾脏)。但数值提示我们:瑞德西韦对新冠病毒有体外活性,但抑制能力可能不如对SARS和MERS病毒的强。
另外,目前还没有新冠病毒的动物模型验证过瑞德西韦对新冠病毒具有体内活性。
瑞德西韦能达到需要的剂量么?
药物的判断标准,包括了疗效和副作用。一个理想的抗病毒药物,应当能抑制体内病毒,又不会或很少产生不良反应。
要判断一个药物对人体的潜在疗效或安全性,通常是从体外实验或动物实验的数据来推论。其中最关键的数据之一,就是药物浓度。
当实验药物进入临床试验时,先要了解的就是它在人体内达到的实际浓度。
瑞德西韦很特殊,它需要进入细胞内部被转换为活性代谢物(代号GS-443902),才能发挥抑制病毒的作用。2018年发布的早期临床试验报告中,29名健康人使用瑞德西韦后,体内血浆药物和PBMC中活性代谢物的平均浓度如下:
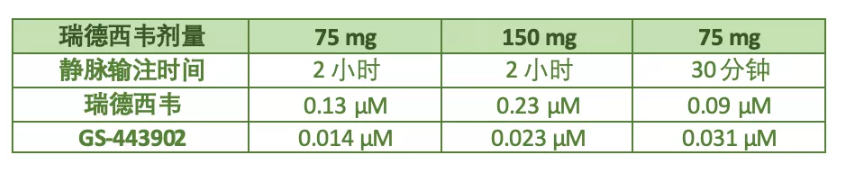
注:数据经药代动力学计算与单位转换
从这个表格中,可以看到:
1)药物剂量与瑞德西韦及其活性代谢物的浓度大体成比例;
2)静脉输注时间越短,细胞内药物有效成分(GS-443902)的浓度越高。
按照我们查阅的数据,这次瑞德西韦治疗新冠病毒感染的临床试验中的试验剂量为第1天200mg,第2-10天每天100mg。
我们先看看瑞德西韦能达到抑制病毒需要的浓度么?
假设采取30分钟静脉匀速输注给药,可以粗略推算出体内平均浓度为0.12μM,比武汉病毒所测得的EC50要低很多。如果想要人体中的浓度超过武汉病毒所测出的体外EC50(0.77μM),则需要提高剂量到每天至少650mg(假设在增加剂量时,瑞德西韦体内浓度按比例增加)。
即使药物在人体的平均浓度达到EC50,距离药物临床有效仍有距离。EC50只是实验室环境里抑制50%的病毒增长所需的浓度,而实际也许需要抑制人体内90%甚至更多病毒增长。
然后我们看看安全风险。
埃博拉的临床试验发现,在每天用药的情况下,多名使用150mg药物的健康人出现了轻度肝功能损伤,目前临床中已知的瑞德西韦最高单次安全剂量是225mg。因此,目前在中国开展的这两项临床试验中使用的瑞德西韦剂量已接近安全剂量的上限。
还值得一提的是,在体外细胞试验中,瑞德西韦抑制埃博拉病毒的EC50值介于0.06-0.14μM之间,对应活性代谢物约5μM,看起来比抑制新冠病毒的能力更强。即便如此,在2019年的抗埃博拉病毒三期临床试验中,瑞德西韦失败了,远不如同一研究中使用的其他两种药物,从此瑞德西韦被吉利德公司打入冷宫。
虽然我们内心都希望能尽快出现新药,但从药理方面的数据推导,目前瑞德西韦的试验剂量想要在人体内产生抑制新冠病毒的效应,非常困难。
“决定做”到“怎么做”,还要考虑哪些问题?
新药研发从来都不是一蹴而就的,从验证药物的体外活性,到动物体内活性、安全性,再到人体内的安全性和有效性研究,需要循序渐进,耗时多年。
非典爆发17年以后,目前尚无药物可有效治疗SARS或MERS等冠状病毒感染。
在当前缺药的情况下,重新考虑瑞德西韦这样的药物是紧急情况下“老药新用”的合理尝试,立即开展临床试验不失为一种快捷方法。
但是知易行难,“决定做”相对容易,想清楚“怎么做”和“做什么”就更困难,而后两者也是达成最终目标所必需的。
决定“怎么做”,就包括从临床药理的角度理性分析已有数据去帮助更好地设计试验。
值得考虑的临床药理因素包括种族差异、药物在人体内的剂量与浓度、药效/安全性的定量关系,药物适用人群等。另外,静脉输注时间为何会影响瑞德西韦及其活性代谢物浓度?药物是否存在肝脏蓄积?等等问题也是需要回答的。
除了做临床试验外,使用临床同情用药、制定建立药物有效性计划、设定严谨的数据库以准备相应的数据分析等,也应该作为真实世界证据研究的做法被考虑。
面对病毒,我们将何去何从?
自从生命诞生以来,人类与病毒导致的传染病对抗从未停歇:从1918年夺去几千万条生命的西班牙流感,到2003年的SARS,及本次新冠病毒等。长期存在于蝙蝠中的冠状病毒对它们无害,大多数情况下也不会感染人类。从宏观上,人类与动物、细菌、病毒等共同生存甚至互相依赖,所以我们热爱和珍惜的不应仅是人类的性命,还应敬畏其他动物生命,尊重大自然。
关于新冠病毒本身,许多问题需要继续研究:流行病学数据及传播方式,易感人群(老人或免疫功能较低、其他基础疾病患者等);迄今为止,新冠病毒的原始宿主(蝙蝠?)和可能的中间宿主(穿山甲?)尚未定论,意味着人们还难以从根本源头控制传染。
在和平时期,战略性储备尽量多的广谱抗病毒药物,才可能避免在未来疫情中再次陷入目前无药可用的困境。
新型传染病的大规模爆发有如悬在头上的达摩克利斯之剑:问题不是这样的事件是否会发生,而是什么时候发生。
当传染病再次来袭时,人类能否从容应对?
写在最后
疫情之下,作为科研工作者,我们能做和想做的,是以临床药理学为工具,帮助筛选、评估和开发有临床潜力的新老药物,为抗击新冠肺炎尽绵薄之力。
相信在举国守望相助、共克时艰的努力下,疫情终将得到纾解,也希望在一线英勇奋斗的医疗工作者能平安回家。
致谢:感谢孙雪莹、李宗益对本文中的学术问题提出宝贵意见和建议。
来源:微信公众号“菠萝因子” (ID:checkpoint_1)
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn