N-芳基咔唑骨架广泛存在于天然产物和功能性OLED材料中,芳烃的C-H胺化反应是构建该骨架最为有效的方法,而过渡金属催化作为常规方法,通常受底物的限制以及需要额外的氧化剂。此外,通过有机催化以对映选择性实现C-N手性轴的构建仍具有一定的难度。近日,南方科技大学谭斌教授课题组在Angew发表论文,首次提出通过有机催化策略,实现偶氮萘和咔唑底物合成新型轴向手性N-芳基咔唑骨架。该反应具有广泛的底物范围,并且以高对映选择性和高收率获得阻转异构的N-芳基咔唑衍生物。该方法不仅是传统金属催化C-N偶联反应的补充,同时也为合成N-芳基阻转异构体(atropisomers)衍生物和OLED材料提供了高效的途径。文章链接DOI:10.1002/anie.202000585
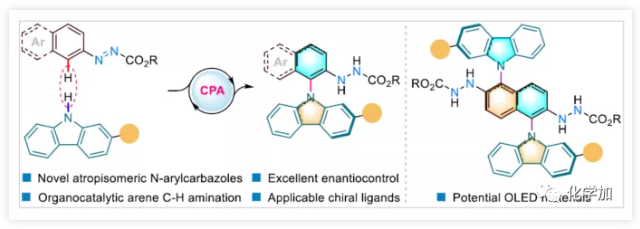
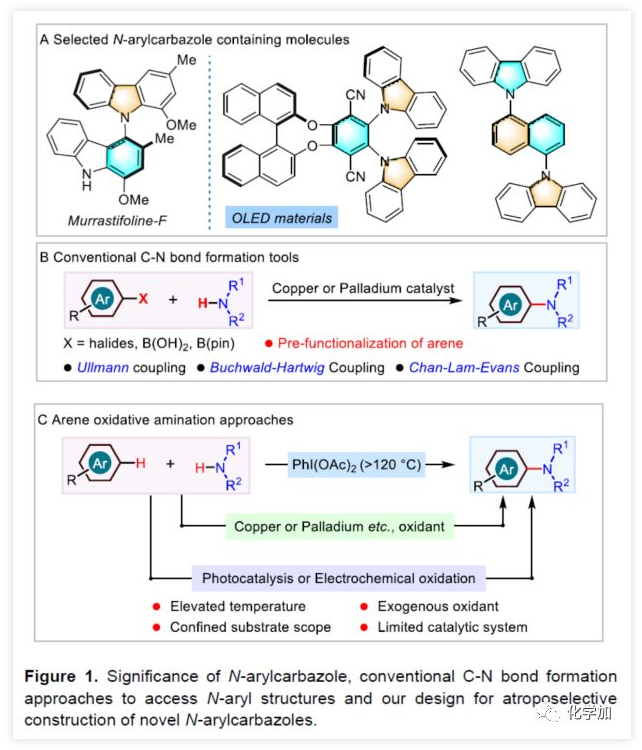
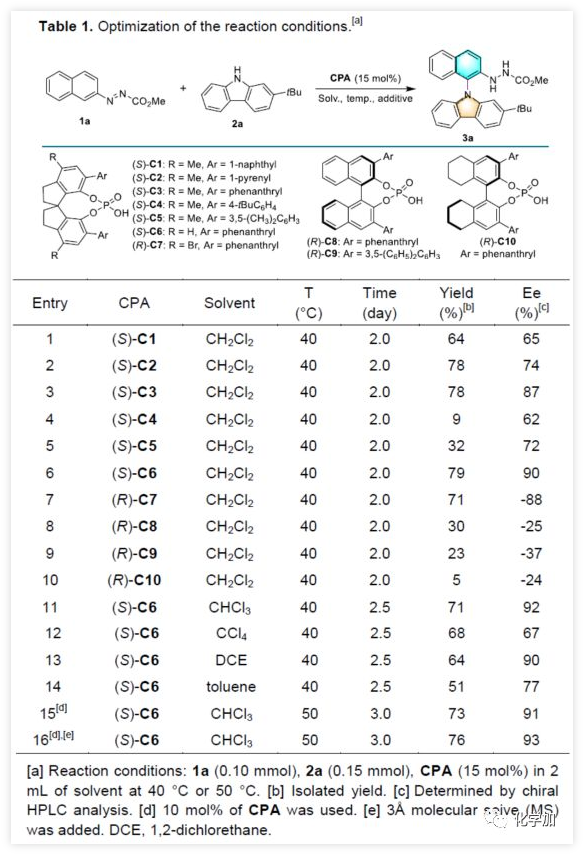
N-芳基骨架广泛存在于天然产物、药物、农药、功能材料等领域。近年来,具有高三重态能量和竞争性孔输运能力的N-芳基咔唑骨架广泛应用于OLED材料中(Figure 1A)。此外,由于材料领域的快速发展从而促进了合成新型N-芳基咔唑的研究,尤其是带有不同手性元素的骨架。因此,选择合适的催化剂并以对映选择性的方式合成此类骨架具有重要意义。常规过渡金属催化的N-芳基化反应(如Ullmann、Buchwald-Hartwig和Chan-Lam-Evans偶联反应)已成为构建C-N键必要的手段(Figure 1B)。但是,该方案常需对芳烃底物进行预官能化处理,同时容易产生自偶联等副产物。据文献报道,可使用高价碘、过渡金属、光催化和电催化等方案,实现芳烃氧化胺化反应,即可克服这些缺点(Figure 1C)。尽管有上述方案已取得一定的成果,但底物局限性仍限制了它们的应用,并且苛刻的反应条件不利于实现对映选择性的控制。同时,由于芳烃具有较低的活性以及极少的不对称有机催化方式,从而使有机催化实现芳烃对映选择性C-H胺化仍难以进行。 (图片来源:Angew. Chem. Int. Ed.)基于课题组前期研究的成果,作者发现,偶氮基团可以促进芳氢的活化,从而实现有机催化下的芳烃C-H芳基化反应。鉴于N-芳基咔唑在化学和材料科学中的重要性,作者尝试使用有机催化剂以实现咔唑与N-芳基底物的C-H胺化反应从而获得轴手性N-芳基咔唑产物(Figure 1D)。值得注意的是,偶氮基可以很容易地转化为胺,并为后期修饰提供了多种可能性。(图片来源:Angew. Chem. Int. Ed.)首先,作者以偶氮萘衍生物1a与2-叔丁基-9H-咔唑2a作为模型底物,进行相关胺化反应的筛选(Table 1)。当以磷酸(S)-C1(15 mol%)作为催化剂,在CH2Cl2中40 ℃反应,获得所需的轴向手性N-芳基咔唑3a(产率64%,65% ee)(entry 1)。尽管对映选择性中等,但证实可通过手性磷酸(chiral phosphoric acid)CPA催化实现芳烃C-H胺化反应。紧接着,作者对不同取代的CPA催化剂进行了筛选,在6,6'-位置带有菲基的(S)-C6可将产物的ee值提高至90%,同时收率也提高至79%(entries 1-6)。随后,将催化剂的手性改变时,均取得较差的结果(entries 7-10)。而对溶剂的筛选中,当使用氯仿作为溶剂时,可将ee值提高至92%(entries 11-14)。将催化剂的载量降低至10 mol%对反应结果影响不大(entry 15),如果将温度略微升高或加入3Å分子筛可进一步促进反应(entry 16)。(图片来源:Angew. Chem. Int. Ed.)
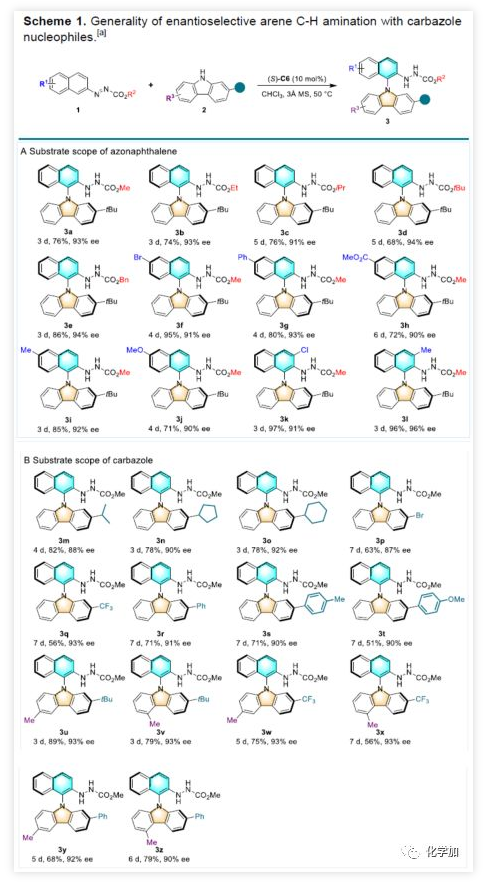
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Scheme 1)。首先,作者对各种偶氮萘衍生物1进行了相关的研究(Scheme 1A)。当甲酯基团改为乙基、异丙基、叔丁基、苄基等,均可获得相应的产物3b-3e(收率>68%,ee>91%)。同时,取代基电性和取代模式对反应影响较小,均可获得目标产物3f-3l。值得注意的是,当使用C3取代基的底物(3k和3l)时,收率可达96%。随后,作者对了9H-咔唑底物2进行了扩展(Scheme 1B)。当含有异丙基、环己基、溴、CF3、芳基等大位阻基团时,也可以获得相应的目标产物3m-3t。此外,C5和C6甲基取代的咔唑底物也与该反应兼容,以中等以上收率获得轴向手性N-芳基咔唑3u-3z(ee 值为90-93%)。(图片来源:Angew. Chem. Int. Ed.)
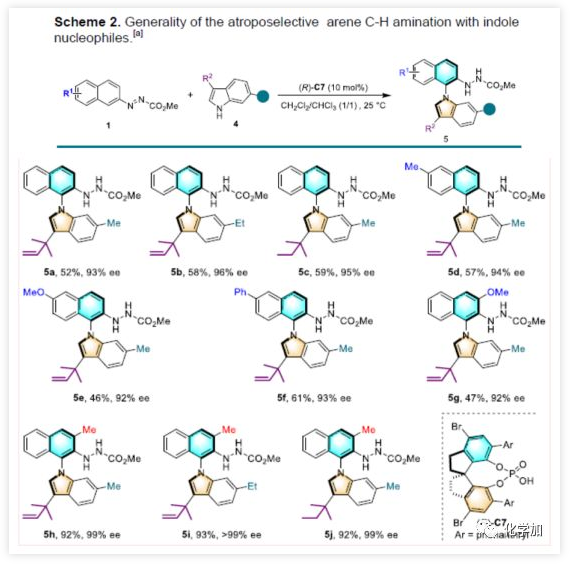
紧接着,作者将9H-咔唑底物2改为活性更高的吲哚底物4(Scheme 2)。反应结果表明,在吲哚C3位上含有大体积基团对于形成所需的N-芳基轴至关重要。当偶氮萘含有不同的取代基团时(甲基、甲氧基、苯基),均可获得中等以上收率的N-芳基吲哚阻转异构体5d-5g(ee值为92-96%)。有趣的是,在氮杂萘的C3位置上引入了一个甲基时,可将产物5h-5j的收率提高至92%以上,ee值为99%。(图片来源:Angew. Chem. Int. Ed.)
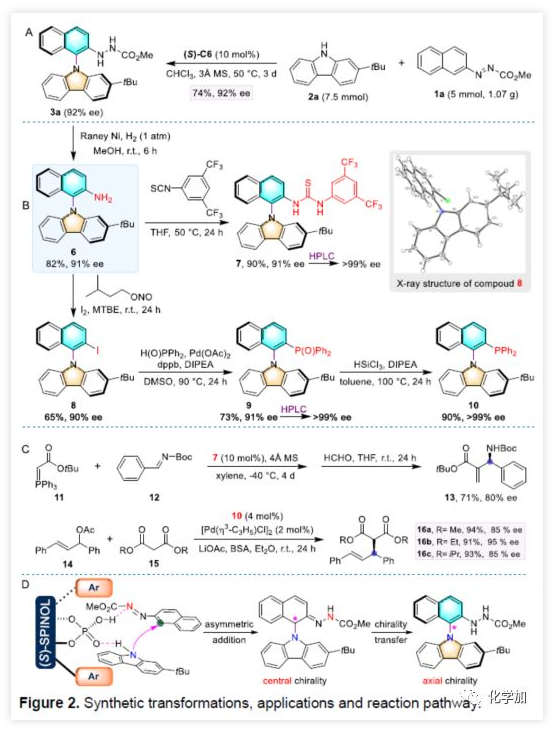
随后,作者对该反应的实用性进行了相关的研究(Figure 2)。首先,在标准条件下对反应进行放大,收率和ee与小试结果基本一致,从而表明该反应在大规模化学生产中具有一定的潜力(Figure 2A)。而产物3a在甲苯中110 ℃下加热48 h,HPLC分析表明3a的ee值并未发生改变,进一步说明了产物构型的稳定性。而手性轴的高稳定性,可促进其在不对称催化的有机催化剂或配体中的应用。因此,作者通过3a合成了阻转异构体硫脲7和单膦10产物(Figure 2B)。两步合成可获得产率为74%的产物7,ee值不变。同时,若以萘环上含有游离胺基的中间体6作为底物时,可经3步反应即可获得单膦产物10。通过使用半制备色谱纯化,可将两种产品的光学纯度提高至 99%以上。令人欣慰的是,硫脲7可促进了磷叶立德11和N-Boc亚胺12的反应,获得71%的收率和80%的ee的预期产物13。N-芳基咔唑10可以作为有效的配体用于钯催化丙二酸酯15与14的烯丙基烷基化反应(Figure 2C)。此外,作者也为芳烃C-H对映选择性胺化反应提供了一个可行的立体化学模型,该模型具有双功能CPA促进氢键活化以及轴向手性传递途径(Figure 2D)。(图片来源:Angew. Chem. Int. Ed.)
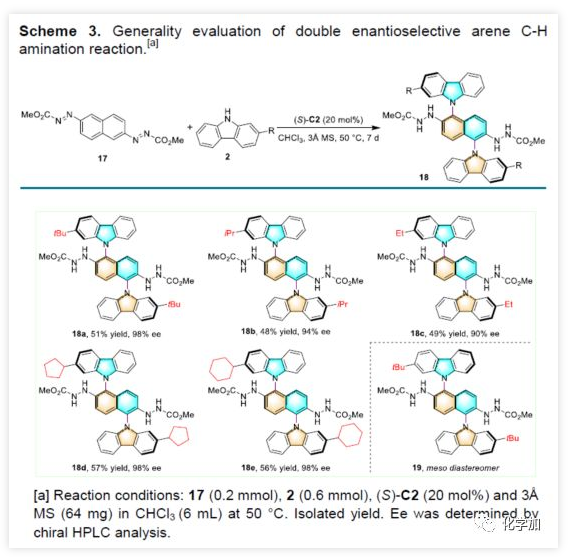
鉴于二咔唑取代的芳烃在OLED材料中的重要作用,作者试图合成具有两个手性N-芳基轴的骨架(Scheme 3)。首先,合成2,6-重氮萘17作为底物,再与咔唑2在标准条件下进行偶联反应,反应结果表明,可获得所需的1,5-二咔唑萘衍生物18,ee值高达98%,但收率仅为27%,可能是由于副产物19(16%)和约10%的单胺化产物导致。而对CPA催化剂筛选后,当使用螺骨架的6,6'-位上带有1-苯基的基团的(S)-C2时,可将收率提高至51%。同时,可以观察到令人满意的非对映选择性(18:19=4:1)。为了证明这种转化的通用性,作者使用在C2位上具有不同取代基的其他咔唑,均可获得中等收率相应的产物18b-18e(ee值>90%)。(图片来源:Angew. Chem. Int. Ed.)
总结: 南方科技大学谭斌教授课题组开发了首例手性磷酸催化,实现芳烃选择性的C-H胺化反应,以高收率和高对映选择性获得轴向手性N-芳基咔唑衍生物,同时也作为构建C-N键的补充(常规的方法为金属催化偶联反应)。此外,吲哚底物也适用于该类转化,以高光学纯度获得N-芳基手性轴的产物。同时,放大实验、手性有机催化剂和配体在不对称催化中的应用以及OLED材料中1,5-二咔唑萘衍生物的合成进一步证实了该反应的实用性。