

3月23日,FDA官网数据库显示,FDA授予吉利德科学(Gilead Sciences)公司开发的在研抗病毒疗法瑞德西韦(remdesivir)孤儿药资格(Orphan Drug Designation),其适应症为冠状病毒疾病2019(COVID-19)。
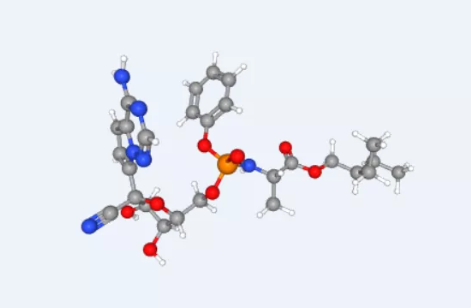
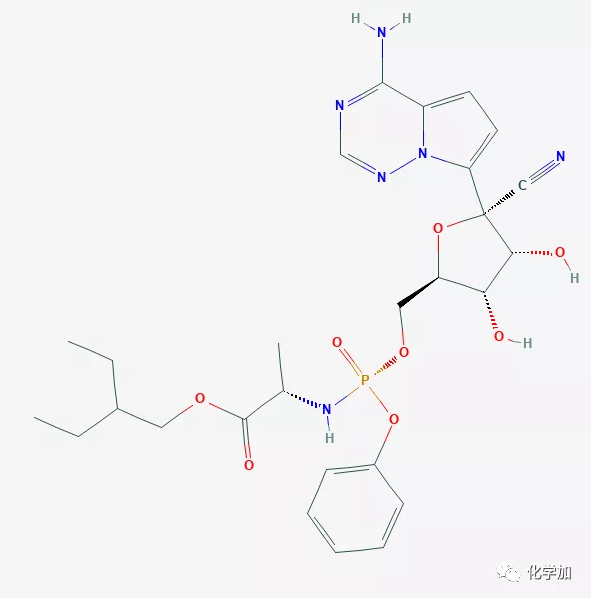
瑞德西韦是一种在研的核苷酸类似物,具有广谱抗病毒活性,在体外和体内动物模型中显示了对多种新兴病毒病原体的活性,包括埃博拉病毒、马尔堡病毒、中东呼吸综合征(MERS)和非典型性肺炎(SARS)病毒。针对瑞德西韦的研究曾在健康志愿者和埃博拉病毒感染者中展开。个别同情用药病例不足以确定瑞德西韦治疗新型冠状病毒肺炎的安全性和有效性,这只能通过未来的临床试验来确定。
孤儿药本是指一些专门用于治愈或治疗/控制罕见病的药物。罕见疾病的定义是在美国是患病人数小于20万人(或发病人口比例000)的疾病。通常,罕见病药物的研发成本高昂,上市之后价格也高昂,但企业回报却未必丰厚。从而在追求利润和投资回报的情况下,医药企业不重视针对适用症或适用病患过少的罕见疾病进行研发。为了鼓励对被忽视的罕见病治疗用药研发,1983年开始美国FDA给针对孤儿症的研究项目提供绿色通道,加速审批的过程。同时,孤儿药身份可以为制药公司提供在该是适应症上为期7年的市场独占期(排他性),即7年内任何药厂不得仿制该药物用于在获批适应症领域进行治疗。在药物开发过程中,制药企业还能够获得与合格临床测试相关的税务抵免,以及交付新药申请时特定费用的减免等其他优惠。
吉利德科学公司开发的瑞德西韦近来成为大家关注的热点药物。它是一款抗病毒疗法,其作用机制为抑制RNA依赖性RNA聚合酶的活性,从而抑制RNA病毒的增殖。目前,吉利德公司正在进展6项临床试验,检验瑞德西韦治疗不同类型的COVID-19患者的疗效。其中,在中国进行的两项临床试验有望在4月获得结果。
为了满足可能出现的未来需求,该公司已经扩大瑞德西韦的生产能力,并且将生产两种瑞德西韦的配方(液体和冻干)。该公司表示,目前正在将提供个人同情使用(compassionate use)紧急通道过渡到扩展使用项目(expanded access programs),这种方法将加速重症患者获得瑞德西韦的机会,并能够收集所有参与患者的数据。这些项目目前正在与全球各国监管机构联合快速开发。
太平洋时间2020年2月26日,吉利德科学宣布启动两项三期临床研究,以评估瑞德西韦在治疗新型冠状病毒肺炎成人患者中的安全性和有效性。从今年3月开始,这两项随机、开放、多中心的研究将主要在亚洲以及全球其他确诊病例较多的国家的医疗中心展开,入组约1,000名患者。研究将评估瑞德西韦静脉给药的两种用药时间方案。吉利德就使用瑞德西韦治疗新型冠状病毒肺炎提出了研究申请(IND),美国食品药品监督管理局(FDA)在迅速审评后,批准吉利德启动这些临床试验。
新的临床研究扩展了正在进行中的针对瑞德西韦的研究,这其中包括在中国湖北省开展的由中日友好医院负责的两项临床试验,以及最近在美国由国家过敏和传染病研究所(NIAID)主导的一项临床试验。吉利德为这些研究捐赠了药品并提供科学支持,在中国的临床试验预计四月份获得结果。
两项研究中的第一项将通过静脉注射5天和10天的给药方案来评估瑞德西韦的安全性和有效性。大约400名重度症状患者将按照1:1的比例被随机分配,除标准治疗之外,他们会在第一天接受静脉注射瑞德西韦200 mg,此后每天注射瑞德西韦100 mg,直到第5天或第10天。本研究的主要目的是通过衡量体温和氧饱和度的正常化来评估瑞德西韦的疗效(即:腋下温度< 36.6 度,口腔温度< 37.2 度,肛温< 37.8度;血氧饱和度 > 94%,持续至少24小时,直到第14天)。
第二项研究将评估瑞德西韦静脉给药5天和10天的方案对新型冠状病毒肺炎中度症状患者的安全性和有效性,并与单纯接受标准治疗的患者进行比较。大约600名参与者将按照1:1:1的比例随机分组,除标准治疗之外,患者第一天接受瑞德西韦200 mg治疗,此后每天注射瑞德西韦100 mg,直到第5天或第10天,把他们与单独接受标准治疗的参与者做比较。本研究的主要目的是通过衡量每组患者在第14天时的出院人数比例来评估瑞德西韦的疗效。
“吉利德的首要关注点是迅速确定瑞德西韦作为新型冠状病毒肺炎潜在治疗方案的安全性和有效性。这些互补的研究有助于帮助我们在短时间内获得关于此药物的更广泛的全球性数据。瑞德西韦针对冠状病毒的研究得以快速开展,反映了探寻疾病治疗方案的紧迫性以及制药业、政府、全球卫生机构和医疗人员共同应对这一公共卫生挑战的高度使命感,”吉利德科学首席医疗官Merdad Parsey博士表示。
吉利德发起的临床试验将对瑞德西韦的两种给药时间方案进行评估。一项研究将入组约400名临床表现严重的新型冠状病毒肺炎患者,随机分配让他们接受5天或10天的瑞德西韦治疗。第二项研究将在约600名具有中度临床症状的患者中展开,随机分配让他们接受5天或10天的瑞德西韦治疗或者仅接受标准治疗。两项研究的主要终点是临床症状的改善,详细描述请见文末。
瑞德西韦尚未在全球任何国家获得许可或批准,其安全性和有效性尚未被证实。除了进行中的临床试验之外,吉利德正与政府机构、非政府组织和地方监管部门合作,为符合条件的新型冠状病毒肺炎患者提供同情用药紧急治疗。
2月1日,吉利德科学全球首席医疗官Merdad Parsey博士代表公司发布声明,称吉利德正与全球的卫生机构密切合作,提供在研药物Remdesivir(瑞德西韦)用于试验性治疗,以支持应对新型冠状病毒(2019-nCoV)感染的暴发。
2月2日,中日友好医院宣布其在武汉疫区牵头开展瑞德西韦(Remdesivir)治疗2019-nCoV新型冠状病毒临床研究,为抗击疫情带来曙光。
2月4日,中国科学院武汉病毒研究所发布其开展联合研究,在抑制2019新型冠状病毒(2019-nCoV)药物筛选方面取得重要进展。相关研究成果以“Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro”(《瑞得西韦和磷酸氯喹能在体外有效抑制新型冠状病毒(2019-nCoV)》)为题发表在中国自主知识产权的国际知名学术期刊Cell Research(《细胞研究》)上。该研究表明,在Vero E6细胞上,瑞得西韦(Remdesivir, GS-5734)对2019-nCoV的半数有效浓度EC50=0.77 uM(微摩尔每升),选择指数SI大于129;磷酸氯喹(Chloroquine)的EC50=1.13 uM,SI大于88,说明上述两种药物在细胞水平上能有效抑制2019-nCoV的感染,其在人体上的作用还有待临床验证。
2月5日,武汉市金银潭医院召开科技部应急攻关“瑞德西韦治疗2019新型冠状病毒感染研究”项目启动会,会上介绍瑞德西韦(remdesivir)已完成临床试验的注册审批工作,第一批病例入组工作也已就位。首批新型冠状病毒感染的肺炎重症患者2月6日将接受用药。瑞德西韦临床试验由中日友好医院、中国医学科学院药物研究所牵头,研究将在武汉金银潭医院等多家临床一线接诊新型冠状病毒感染肺炎患者的医院中进行,拟入组761例患者,采用随机、双盲、安慰剂对照方法展开。
2月7日,重庆博腾制药科技股份有限公司发布公告,称已收到核心客户 Gilead Sciences, Inc.(吉利德科学)在研抗病毒药物 Remdesivir(瑞德西韦) 的中间体订单确认函件。
2月12日,博瑞医药发布公告称,凭借其在高端原料药和特殊注射剂开发领域的技术积累,该公司成功开发了瑞德西韦原料药合成工艺技术和制剂技术,并已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中。
2月25日,国务院联防联控机制举行新闻发布会,国家知识产权局副局长何志敏介绍,瑞德西韦临床试验正在进行中,4月27日才能公布临床试验的结果。围绕瑞德西韦,吉利德科学公司的确在中国申请了8件专利,目前已经有3件专利得到授权,还有5件正在审查的过程中。这8件专利申请的保护范围涵盖了化合物的核心结构和类似结构以及晶型,以及相关的制造方法、用途等等。
2月26日,吉利德科学宣布启动两项三期临床研究,以评估瑞德西韦在治疗新型冠状病毒肺炎成人患者中的安全性和有效性。
3月23日,美国食品和药品管理局(FDA)官网数据库显示,FDA授予吉利德科学(Gilead Sciences)公司开发的在研抗病毒疗法瑞德西韦(remdesivir)孤儿药资格(Orphan Drug Designation),其适应症为冠状病毒疾病2019(COVID-19)。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn