- 首页
- 资讯
兰州大学涂永强、张晓明团队Angew: α-季碳-δ-羰基环酮化合物和天然产物(+)-Cerapicol的不对称合成
来源:化学加编辑部 暖冬 2020-05-18
导读:兰州大学涂永强、张晓明团队报道了有机催化烯胺自由基正离子诱导的不对称醛α位烷基化/半频哪醇重排串联反应,能以良好的收率、优秀的对映选择性以及良好至优秀的非对映选择性得到一系列光学纯α-季碳-δ-羰基环酮化合物。同时,作者成功地将该策略应用于天然产物(+)-Cerapicol的全合成中。该成果发表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.202001100)。
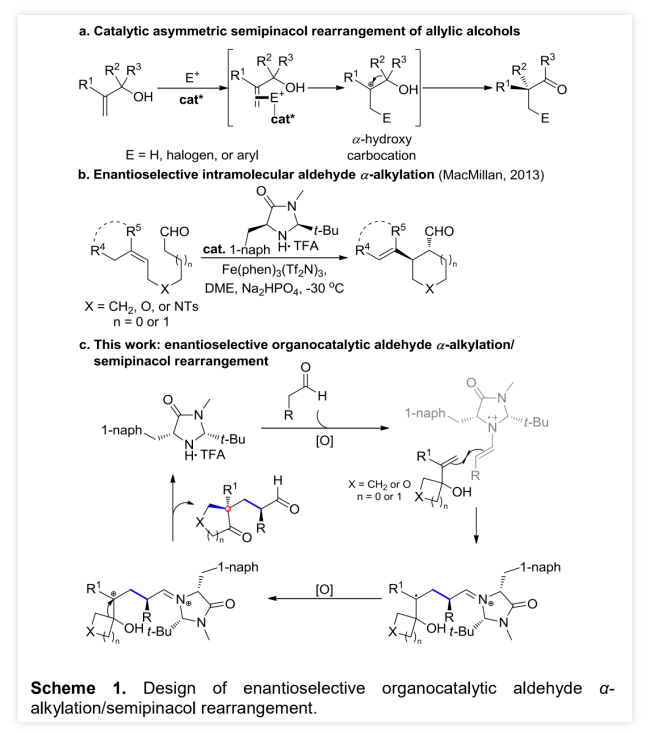
季碳手性中心结构单元广泛存在于具有生物活性的天然产物和药物分子中,因此对该类结构单元的高对映选择性构建成为不对称合成化学的研究重点之一。烯丙醇的半频哪醇重排反应被认为是合成含季碳手性中心化合物的一种可靠而实用的方法,但这种策略以往一般需要质子、卤化物或环氧化物等非碳亲电试剂先与烯烃发生不对称亲电反应,然后再诱导分子内1,2-碳迁移过程最后生成含季碳手性中心的化合物(Scheme 1a)。随着时代的发展,二甲基乙缩醛、β,γ-不饱和α-酮酸酯等碳亲电试剂在半频哪醇重排反应中得到了一定的应用,但这些反应多半是消旋反应,这极大的限制了含季碳手性中心化合物的合成。2013年,MacMillan课题组提出了有机-SOMO催化策略,并成功的将这种策略用于醛的α-烷基化反应中(Scheme 1b)。受到MacMillan课题组提出的这种催化模式的启发,兰州大学涂永强、张晓明团队报道了有机催化烯胺自由基正离子诱导的不对称醛α位烷基化/半频哪醇重排串联反应,能以良好的收率、优秀的对映选择性以及良好至优秀的非对映选择性得到一系列光学纯α-季碳-δ-羰基环酮化合物(Scheme 1c)。同时,该课题组成功的将这种策略应用于天然产物(+)-Cerapicol的全合成中。(图片来源:Angew. Chem. Int. Ed.)
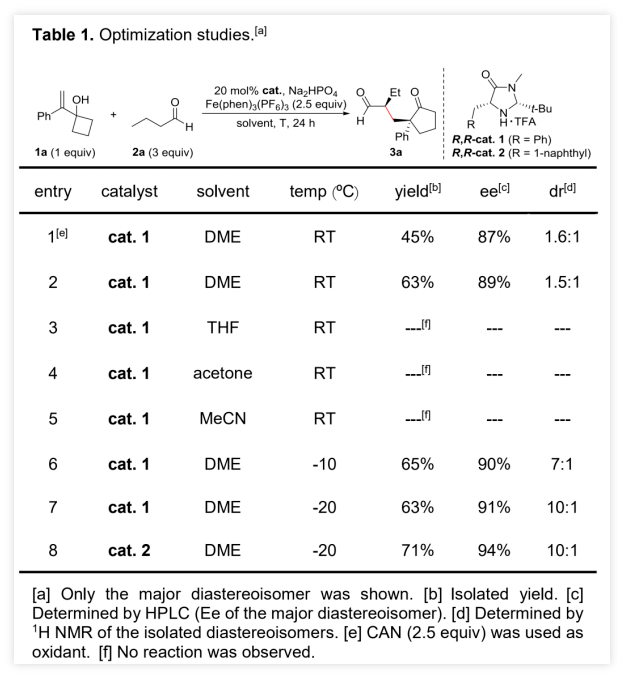
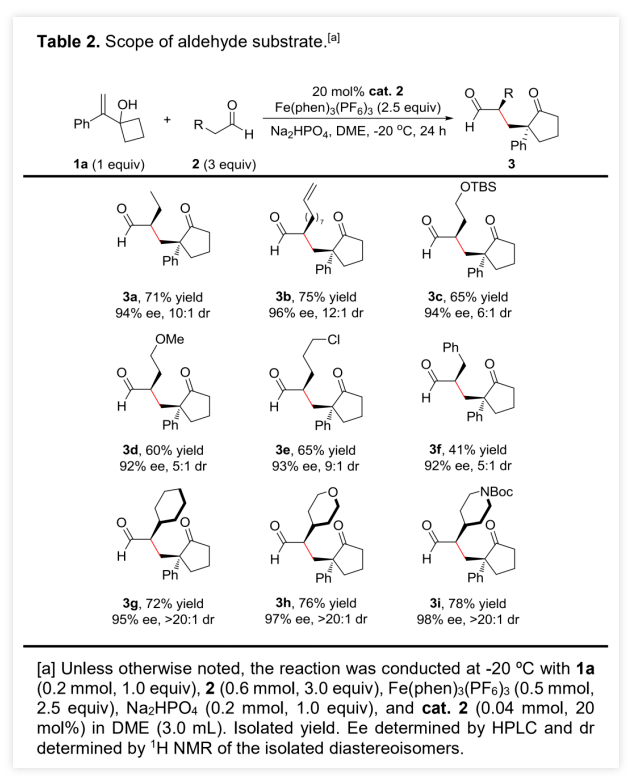
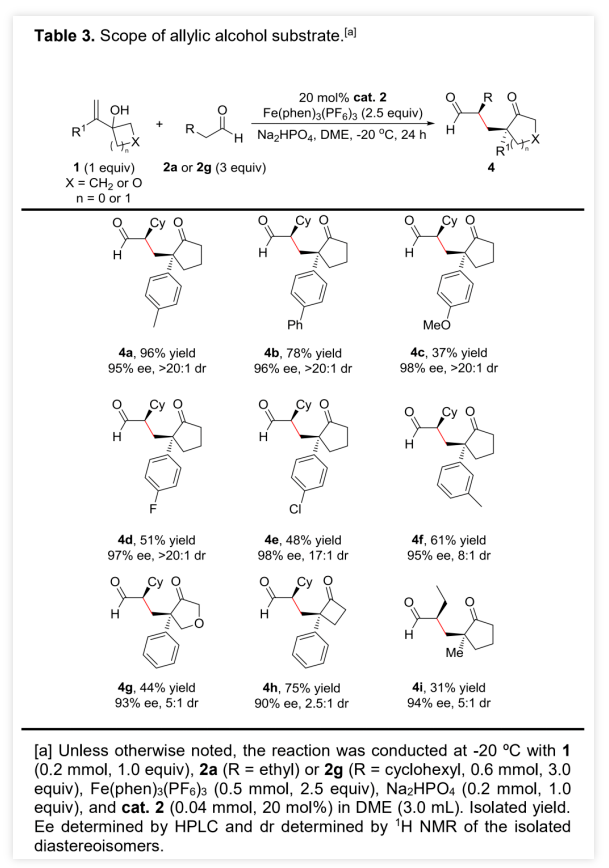
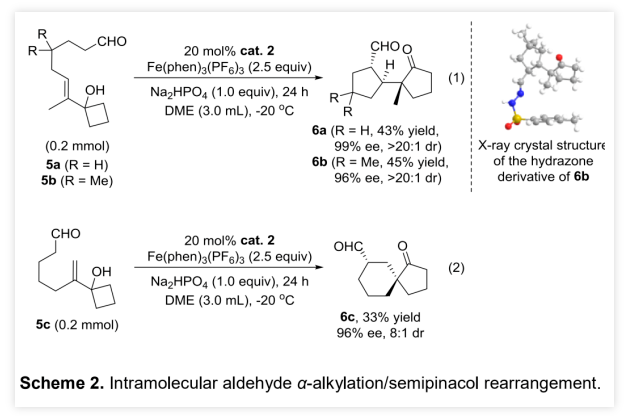
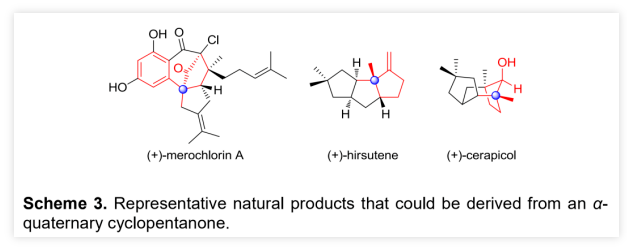
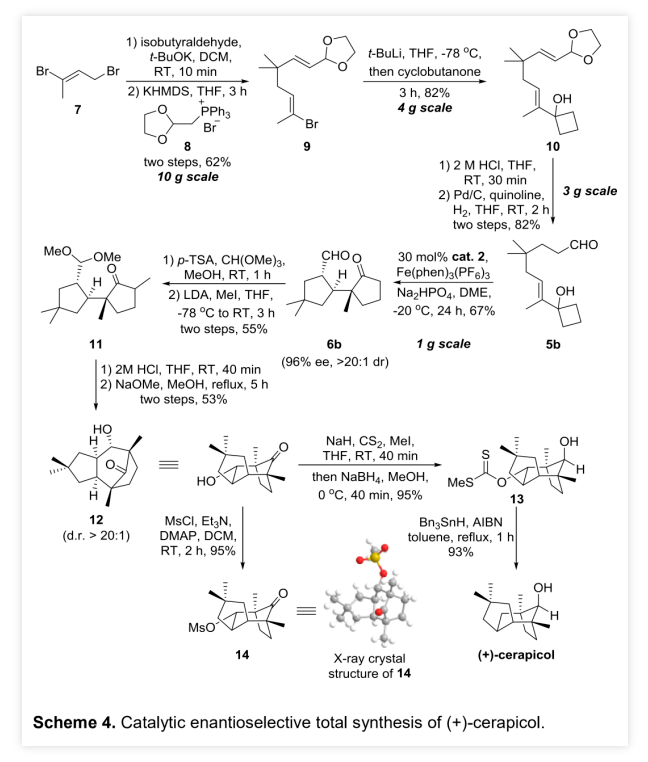
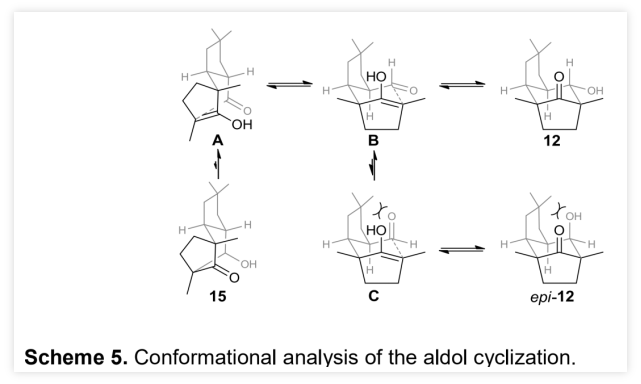
作者以烯丙醇1a和正丁醛 2a为模板底物,通过对催化剂、溶剂、温度以及氧化剂等反应条件进行筛选,确定最优的反应条件(Table 1, entry 8):20 mol% Cat.2为催化剂,2.5 equiv Fe(phen)3(PF6)3为氧化剂,Na2HPO4为碱,DCE为溶剂,在-20 ℃条件下反应24 h,能以71%的收率、94%的对映选择性以及10:1的非对映选择性得到相应产物。(图片来源:Angew. Chem. Int. Ed.)在最优反应条件下,作者对醛的底物范围进行了考察(Table 2)。各种取代的醛均能较好的适应反应条件,能以中等至良好的收率和优秀的对映选择性得到相应的α-季碳环戊酮产物。产物的非对映选择性则受到醛的末端取代基的影响较大,吸电子取代或苄基取代的醛的反应产物的非对映选择性较低,而α位为大位阻取代基的醛的反应产物的非对映选择性则较高。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者考察了各种取代的烯丙醇对反应条件的适应性(Table 3)。各种间位或对位含取代基的β-苯基烯丙醇、氧杂环丁醇以及环丙醇均能较好的适应反应条件,能以中等至优秀的收率、优秀的对映选择性以及中等至优秀的非对映选择性得到相应产物。理论上,由于苯环对苄位碳正离子的稳定作用,含β-苯基的烯丙醇通常被认为是反应发生的必要条件,但β-甲基取代烯丙醇也能较好的适应反应条件,能以较低的收率、优秀的对映选择性和较低的非对映选择性得到相应产物。(图片来源:Angew. Chem. Int. Ed.)为了证明反应的实用性,作者进一步考察了分子内不对称醛α位烷基化/半频哪醇重排串联反应(Scheme 2)。在最优反应条件下,5a和5b均能发生分子内不对称醛α位烷基化/半频哪醇重排串联反应,能以中等的收率、优秀的对映选择性和非对映选择性分别得到环戊酮6a和6b。此外,5c也能发生分子内环化/重排串联反应,但只能以较低的收率和非对映选择性以及优秀的对映选择性得到螺环酮6c。其中,6b的绝对构型可以通过其对甲苯磺酰腙衍生物的单晶结构确定。(图片来源:Angew. Chem. Int. Ed.)含手性α-季碳的环戊酮结构存在于一些天然产物分子中(Scheme 3)。其中,(+)-cerapicol是一种具有三环倍半萜骨架的真菌代谢物,具有重要的合成价值。但到目前为止,关于这种天然产物的不对称合成的报道只有一例,且该报道使用的拆分策略以及最后使用的非选择性转化步骤都极大地降低了(+)-cerapicol的合成效率。因此,针对该分子发展催化不对称的合成路线将具有重要意义。(图片来源:Angew. Chem. Int. Ed.)作者以异丁醛为初始原料与(E)-1,3-二溴丁-2-烯7发生α-烯丙基化反应,随后经历Wittig同系化过程生成烯基溴化物9 (Scheme 4)。9的锂盐与环丁酮反应可生成烯丙醇10。10脱除醛基保护,再进行烯烃的区域选择性还原反应能以82%的收率得到烯丙醇5b。在标准条件下,使用30 mol%的催化剂2,5b能以67%的收率、96%的对映选择性以及>20:1的非对映选择性克级规模转化得到6b。6b的对甲苯磺酰腙衍生物的单晶结构显示产物的环戊基为反式-氢构型,尽管这与(+)-cerapicol的构型不一致,但作者认为通过α-差向异构反应调整6b的构型即可保证最终得到产物的构型与天然产物一致。因此,作者先将6b的醛基保护,再进行酮α位的甲基化,能以55%的收率得到化合物11。11的醛基去保护后,在NaOMe的甲醇溶液中发生差向异构/分子内羟醛缩合串联反应生成产物12。其中,通过12的甲磺酸酯衍生产物14的单晶构型可以确定12的构型与(+)-cerapicol的构型一致。通过对环化反应的构象分析,这步反应的高立体选择性便能得到很好地解释 (Scheme 5)。在碱性条件下,烯醇A和B达到平衡。烯醇A若发生反应是以能量较高的船式构像参与环化反应,而烯醇B(或其构象C)则是以能量较低的椅式构像参与环化反应。无论是B构像还是C构像的羟醛反应过程都与逆-羟醛反应过程形成平衡,从而可以形成热力学更稳定的β-羟基酮12。然后,通过一锅法,12的羟基转化为硫代酸酯,非对映选择性酮羰基还原为羟基得到13。最后,13发生Barton-McCombie自由基脱氧化反应以88%的收率得到天然产物(+)-cerapicol。(图片来源:Angew. Chem. Int. Ed.) (图片来源:Angew. Chem. Int. Ed.)总结:兰州大学涂永强、张晓明团队报道了有机催化烯胺自由基正离子诱导的不对称醛α位烷基化/半频哪醇重排串联反应,能以良好的收率、优秀的对映选择性以及良好至优秀的非对映选择性得到一系列光学纯α-季碳-δ-羰基环酮化合物。同时,该课题组成功的将这种策略应用于天然产物(+)-Cerapicol的全合成中。
撰稿人:暖冬
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn