

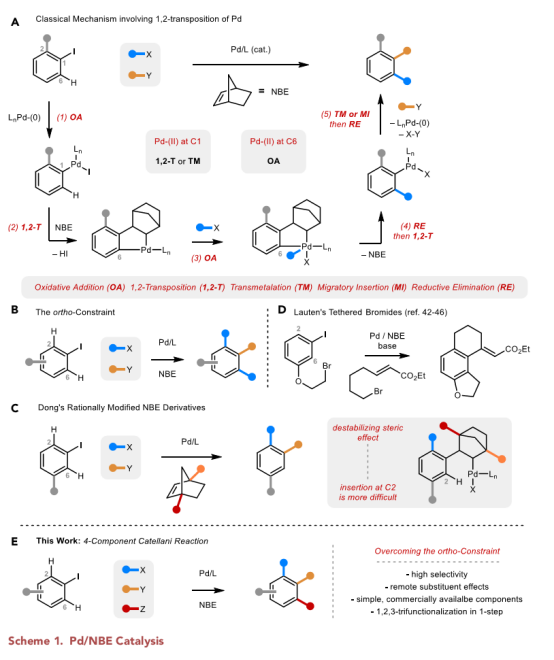
一步反应下的多组分偶联可以有效地在一个分子中引入多个官能团。Catellani反应即是这样一种将取代芳环与钯和降冰片烯(NBE)结合,为许多三组分偶联反应提供了一个通用的方法(Scheme 1A)。NBE的加入促进了钯的特征性1,2-转位,完成随后的氧化加成,使得起始的卤化物邻位和间位碳都能官能团化。
高化学选择性和区域选择性是由钯独特的配位环境引起的,这种配位环境在催化循环过程中会发生变化。C1处的Pd-(II)中心相对正电荷,不饱和,非常适合迁移插入(migratory insertion),而C6位的 Pd-(II)中心相对富含电子,使其更适合氧化加成。这些环境的互补性促成了许多对偶联试剂的成功结合,但要求起始芳香卤化物上有一个邻位取代基,以确保高选择性。
在没有邻位取代基的情况下,C1和C6的Pd-(II)中心表现出完全不同的行为,许多竞争性的途径破坏了邻位效应所约束下的选择性(Scheme 1B)。这就包括C2和C6过度功能化的产物,以及加成NBE的副产品。
最近,董广彬课题组对这一局限性进行了一系列巧妙的研究,他们精心设计的NBE衍生物实现了经典的空间效应三组分反应(Scheme 1C)。这些例子说明了远程空间效应在选择性芳香C-H官能化中的重要作用,这为推动Catellani反应的新设计提供了参考。
近日,西北大学栾新军教授课题组同麦吉尔大学Jean-Philip Lumb教授合作报道了在邻位未取代的碘苯上引入不同的取代基,利用不同的偶联试剂在一次转化中使两个芳香C-H键官能团化,完成了一个四组分的Catellani反应(Scheme 1E),其成果发表在Chem(10.1016/j.chempr.2020.06.021)上。
(图片来源:Chem)
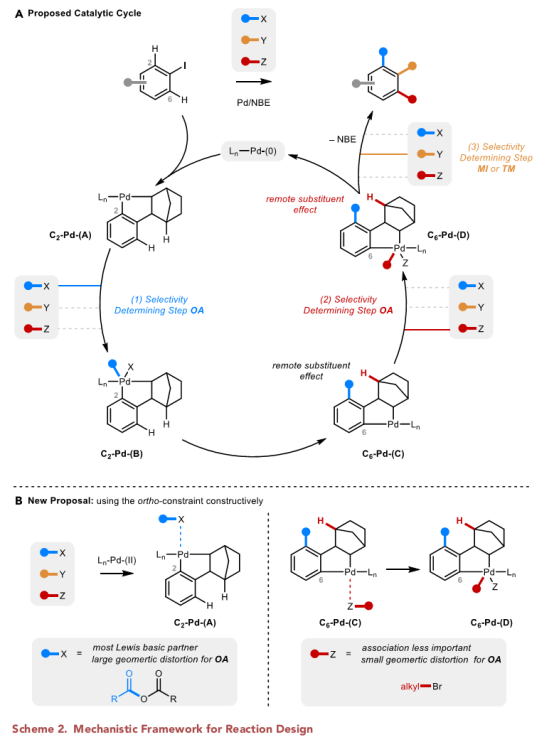
在没有邻位取代基的情况下,完成这一挑战的关键是Pd-(II)络合物之间的细微差异(Scheme 2A)。然而,C2[C2-Pd-(A)]处的Pd-(II)络合物和C6[C6-Pd-(C)]处的下游Pd-(II)络合物不存在直接的电子交流,作者推测这些配合物之间的主要区别可能来自于C2取代基和NBE桥上氢原子之间的远距离空间位阻作用。
所以,作者设想可以将这种远程空间效应建设性地加以利用,以使在C2-Pd-(A)和C6-Pd-(C)上被不同的偶联试剂的功能化(Scheme 2B)。作者推断络合物A不受空间效应的限制,因此可能有利于与Pd-(II)中心以最佳的空间位阻协调的相关偶联试剂发生反应。相比之下,络合物C在C2上有一个取代基,因此,通过尽可能最小空间途径实现氧化加成。
(图片来源:Chem)
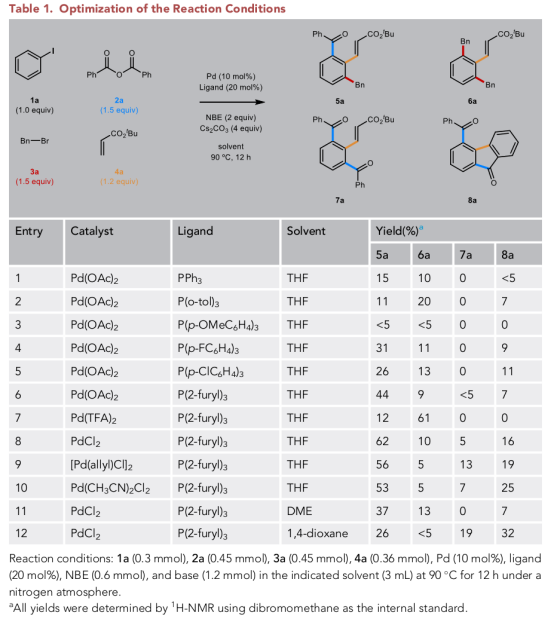
首先,作者以碘苯(1a)、苯甲酸酐(2a)、溴化苄酯(3a)和丙烯酸丁酯(4a)四组分偶联,制备1,2,3-三取代苯(5a)(Table 1)。在许多竞争性路径中,预计二苄基化生成6a,二酰化生成7a或8a, 虽然通过使用较少供电子的磷化氢配体可以在一定程度上提高目标路径的选择性,但直到使用了三(2-呋喃)磷化氢,才观察到5a形成的显著改善。
最初,作者将此效应归因于三(2-呋喃)磷化氢相对于PPh3的空间需求减少。除了这种配体效应外,作者还观察到了显著的反离子效应,并通过使用PdCl2作为前体催化剂以最高62%产率获得了5a。作者还注意到一个重要的溶剂效应,当他们不使用THF时,5a的选择性急剧下降。
(图片来源:Chem)
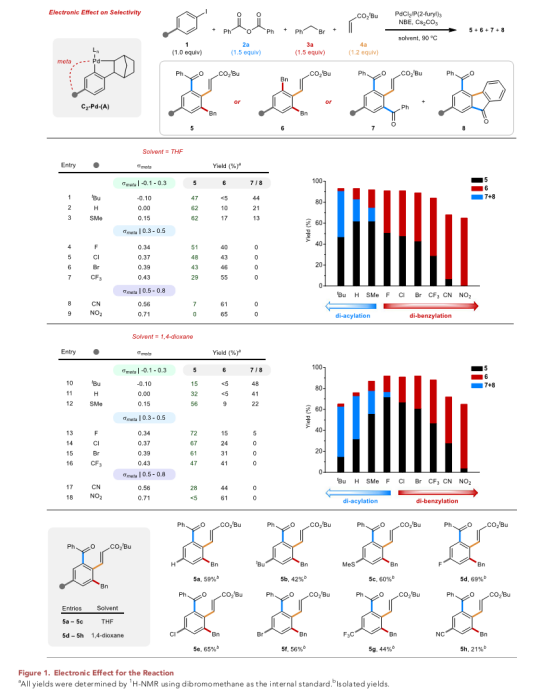
虽然作者最初认为空间效应是选择性的主要决定因素,但对起始碘化物对位取代基的研究揭示了该反应与取代物的δmeta值有关。当使用THF作为溶剂时,作者观察到当对位取代基适度给电子时,对四组分偶联的选择性最高(Figure 1,条目1-3)。然而,当取代基吸电子性更强时,选择性变为有利于二苄基化反应(Figure 1,条目4-7)。在最极端的情况下,对位取代基是腈基或硝基,只得到少量的酰化产物,而二苄基化占主导地位。
但是,如果用1,4-二氧六环取代THF,四组分偶联的选择性可以恢复。适度调整吸电子取代基的效果最为显著(Figure 1,条目13-16),其中四组分偶联的产率提高了约20%。虽然这种溶剂效应的根本原因尚不清楚,但总体效果有利于酰化而不是苄基化。
(图片来源:Chem)
结合作者在THF和1,4-二氧六环中的优化条件,作者继续探索反应范围(Figure 2)。对于碘代苯(Figure 2A),该反应也兼容吸电子的醛(5i)、酮(5j)和酯基(5k)以及三氟甲基醚(5l)。同样,Boc保护的苯酚(5m)和三级酰胺(5n)也可以耐受。值得注意的是,当使用1,4-二氧六环作为溶剂时,这些底物的产率最好(58%-62%),这与Table 1中的观察结果一致。随着对位取代基的给电子能力增强,THF的使用势在必行,甲基(5o)以及氧或氮杂原子(5o-5r)也可以适用于该反应。某些常见的官能团,包括酚类或苯胺类,以及苯甲醇,先进行原位酰化,再生成相应的产物(5s-5u)。
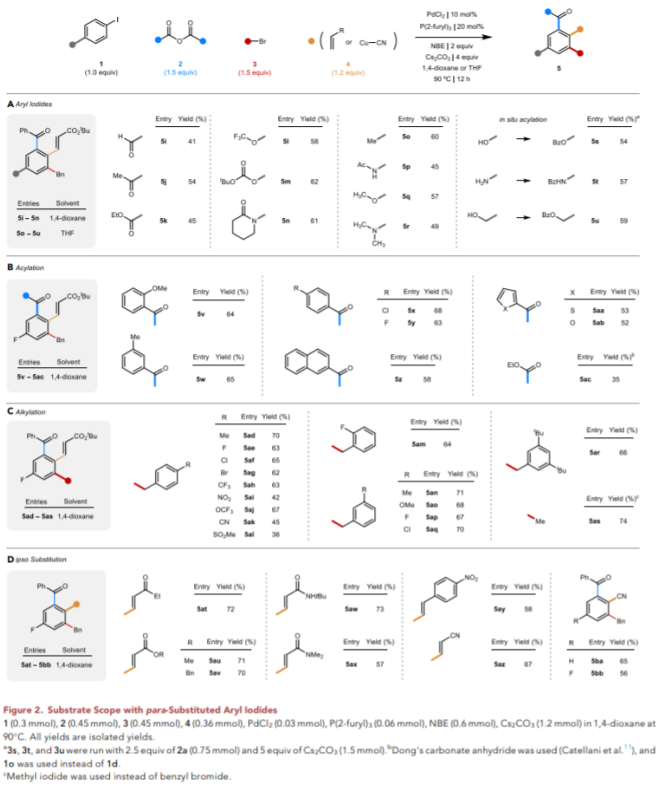
(图片来源:Chem)
接下来,作者评估了酸酐、苄基溴和烯烃组分的范围(Figure 2B-2D)。作者以4-氟-碘代苯(1d)作为碘代物组分,使用1,4-二氧六环作为溶剂。对于酸酐,空间要求更高、电子含量更高的邻甲氧基苯甲酸酐(5v),以及在对位(5x和5y)具有氯或氟取代基,和苯环以外的取代基,包括2-萘环、2-呋喃环和2-噻吩环(5z-5ab)都可以可耐受。
苄基溴的范围显示出对一系列常见官能团的相对较高的耐受性(Table 2C)。其中包括对位上的吸电子取代基,如三氟甲基(5ah)、硝基(5ai)、三氟甲基醚(5aj)、氰基(5ak)和甲基磺酰基(5al)。在邻位(5am)和间位(5ap)也能耐受氟的取代。同样,在间位(5aq)和对位(5ae-5ag)中也能耐受卤素取代基,也包括碘甲基(5as)。
最后,作者研究了丙烯酸酯的变化,发现可以使用一系列缺电子烯烃,包括与酯、酰胺或酮(5at-5ax)结合的烯烃,以及缺电子的苯乙烯(5ay)或丙烯腈(5az)。一个值得注意的扩展是氰基基团来自Cu-CN,可以与该反应很好地结合,快速制备有价值的芳基腈(5ba和5bb)。
随后,作者以间位取代碘苯在更具挑战性的底物中保持较高的选择性完成了该反应(Figure 3A),在C2处引入酰基,C1处引入腈或烯烃,C6引入苄基或甲基(11a–11l)生成一系列取代基的四取代产物。同样,如果碘化物为4,5-二取代(Figure 3B),则生成具有区域选择性(11m-11w)的五取代芳烃。
最后,当碘化物被三取代时(Figure 3C),多达6个不同取代基的芳烃可以一步合成,从而为完全取代的芳香环(11y和11z)提供了一种新方法。
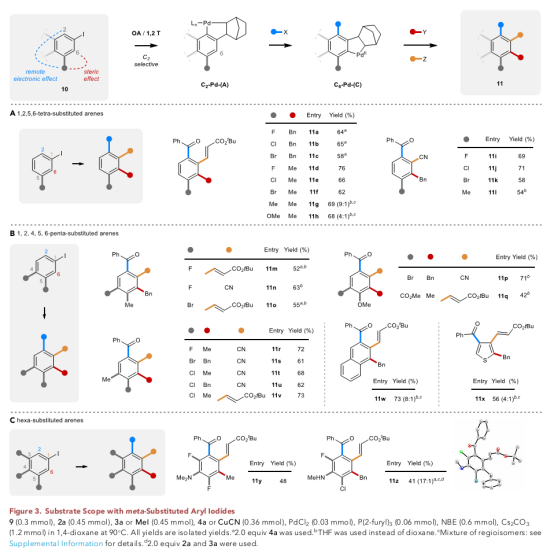
(图片来源:Chem)
最后为了进一步提升了该方法的实用性,作者分别以62%和50%的分离产率在克级规模上制备了5d和5bb,然后转化成一系列具有不同功能性质的下游产品(Scheme 3)。
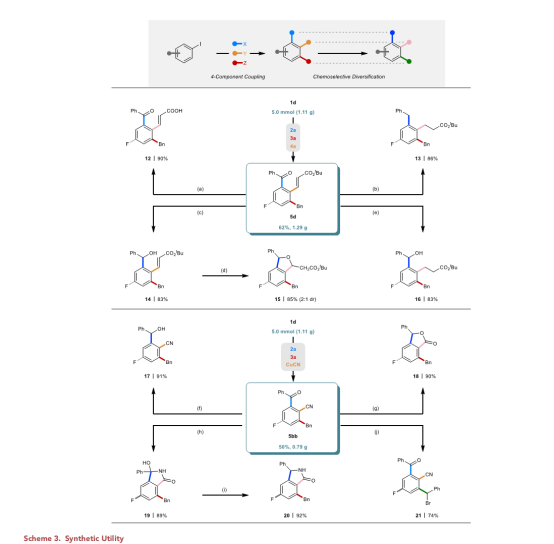
总结:西北大学栾新军课题组证明了简单的间位取代碘和对位取代碘是四组分Catellani反应中有效的偶联试剂。作者通过对空间相互作用的仔细分析,发现这些底物与Catellani反应选择路径兼容,并且它们可以用于高阶、多组分偶联,并具有良好的选择性。这一报道提醒人们,芳基碘化物在Catellani反应中既是底物又是配体,其空间位阻和电性在反应过程中会发生变化。
撰稿人:Turro
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn