

酰基基团是许多活性天然产物的药效基团,催化酰基组装的转移酶因其宽泛的底物选择性成为药物研发中化合物结构多样性研究的重要工具酶,但目前对于其底物选择性的分子机制研究报道较少。二十四元大环内酯类抗生素Macrolactins(MLNs)有多种药理学活性,其中带有丙二酰基修饰和琥珀酰基修饰的MLNs对多种多重耐药菌具有良好的抑制作用,然而其酰基化后修饰机制尚不清楚。
该研究采用体内遗传学、体外酶学、蛋白晶体学等手段,以海洋芽孢杆菌B-9987为研究对象,首次系统阐明了MLNs酰基化后修饰步骤,发现β-内酰胺酶同源蛋白BmmI能够特异性选择带有羧基末端的酰基供体,并对酰基供体和酰基受体显示出较宽的底物选择性。为了探究BmmI的底物选择分子机制,作者解析了BmmI与琥珀酰基共价连接的蛋白质结构,发现一个特殊的“氧阴离子穴”类似结构扮演了酰基供体gatekeeper的角色,通过设计“粗调”和“微调”方案对该“氧阴离子穴”结构进行了理性改造,成功拓宽了BmmI酰基供体选择性。该研究还解析了BmmI与MLN A的复合物蛋白质结构,揭示了酰基受体的结合方式,阐明了BmmI催化酰基化反应的分子机制。该研究系统阐释了酰基转移酶底物选择性的分子机制,为酶的理性设计与改造提供了理论指导,也为创新药物研发提供了有力工具。
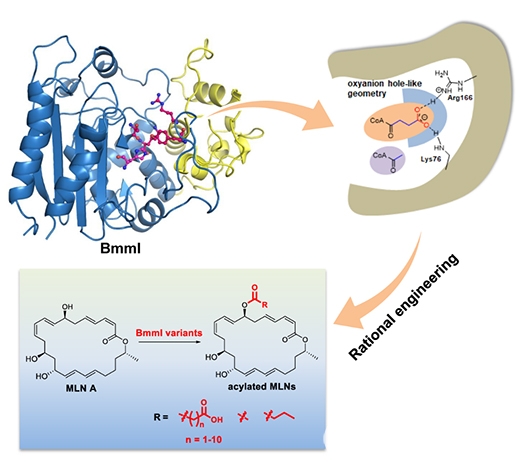
BmmI特殊的“氧阴离子穴”类似结构及其理性改造
中国海洋大学刘扬博士、李花月副教授,中国科学院青岛生物能源与过程研究所东升副研究员、冯银钢研究员、崔球研究员和北京大学云彩虹教授为论文共同作者,该研究工作得到了国家重点研发计划和国家自然科学基金等项目资助。李文利课题组长期致力于海洋微生物次级代谢产物合成生物学研究,在J. Am. Chem. Soc.、Nat. Commun.等发表SCI研究论文50余篇,受邀在Trends Biochem. Sci.(IF=16.889)上发表综述“Next-Generation Drug Discovery to Combat Antimicrobial Resistance”,被推选荣获Thieme Chemistry Journals Award 2020奖项。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn