

郭子建教授主要从事金属及其配合物的化学生物学研究。设计构筑了系列金属离子荧光探针,建立和发展了相关的体内外荧光成像方法,观察到离子的迁移和富集现象。探索了金属抗肿瘤药物反应性能及活性差异,构建了新型铂类药物靶向传输体系。发展了系列基于铜配合物的人工核酸酶,研究了它们的构效关系及金属中心间的协同效应、DNA断裂能力及抗肿瘤活性间的关联等。

以下对郭子建教授课题组2019年部分研究工作进行介绍,供大家学习交流。
(以通讯作者和0nline时间为主,如有疏漏,欢迎指正)
1. Angew:砷烯:一种潜在的治疗剂,通过作用于核蛋白治疗急性早幼粒细胞白血病
二维(2D)材料在生物医学领域得到了广泛的研究和应用。砷烯因其优异的光电性能而成为一种很有前途的新材料。但是,对生物砷烯相互作用的研究还很缺乏。近日,南京大学郭子建院士、金钟、赵劲等研究人员,合成了新的二维砷烯纳米薄片,发现它对NB4早幼粒细胞白血病(APL)细胞有抑制作用,抑制率为82%,并诱导凋亡,而对正常细胞无毒性。
Zeta电位越高,其尺寸越小,其平面结构越好,对砷材料的毒性起着至关重要的作用。无标记蛋白质组分析表明,砷烯通过下调DNA聚合酶POLE、POLD1、POLD2和POLD3,影响核DNA复制、核苷酸切除修复和嘧啶代谢途径。质谱分析表明,NB4细胞中的砷烯结合蛋白主要是核苷酸结合蛋白。进一步的细胞荧光研究表明,砷烯的作用主要发生在细胞核内,并破坏了细胞核。小鼠体内毒性试验也表明了小鼠的生理安全性。
这项工作首次为二维砷烯在生物医学上的应用提供了新的视角,表明砷烯在APL治疗中的应用前景。
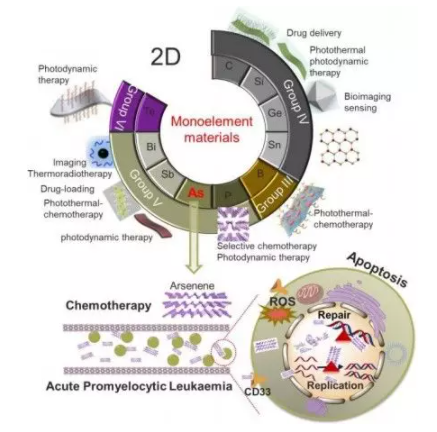
Xiuxiu Wang, Yi Hu, Jianbin Mo, et al. Arsenene: A Potential Therapeutic Agent for Acute Promyelocytic Leukaemia Cells by Acting on Nuclear Proteins. Angew. Chem. Int. Ed., 2019.
DOI: 10.1002/anie.201913675
https://www.onlinelibrary.wiley.com/doi/10.1002/anie.201913675
2. Chem. Sci.:光调控的适配体传感器用于实时监测活细胞线粒体内ATP的变化
荧光适配体传感器在用于小分子代谢物的细胞内成像方面具有良好的应用潜力。这类代谢物在不同亚细胞位置上的分布往往不同,其浓度和位置也会随时间波动,因此对这些代谢物进行时空控制监测的难度也很大。中科院苏州纳米所裴仁军研究员、伊利诺伊大学香槟分校陆艺教授和南京大学郭子建院士合作报道了一种可被光调控的功能化适配体传感器,它能够利用修饰的DQAsomes去靶向线粒体,进而可对活细胞线粒体内的ATP进行时空监测。
由于具有光调控的性能,该适配体传感器在到达线粒体之前不会被激活,而在光的照射下则会激活其传感性能。研究表明,该传感器的检测限为3.7 mM,并具有高选择性,可以检测由Ca2+或寡霉素诱导产生的线粒体内ATP浓度变化。
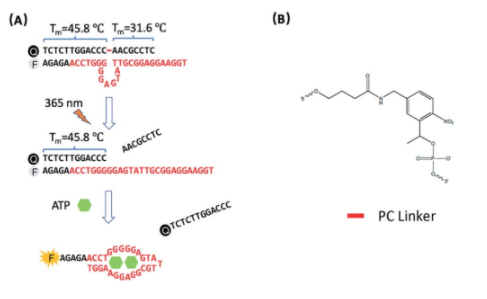
Shanni Hong, Zijian Guo, Renjun Pei, Yi Lu. et al. A photo-regulated aptamer sensor for spatiotemporally controlled monitoring of ATP in the mitochondria of living cells. Chemical Science. 2019
DOI:10.1039/C9SC04773E
https://pubs.rsc.org/en/content/articlelanding/2020/sc/c9sc04773e#!divAbstract
3. JACS:光学/PA双模探针,用于小鼠受激H2S上调的比率型成像
作为第三种气体信号分子,H2S参与血管扩张、血管生成、抗氧化、抗感染和中枢神经系统调节,因此,活体模型中H2S的实时追踪对于研究信号小分子在生物学中的作用机制具有重要意义。在活体小鼠中追踪H2S信号需要具有精细的组织成像深度、低组织散射/自发荧光和探针浓度干扰的响应性成像。利用荧光和光声(PA)成像的互补优势,可以将光学/PA双模态成像用于体内/体外H2S成像。
在此,南京大学郭子建院士、上海师范大学杨仕平等人利用酮-烯醇过渡传感机制,首次制备了间-苯甲酰氧基三羧甲川菁(HS-CyBz),并将其作为H2S的比率型光学/PA双模探针。
通过近红外吸收/发射,HS-CyBz可实现小鼠皮下H2S的光学/PA双模态成像,且两种模式的比率型成像均有利于减轻来自组织自身荧光和探针浓度偏差的干扰。尾静脉注射该探针会导致探针在小鼠肝脏中蓄积,通过比率型光学/PA成像已验证了由S-腺苷-L-甲硫氨酸触发的内源性H2S上调,表明此比率型双模态成像是追踪活体小鼠和组织中信号小分子上调的有效途径,通过此技术有望实现信号小分子生物学的生物学研究的进一步深入。
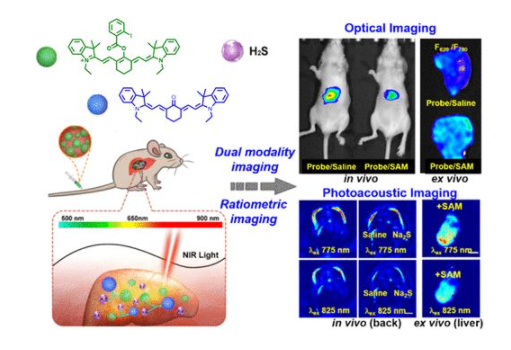
Zhongyan Chen, Xueling Mu, Zhong Han, et al. An Optical/Photoacoustic Dual-Modality Probe: Ratiometric in/ex Vivo Imaging for Stimulated H2S Upregulation in Mice. J. Am. Chem. Soc., 2019.
https://doi.org/10.1021/jacs.9b09181
4. Chem. Sci.:线粒体靶向铂配合物通过多途径参与能量代谢抑制肺癌
线粒体是抗癌药物的潜在治疗靶点。南京大学郭子建、王晓勇等人研究了一系列线粒体靶向的单功能铂配合物,[Pt(ortho-PPh3CH2Py)(NH3)2Cl](NO3)2 (OPT),[Pt(meta-PPh3CH2Py)(NH3)2Cl](NO3)2 (MPT),和[Pt(para-PPh3CH2Py)(NH3)2Cl](NO3)2 (PPT) (PPh3=三苯基膦,Py=吡啶)。在体内外和分子水平上对其抗肿瘤活性和作用机制进行了研究。
OPT对A549肺癌细胞的杀伤效果优于顺铂,且对裸鼠非小细胞肺癌的生长有较强的抑制作用。这些配合物与DNA的结合能力大小顺序为PPT>OPT>MPT。细胞摄取和分布研究表明,OPT主要在线粒体中积累,而MPT和PPT在细胞核中的积累比在线粒体中更为优先。
结果表明,OPT可引起线粒体膜和超微结构的显著改变,导致线粒体功能障碍较顺铂更为严重。OPT诱导A549细胞凋亡的作用与顺铂相似,但OPT诱导的A549细胞线粒体细胞色素c释放较顺铂明显。这些化合物的抗肿瘤机制与破坏线粒体氧化磷酸化和糖酵解有关。结果表明,除了DNA结合外,生物能量途径在线粒体靶向单功能铂配合物的抗肿瘤活性中也起着至关重要的作用。

Zhenzhu Zhu, Zenghui Wang, Changli Zhang, et al. Mitochondrion-targeted platinum complexes suppressing lung cancer through multiple pathways involving energy metabolism, Chem. Sci., 2019.
DOI: 10.1039/c8sc04871a
https://doi.org/10.1039/C8SC04871A
5. Angew:光激活单功能PtII配合物Pt-BDPA溶酶体逃逸进入细胞核
南京大学郭子建、何卫江,南京师范大学刘红科等人用BODIPY生色团制备了光敏性单功能铂配合物Pt-BDPA。除了与DNA的结合能力外,该配合物还在约578 nm处有发射,单线态氧量子产率为0.133。
共聚焦成像显示,这种配合物在黑暗中通过内吞作用被隔离在溶酶体中,阻止其进入细胞核。由于其光诱导ROS的产生能力,该配合物在光照射下经历溶酶体逃逸进入细胞核。光诱导的ROS还引起细胞内GSH的下降,有利于Pt-BDPA的稳定性,并有助于其核DNA的可及性。该配合物在光照射下对所有受试肿瘤细胞株均有明显的细胞毒作用,IC50值约为3~6 mm,明显低于单纯暗培养(IC50>50 mm)。这些结果与光激活这种光敏性铂配合物酶体逃逸进入细胞核相一致。
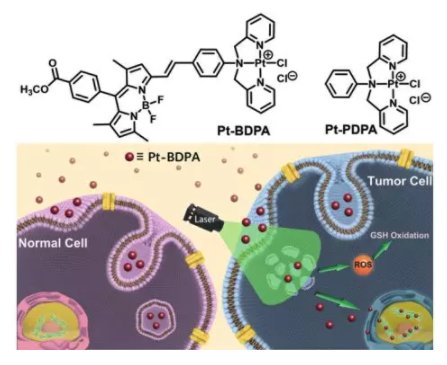
Xuling Xue, Chenggen Qian, Hongbao Fang, et al. Photoactivated Lysosomal Escape of a Monofunctional PtIIComplex Pt-BDPA for Nucleus Access, Angew. Chem. Int. Ed., 2019.
https://doi.org/10.1002/anie.201906203
6. Angew:线粒体靶向铂(II) 配合物通过双重代谢抑制抑制癌细胞
癌细胞通常使代谢表型适应化学疗法。针对这种灵活性的一种防御策略是调节与癌症生物能量学相关的信号通路。有鉴于此,南京大学郭子建、王晓勇等人设计了一种三苯基膦修饰的三联吡啶铂(II)配合物(TTP),用于抑制肿瘤细胞的硫氧还蛋白还原酶(TrxR)和多种代谢。
TTP以不依赖于caspase-3的方式对顺铂不敏感的人卵巢癌细胞具有增强的细胞毒性,并对线粒体TrxR具有优先抑制作用。线粒体形态和功能严重受损,线粒体和细胞内活性氧水平降低。因此,TTP对线粒体和糖酵解生物能都有很强的抑制作用,从而诱导癌细胞进入低代谢状态。
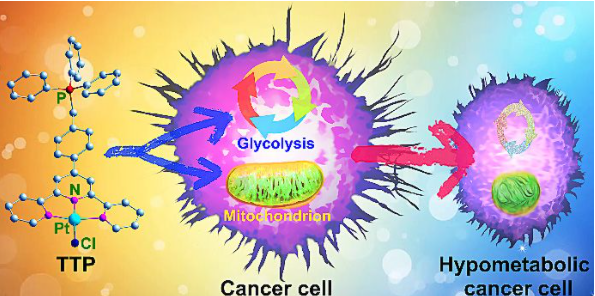
Kun Wang, Chengcheng Zhu, Yafeng He, Restraining Cancer Cells by Dual Metabolic Inhibition with a Mitochondrion-Targeted Platinum(II) Complex, Angew. Chem. Int. Ed., 2019.
https://doi.org/10.1002/anie.201900387
7. Chem. Rev.:刺激响应治疗性金属药物
铂基抗癌药物的成功推动了几十年来新型金属基药物的开发,然而诸如耐药性和全身毒性等问题阻碍了其临床应用和疗效。一些金属配合物的刺激响应性为设计位点特异性前药提供了良好的机会,以最大限度地提高治疗效果,并最小化金属药物的副作用。
南京大学郭子建、王晓勇等人综述了近二十年来出现的治疗性刺激响应金属药物,包括氧化还原、pH、酶、光、温度等刺激。根据刺激物的性质将其分为三大类,即内刺激响应性金属药物、外刺激响应性金属药物和双刺激响应性金属药物。从结构、反应机理和潜在的医学应用方面讨论了每种类型的代表性例子。最后,初步提出了该领域未来的机遇和挑战。在介绍各种金属配合物的基础上,重点介绍了铂和钌配合物。
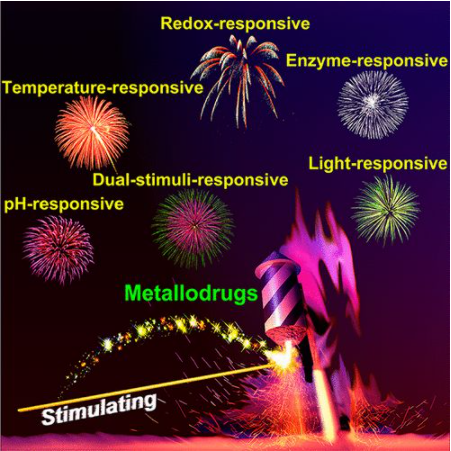
Xiaohui Wang, Xiaoyong Wang, Suxing Jin,et al. Stimuli-Responsive Therapeutic Metallodrugs, Chem. Rev., 2019.
https://doi.org/10.1021/acs.chemrev.8b00209
8. Inorg. Chem.:双DNA损伤法增强单功能铂配合物的细胞毒性
除了核DNA(nDNA)外,线粒体DNA(mtDNA)也是抗癌药物的一个有吸引力的细胞靶点。有鉴于此,南京大学郭子建、王晓勇等人设计了含DNA插层部分NP的阳离子铂(II)配合物顺式[Pt(NP)(NH3)2Cl]NO3(PtNP,NP=N-(2-乙基吡啶)-1,8-萘酰亚胺)。用单晶X射线晶体学、核磁共振和高分辨质谱对PtNP的结构进行了全面表征。
PtNP在体外和体内的抗癌活性均优于顺铂,且全身毒性低。PtNP与CT-DNA的相互作用表明,PtNP可以通过共价和非共价双结合方式与DNA有效结合。PtNP除了对nDNA造成明显的损伤和对DNA损伤修复的显著抑制外,还分布在线粒体中,诱导mtDNA损伤,影响线粒体编码基因的下游转录水平。另外,PtNP通过降低线粒体膜电位,促进活性氧的产生,干扰了线粒体的生理过程。
机制研究表明,PtNP通过上调Bax和Puma,下调Bcl-2蛋白,导致细胞色素c释放,激活caspase-3和caspase-9,通过线粒体途径诱导细胞凋亡。作为一种双重DNA损伤剂,PtNP可以通过同时损伤细胞核和线粒体DNA来提高抗癌活性,从而为萘酰亚胺单功能铂(II)配合物提供了一种新的抗癌作用机制。
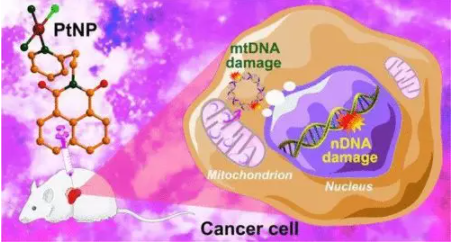
Yan Guo, Yafeng He, Shengde Wu, et al. Enhancing Cytotoxicity of a Monofunctional Platinum Complex via a Dual-DNA-Damage Approach, Inorg. Chem., 2019.
https://doi.org/10.1021/acs.inorgchem.9b02033
9. Journal of Inorganic Biochemistry:以细胞核、线粒体和环氧合酶-2为多靶点的抗癌铜配合物
铜配合物具有多方面的生物学特性和较高的生物相容性,是一种很有希望的抗癌药物。炎症环境在肿瘤进展中起重要作用,并影响机体对化疗药物的反应。有鉴于此,南京大学郭子建、王晓勇等人合成了以邻菲罗啉衍生物N-(1,10-菲罗啉-5-基)壬酰胺(L)和两个阿司匹林阴离子(A)为配体的铜(II)配合物。
CULA可有效诱导SKOV-3细胞线粒体功能障碍,促进其早期凋亡,并抑制内毒素刺激的RAW-264.7细胞中参与炎症反应的关键酶-环氧合酶-2的表达。相比之下,不含阿司匹林配体的模拟配合物CuL对细胞氧化还原稳态和细胞周期进程具有相似的影响,但由于其对线粒体功能的影响较小,细胞毒活性相对较低,更重要的是,它对环氧合酶-2没有抑制作用。
结果表明,CULA通过DNA损伤和线粒体功能障碍两条途径抑制肿瘤细胞生长。阿司匹林的引入不仅提高了抗肿瘤的疗效,而且降低了炎症威胁。兼具抗肿瘤和抗炎活性的铜配合物有可能成为一种新型的多功能金属配合物,并有望被开发成新型的金属药物。

Xiangchao Shia, Hongbao Fanga, Yan Guo, et al. Anticancer copper complex with nucleus, mitochondrion and cyclooxygenase-2 as multiple targets, Journal of Inorganic Biochemistry, 2019.
https://doi.org/10.1016/j.jinorgbio.2018.10.003
10. Dalton Trans.:一种通过破坏血管和抑制转移来抗击乳腺癌的铂(IV)前药
南京大学郭子建、王晓勇等人报道了一种有效的PtIV前药PDMA,它具有显著的克服三阴性乳腺癌(TNBC)耐药性的能力。
PDMA能够通过破坏肿瘤血管来抑制肿瘤转移。轴向血管干扰剂(VDA)配体DMA增加了PDMA的亲脂性,改善了PDMA的细胞蓄积。与顺铂(CDDP)相比,细胞内高度的DNA损伤导致对CDDP耐药的MDA-MB-231癌细胞具有显著的细胞毒性。更明显的是,PDMA通过破坏肿瘤血管而显示出良好的抗血管生成特性,可以切断氧和营养物质的供应,从而在原位杀死肿瘤细胞,防止肿瘤转移。值得注意的是,PDMA对动物的毒性比CDDP小。
总之,本研究提供了一种创新的PtIV前药,通过阻断肿瘤血管来对抗CDDP耐药和抑制肿瘤转移,从而显示了抑制转移性TNBC的可能性。
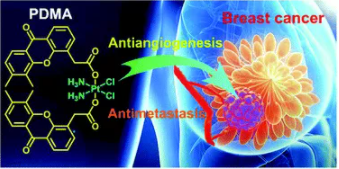
Yan Guo, Shuren Zhang, Hao Yuan, et al. A platinum(IV) prodrug to defeat breast cancer through disrupting vasculature and inhibiting metastasis, Dalton Trans., 2019.
DOI: 10.1039/c9dt00335e
https://doi.org/10.1039/C9DT00335E
郭子建院士简介
郭子建,南京大学化学化工学院教授、博士生导师、中国科学院院士。1989-1994年在意大利帕多瓦大学学习并获得博士学位,先后在英国伦敦大学、加拿大不列颠哥伦比亚大学、英国爱丁堡大学从事研究工作,研究方向为抗肿瘤金属配合物的作用机理研究。1999年起担任南京大学教授、博士生导师。从教近20年,获得国家自然科学基金委杰出青年基金资助,先后获得教育部长江学者奖励计划特聘教授、享受国务院特殊津贴专家、中国科学院化学部院士荣誉称号。曾获意大利化学会Sacconi奖章、教育部自然科学一等奖等。
参考资料
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn