


据公告披露,泰它西普(RC18,商品名:泰爱)获准上市销售是荣昌生物的一项重大里程碑,体现了其在自身免疫疾病治疗领域的成就,也彰显了其在生物药物开发领域的能力,并显示出荣昌生物强大的自主研发能力。
系统性红斑狼疮(SLE)是自身免疫性风湿疾病中死亡率及致残率最高的疾病之一。根据弗若斯特沙利文的资料,2019年全球SLE患病人口约为770万人,估计到2030年将达到860万人。
在中国,2019年SLE患者约为100万人,估计到2030年将增至约110万人。根据弗若斯特沙利文的资料,估计全球SLE生物疗法的市场规模将按复合年增长率26.8%由2019年的8亿美元增至2030年的108亿美元。泰它西普是近60年内在中国获批的第二个可用于SLE的全新生物制剂。
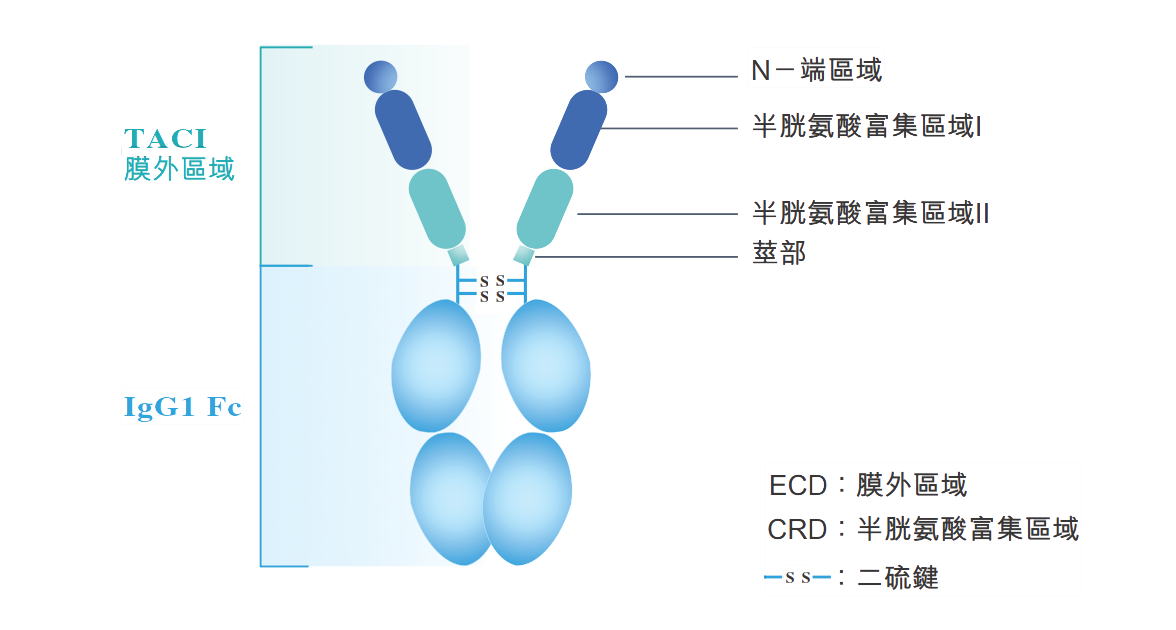
泰它西普的结构
泰它西普(RC18,商品名:泰爱)是荣昌生物专有用于治疗自身免疫性疾病的新型融合蛋白,由人跨膜激活剂及钙调亲环素配体相互作用因子(TACI)受体的胞外域以及人免疫球蛋白G (IgG)的可结晶片段(Fc)域构成。泰它西普靶向两类对B淋巴细胞发育至关重要的细胞信号分子:B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL),得以有效降低B细胞介导的自身免疫应答,自身免疫应答与多种自身免疫性疾病有关。
泰它西普2010年向国家药监局申报临床试验,2011年获得一期临床试验批件,2012年在北京协和医院完成I期临床试验,2013年获国家食品药品监督管理总局Ⅱ、Ⅲ期临床试验批件。2019年11月,中国国家药监局受理了泰它西普用于治疗SLE的NDA,并于2019年12月授予优先审评资格,2021年3月,泰它西普获批有条件上市。另外,荣昌生物也在推进泰它西普的全球临床开发计划,以最大化其治疗及商业价值,2020年4月,FDA授予泰它西普快速通道资格,这有可能加快FDA的审核及可能的批准流程。
荣昌生物现正于多种适应症开展II期或III期临床试验,评估泰它西普,以探索其治疗各种自身免疫性疾病的潜力,旨在解决该治疗领域中大量未满足或未充分满足的医疗需求。荣昌生物现正于后期临床试验评估泰它西普,以探索其解决七大自身免疫性疾病的潜力,旨在解决该治疗领域中大量未满足或未充分满足的医疗需求。

公司简介
荣昌生物制药(烟台)股份有限公司由王威东先生领导的烟台荣昌制药股份有限公司和留美科学家房健民博士于2008年共同创立。荣昌生物总部位于中国山东省烟台市,在中国和美国均设有实验研究机构和办事处。荣昌生物致力于发现、开发和商业化创新的、有特色的生物药物,针对自身免疫、肿瘤、眼科等重大疾病领域创制出一批具有重大临床价值的生物新药。2020年11月9日,荣昌生物制药(烟台)有限公司(荣昌生物,股份代号:9995)于香港联合交易所有限公司(港交所)主板正式挂牌交易。
参考资料
[1] 荣昌生物制药(烟台)股份有限公司http://www.remegen.cn/Default.aspx
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn