

近日,南方科技大学刘心元和李忠良团队开发了铜催化苄基/炔丙基卤化物与烯基硼酸酯的不对称自由基C(sp3)-C(sp2)交叉偶联反应,并能以高收率和对映选择性得到一系列手性烯烃衍生物和手性1,4-烯炔衍生物。该团队选用对空气/湿气稳定、易于制备并能与多种官能团兼容的烯基硼酸酯作为偶联试剂,并通过合理设计的半不稳定手性N,N,N-配体以提高反应效率和对映选择性。同时,多样的衍生转化证明了反应的应用潜力。相关研究成果发表于J. Am. Chem. Soc.(DOI: 10.1021/jacs.2c00957)。
烷基卤化物或烷基拟卤化物与烯基金属试剂的不对称自由基C(sp3)-C(sp2)交叉偶联反应是合成手性烯烃衍生物较为强大的策略之一。美国加州理工学院Fu课题组和Reisman课题组分别利用手性镍和钴催化烯基锌试剂、烯基硅试剂、烯基锆试剂以及烯基镁试剂的不对称交叉偶联反应(Scheme 1A)。但大部分烯基金属试剂均对空气/湿气敏感,需要在惰性气体保护的溶液中小心储存。因此,开发更稳定的烯基金属试剂用于不对称交叉偶联反应是非常有必要的。鉴于烯基硼酸酯具有对空气/湿气稳定、易于制备、并能与多种官能团兼容等优势,烯基硼酸酯与烷基卤化物的不对称自由基交叉偶联反应或许能成为合成手性烯烃衍生物的一种新方法。南方科技大学刘心元和李忠良团队基于对铜催化不对称自由基交叉偶联反应的兴趣,试图将铜催化策略用于烯基硼酸酯与烷基卤化物的不对称自由基交叉偶联反应中(Scheme 1B)。为了实现该目标,该团队需要面临许多挑战:(1)与烯基金属试剂相比,烯基硼酸酯的转金属速度较慢;(2)烯基硼酸酯的去硼化和氧化偶联过程易发生副反应;(3)与镍和钴相比,铜的还原能力较差,相对较难引发自由基过程;(4)选择合适的手性配体对于高立体选择性的自由基交叉偶联反应是必不可少的。尽管存在这些问题,南方科技大学刘心元和李忠良团队成功实现了铜催化烷基卤化物与烯基硼酸酯的不对称自由基C(sp3)-C(sp2)交叉偶联反应(Scheme 1C)。该反应成功的关键在于合理的在配体的喹啉环邻位引入甲基增强空间位阻,并使这种新型半不稳定手性N,N,N-配体能以三齿形式提高反应效率和以双齿形式提高对映选择性。下载化学加APP,阅读更有效率。(手机上如何查询化合物分子式、结构式、制备方法、合成路线、图谱信息、供应商?)

(图片来源:J. Am. Chem. Soc.)
作者以1-溴丙基苯1a与甲基戊二醇衍生的烯基硼酸酯2a为模板底物,通过对催化剂、碱、溶剂以及温度等条件进行筛选,确定最优反应条件(Table 1):氩气条件下,以5 mol% CuI和7.5 mol%半不稳定手性N,N,N-配体L9为催化剂,以2.0 eq. LiOtBu为碱,以1.0 eq. H2O为添加剂,以DMF为溶剂,在-20 oC条件下反应2 d,反应能以80%的收率和95%的对映选择性得到手性烯烃产物。
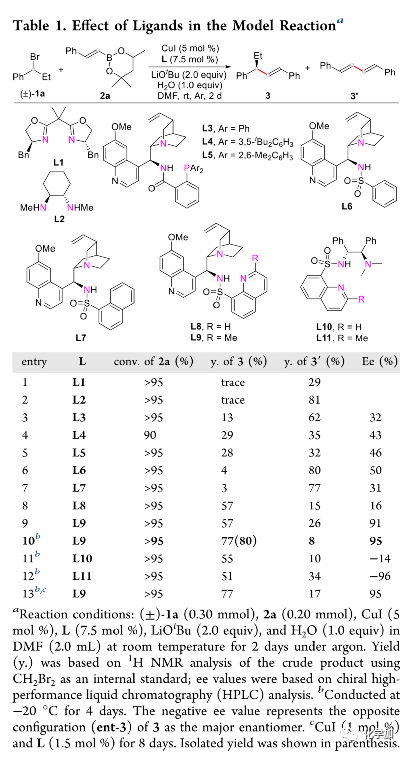
(图片来源:J. Am. Chem. Soc.)
在最优反应条件下,作者考察了烯基硼酸酯的底物范围(Table 2)。各种给电子或吸电子取代的苯基、萘基、噻吩、吡啶、喹啉等杂芳基取代、脂肪族取代以及含共轭烯烃、酯、醚、乙酸酯、甲硅烷基醚以及硫醚等官能团的烯基硼酸酯均能较好的适应反应条件,并能以良好至优秀的收率和优异的对映选择性得到相应产物。但1,1-二取代烯基硼酸酯只能以中等的对映选择性得到相应产物。
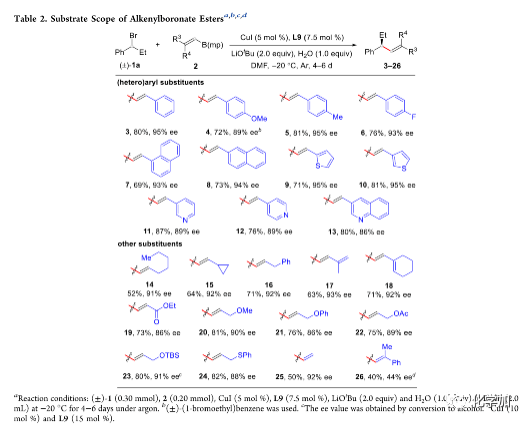
(图片来源:J. Am. Chem. Soc.)
随后,作者对(杂)苄基溴化物的底物范围进行了考察(Table 3)。将烷基溴化物中的苯基换成各种邻位、间位或对位取代的苯基、萘基以及噻吩、苯并[b]噻吩和喹啉等杂芳基,反应均能正常进行,并能以中等至优秀的收率和良好至优秀的对映选择性得到相应产物。对于烷基溴化物中的烷基部分,将乙基换成简单的脂肪族、(杂)芳基、含末端烯烃、伯氯、伯溴、甲硅烷基醚、醚、砜、酮、酯、氰等潜在反应性官能团的烷基以及环烷基,反应均能正常进行,并取得较好的结果。
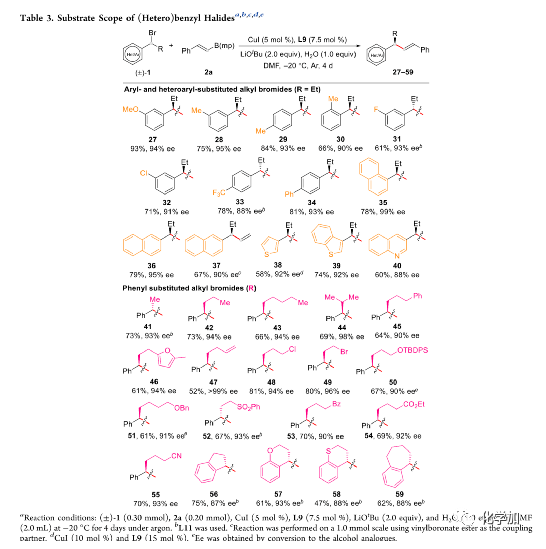
(图片来源:J. Am. Chem. Soc.)
考虑到手性1,4-烯炔的应用潜力,作者以炔丙基溴化物1b与甲基戊二醇衍生的烯基硼酸酯2a为模板底物,通过对催化剂、碱、溶剂以及温度等条件进行筛选,确定最优反应条件(Table 4):Ar条件下,以5 mol% CuI和5 mol%手性N,N,N-配体L9为催化剂,以1.5 eq. LiOtBu为碱,以3.0 eq. H2O为添加剂,以DMF为溶剂,在-30 oC条件下反应5 d,反应能以86%的收率和97%的对映选择性得到手性1,4-烯炔产物。

(图片来源:J. Am. Chem. Soc.)
随后,在最优反应条件下,作者考察了烯基硼酸酯与炔丙基卤化物的反应情况(Table 5)。各种苯基或杂芳基取代的烯基硼酸酯均能较好地适应反应条件,并能以良好至优秀的收率和优秀的对映选择性得到相应产物。同时,各种简单的链状或空间位阻较大的脂肪族取代、含苯环、呋喃、末端烯烃、非末端烯烃、酯、腈、乙缩醛、醚以及伯氯等官能团的炔丙基溴化物、环烷基取代的炔丙基溴化物以及炔丙基氯化物均能与烯基硼酸酯反应,并能以良好至优秀的收率和优秀的对映选择性得到相应产物。
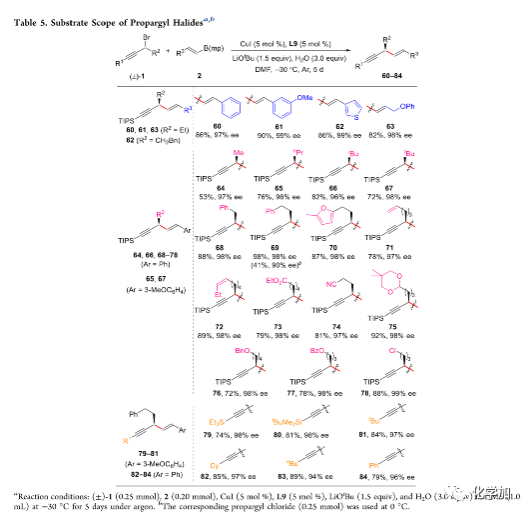
(图片来源:J. Am. Chem. Soc.)
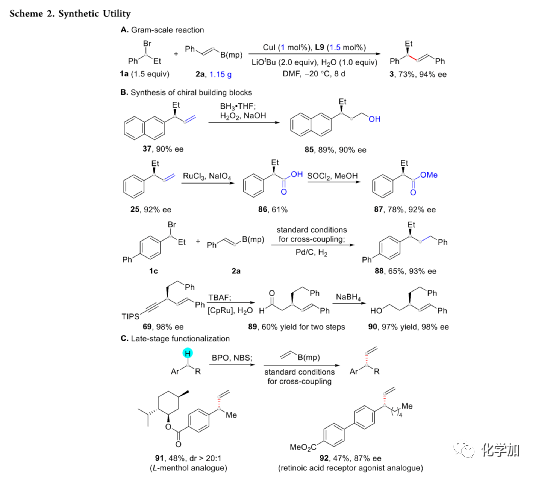
为了证明反应的应用潜力,作者进行了规模化反应和衍生反应(Scheme 2)。降低催化剂用量同时延长反应时间,该反应仍可以扩大至克级规模,并能以73%的收率和94%的对映选择性得到化合物3(Scheme 2A)。在简单的反应条件下,25或37中的末端烯烃可转化为醇、羧酸和酯(Scheme 2B)。烷基溴化物1c与甲基戊二醇衍生的烯基硼酸酯2a可经历不对称交叉偶联/加氢还原串联过程,转化为含手性C(sp3)-C(sp3)键的产物88。手性1,4-烯炔产物69还可转化为烯基醛89,并进一步被还原为相应的醇90。含苄基的化合物连续发生C-H键溴化/不对称交叉偶联反应,可在分子中引入末端烯烃,这为生物活性化合物的后期官能化提供了一种实用的新策略(Scheme 2C)。利用该策略,L-薄荷醇衍生物和维甲酸受体激动剂类似物可以高立体选择性得到产物91和92。
(图片来源:J. Am. Chem. Soc.)
为了进一步了解反应机理,作者进行了一系列对照实验(Scheme 3)。在反应中加入自由基捕获剂TEMPO,反应中只分离出TEMPO捕获的产物93,无偶联产物,该结果表明苄基自由基参与了反应(Scheme 3A)。标准反应条件下,含烯烃的底物94可与2a发生反应,生成自由基5-exo环化/交叉偶联产物95,该结果进一步证明了自由基中间体的产生(Scheme 3B)。其它条件不变,若反应中不加入2a,无反应发生(Scheme 3C)。该结果表明反应首先发生CuI与烯基硼酸酯的转金属过程,而不是CuI和苄基溴的单电子转移过程。(±)-1d或(S)-1d与对甲氧基苯基衍生的烯基硼酸酯2b反应,能以相似的收率和对映选择性得到偶联产物4,且回收的原料1d的对映选择性与反应原料的对映选择性保持一致(Scheme 3D)。该结果表明反应未经历动力学拆分过程。

(图片来源:J. Am. Chem. Soc.)
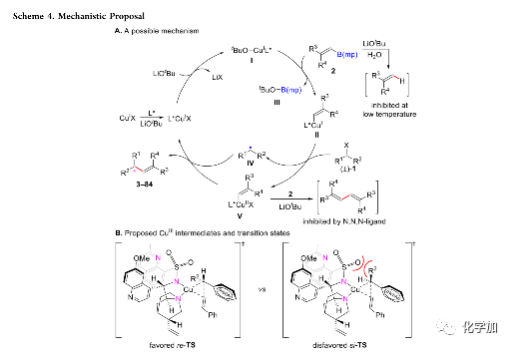
根据对照实验的结果以及前人的研究,作者提出可能的反应机理(Scheme 4A):首先,Cu(I)、手性配体和LiOtBu反应得到活化的铜络合物I,其中,配体以三齿形式存在;然后,络合物I与烯基硼酸酯2发生转金属过程,生成烯基Cu(I)络合物II和硼酸盐III;络合物II再与烷基卤化物1发生单电子转移过程,生成前手性烷基自由基IV和烯基Cu(II)络合物V;最后,自由基IV和络合物V发生交叉偶联反应得到手性烯烃产物,同时,再生的L*Cu(I)进入下一个催化循环。最后的交叉偶联过程是反应的关键步骤,作者推测反应可能先生成以双齿形式和Cu(III)配位的络合物,再经历还原消除过程得到偶联产物(Scheme 4B)。基于该推测,作者提出两种可能的过渡态模型si-TS和re-TS。其中,re-TS为优势过渡态,可以转化为S-构型的产物。但目前没有足够的证据可以支持所提出的过渡态模型,作者将进行更多的实验和理论研究以揭示详细的反应机理。
(图片来源:J. Am. Chem. Soc.)
小结:南方科技大学刘心元和李忠良团队开发了铜/新型半不稳定手性N,N,N-配体催化苄基/炔丙基卤化物与烯基硼酸酯的不对称自由基C(sp3)-C(sp2)交叉偶联反应,并能以良好至优秀的收率和对映选择性得到一系列手性烯烃衍生物和手性1,4-烯炔衍生物。同时,多样的衍生转化证明了该反应的应用潜力。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn