

近日,山东大学刘磊教授课题组报道了一种通过位点和对映选择性 C(sp3)-H键氧化从而实现环状苄基叠氮化物的动力学拆分(KR)。同时,该催化体系具有良好的官能团耐受性,适用于一系列四氢喹啉-/二氢吲哚基有机叠氮化物,且具有优异的位点和对映体选择性。计算研究表明,有效的手性识别源自底物和催化剂之间氢键的相互作用。文章链接DOI:10.1038/s41467-022-29319-z
(图片来源:Nat. Commun.)
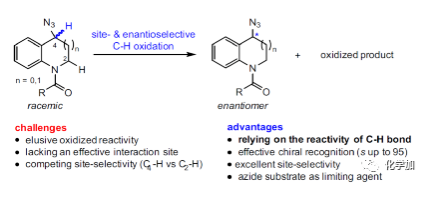
外消旋体的催化非酶促动力学拆分(KR)是制备具有价值对映体的一种高效且实用的方法。同时,手性有机叠氮化物是合成多种含氮分子的通用前体,并广泛应用于医学、生物学和材料科学等领域。然而,通过催化动力学拆分制备光学纯叠氮化物仍具有难度:(1)不稳定性阻碍了新反应中化学选择性的设计;(2)小尺寸环(small size)阻碍了有效的手性识别。目前,通过动力学拆分制备手性叠氮化物的方法包括叠氮化物-炔烃之间的环加成(AAC)(Fig. 1A)与烯烃的不对称双羟基化反应(Fig. 1B),但存在使用过量的叠氮化物、手性识别差、底物范围窄等问题。在此,山东大学刘磊教授课题组报道了一种通过位点和对映选择性C(sp3)-H键氧化从而实现环状苄基叠氮化物的动力学拆分(Fig. 1C)。首先,鉴于苯并稠合的含氮杂环分子在现代药理学中的重要性,作者选择了一系列具有此类骨架的外消旋苄基叠氮化物作为底物。其次,作者选择易于修饰的salen作为配体来寻找合适的金属催化剂。第三,通过改变氮单元的保护基团可为手性识别提供机会。基于上述的考虑,一系列(36个例子)环状苄基叠氮化物均以良好至优异的选择性因子(高达95)顺利进行了氧化动力学拆分过程。下载化学加APP,阅读更有效率。(手机上如何查询化合物分子式、结构式、制备方法、合成路线、图谱信息、供应商?)
(图片来源:Nat. Commun.)
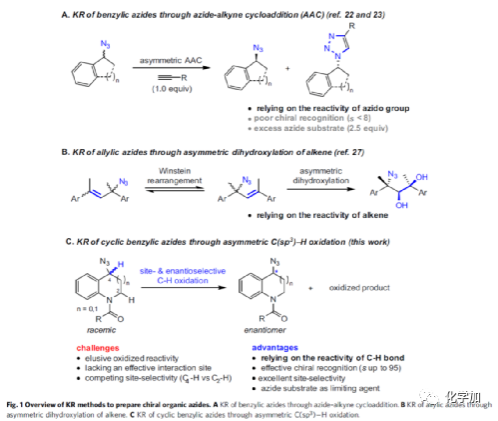
首先,作者以四氢喹啉基有机叠氮化物rac-1a作为模型底物,进行了相关氧化动力学拆分反应条件的筛选(Table 1)。当以C12作为催化剂,PhIO作为氧化剂,在乙酸乙酯溶剂中反应,能以52%的收率和98%ee获得产物(S)-1a,选择性因子s为91。
(图片来源:Nat. Commun.)
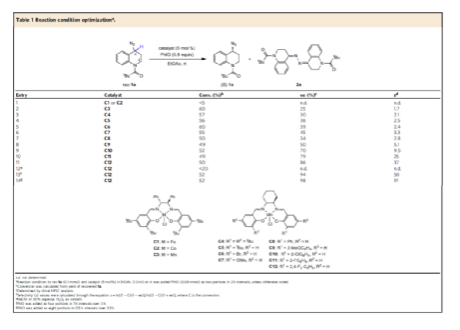
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Fig. 2)。首先,当R1取代为一系列不同电性的基团时,均可顺利反应,获得相应的光学纯产物 (S)-1a-1m,收率为46-50%,ee为90-98%,s为29-91。值得注意的是,该反应具有良好的官能团兼容性,如卤素、甲硅烷基醚、三氟甲磺酸基等均与体系兼容。其次,当R2取代为一系列烷基、环己基等时,也可顺利进行反应,获得相应的手性产物(S)-1n-1u,收率为44-47%,ee为90-95%,s为20-35。
(图片来源:Nat. Commun.)
同时,作者发现,当使用C7作为催化剂时,一系列吲哚基有机叠氮化物rac-3也能够顺利进行反应(Fig. 3)。当底物中的R1取代为甲基、甲氧基、卤素时,均与体系兼容,得相应的手性产物(S)-3a-3h,收率为46-51%,ee为90-97%,s为35-95。其次,当底物中的R2取代为甲基、正丙基时,也是合适的底物,获得相应的手性产物(S)-3i与(S)-3j。然而,当底物中的R2取代为叔丁基时,未能顺利进行反应,如rac-3k。值得注意的是,与叠氮基相邻的C3-H键具有优异的位点选择性,而非C2-H键。
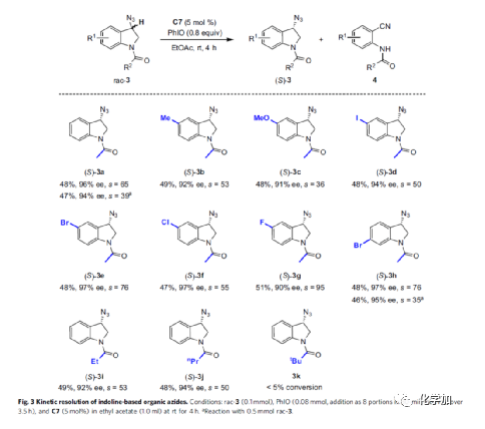
(图片来源:Nat. Commun.)
紧接着,作者对反应的实用性进行了研究(Fig. 4)。例如,通过铜催化(S)-1a与维生素E衍生物(5)和雌酮衍生物(7)之间的AAC,可将三氮唑单元引入THQ骨架中。

(图片来源:Nat. Commun.)
为了进一步了解反应的机理,作者进行了相关的控制实验(Fig. 5)。首先,通过Mn(salen)催化剂与回收底物ee值之间的线性关系曲线表明,回收底物3a与C7的ee成正比(Fig. 5A)。当rac-1a的标准体系中无PhIO时,反应未能进行,从而表明oxoMn(V)可能是负责C-H键氧化的配合物(Fig. 5B)。通过rac-1a 和[D]-rac-1a的混合物进行的竞争性氘动力学同位素效应(KIE)表明,C-H键断裂可能参与决速步骤(Fig. 5C)。其次,不同酰基取代的底物对于反应影响较大,空间位阻大的底物比空间位阻小的底物更具反应性,可能是由于羰基单元的α-烷基与Mn(salen)催化剂之间的非共价相互作用导致(Fig. 5D)。此外,通过氘代实验表明,羰基单元α-位的sp3 C-H键对底物3a的反应性至关重要(Fig. 5E)。
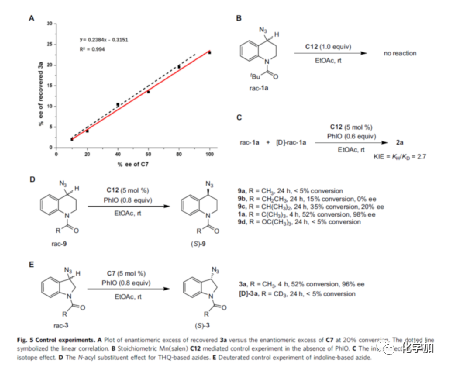
(图片来源:Nat. Commun.)
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Fig. 6)。首先,手性MnIII催化剂被PhIO氧化,生成oxoMnV中间体,可与rac-1a 经HAT,生成苄基自由基10和MnIV-OH。叠氮化物10脱除氮气后可形成亚氨基自由基11,可经快速二聚化生成二聚物2a。MnIV-OH通过脱去水后进行二聚化可生成μ-oxo桥接的二聚体MnIVOMnIV,其可能发生歧化反应,从而再生MnIII 催化剂和oxoMnV配合物以完成催化循环。其次,作者还提出了一种可能的二氢吲哚基苄基叠氮化物的氧化动力学拆分过程。rac-3a可能通过与oxoMnV配合物经类似的HAT过程生成苄基自由基12,经氮气的脱除与C-C键的断裂生成烷基自由基中间体14。烷基自由基14可与MnIV-OH发生oxygen rebound,然后进行半缩醛胺的分解,从而生成2-氨基苄腈4a以及用于催化循环的MnIII催化剂。
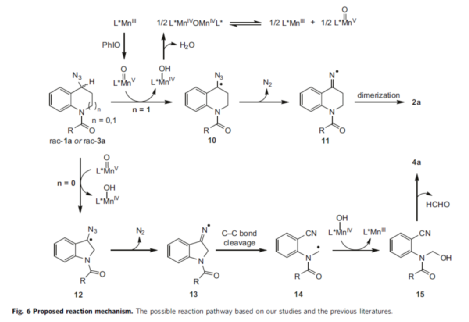
(图片来源:Nat. Commun.)
为了进一步阐明rac-1a出色的手性识别起源,作者进行了相关的DFT计算(Fig. 7)。计算结果表明,有效的手性识别源自底物和催化剂之间CH···F氢键的相互作用。
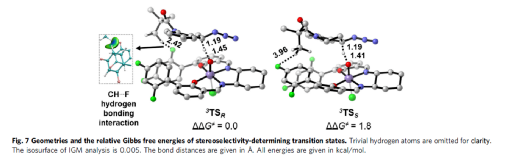
(图片来源:Nat. Commun.)
总结:山东大学刘磊教授课题组报道了一种通过位点和对映选择性 C(sp3)-H键氧化从而实现环状苄基叠氮化物的动力学拆分。同时,该催化体系具有良好的官能团耐受性,适用于一系列四氢喹啉-/二氢吲哚基有机叠氮化物,且具有优异的位点和对映体选择性。此外,通过相关的计算研究表明,有效的手性识别源自底物和催化剂之间氢键的相互作用。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn