- 首页
- 资讯
中国科学技术大学王细胜教授课题组JACS:对映选择性合成β-三氟甲基二级醇
来源:化学加网 2022-04-19
导读:近日,中国科学技术大学王细胜教授课题组首次报道了一种镍催化酰氯的不对称还原交叉偶联三氟烷基化反应,实现了一系列α-三氟甲基化酮的对映选择性合成。同时,将其用以一锅法还原反应,可获得具有β-CF3-取代立体碳中心的醇衍生物,且具有优异的非对映和对映选择性。此外,该反应具有反应条件温和、官能团兼容性良好、收率良好、对映选择性出色等特点。值得注意的是,通过对生物活性分子的后期修饰,进一步证明了反应的实用性。文章链接DOI:10.1021/jacs.2c01422
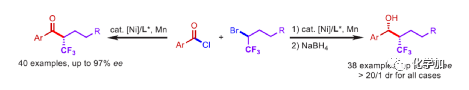
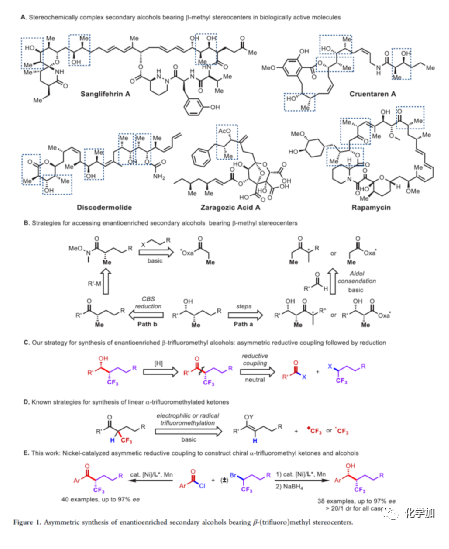
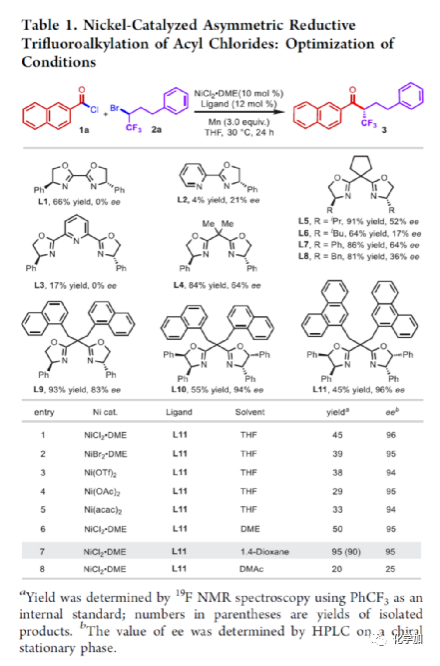
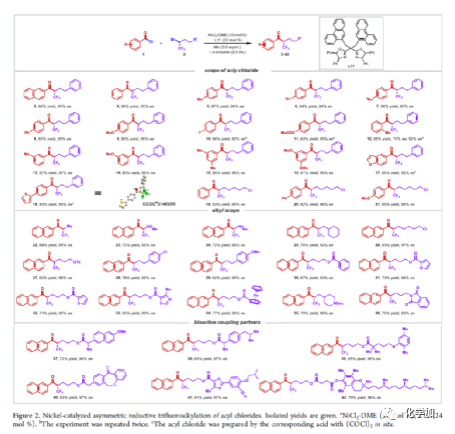
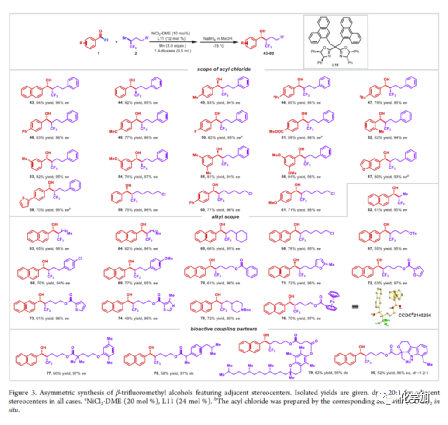
在过去的几十年中,手性药物分子的构建备受关注。由于手性分子和外消旋体的对映异构体之间的分子间相互作用存在差异,因此手性药物的对映异构体可导致药效、药代动力学甚至毒性等活性出现明显的差异。同时,将氟原子引入至化合物中,氟对类药物分子的生物活性产生了独特的影响。与已知的芳烃氟化或氟烷基化反应相比,对于通过不对称策略构建此类化合物的有效方法却很少被研究。其中,烃类的氟化反应是构建手性脂肪族氟化物的主要方法,若将三氟甲基基团引入分子中,常需要使用氧化/腐蚀性的亲电三氟甲基源(Togni、Umemoto试剂等)。同时,含有β-甲基立体中心的二级醇结构单元广泛存在于各种生物活性天然产物和药物中(Figure 1A)。因此,许多课题组已开发出多种用于构建此类分子的不对称合成方法,如醛的不对称aldol缩合反应与不对称烷基化/CBS还原的方法(Figure 1B)。迄今为止,对于具有β-CF3-取代立体碳中心的醇衍生物的不对称方法,仍有待进一步探索。下载化学加APP,阅读更有效率。(手机上如何查询化合物分子式、结构式、制备方法、合成路线、图谱信息、供应商?)考虑到空间位阻更大的三氟甲基可以有效的控制手性α-三氟甲基酮的非对映选择性还原,王剑波课题组假设,是否可将不对称偶联与还原反应相结合,从而实现对映体富集β-CF3-取代的醇衍生物的合成(Figure 1C)。然而,由于存在酸性的α-氢原子,酮-烯醇互变异构体通过传统的亲电或自由基三氟甲基化反应,仅获得外消旋或对映选择性差的α-三氟甲基酮衍生物(Figure 1D)。因此,对于β-三氟甲基醇分子的对映选择性构建也存在此类问题。近日,王剑波课题组报道了一种ScIII催化的同系化反应,从而实现了α-三氟甲基环庚酮分子的对映选择性合成,其中使用2,2,2-三氟重氮乙烷作为CF3源。在此,中国科学技术大学王细胜教授课题组报道了一种镍催化酰氯的不对称还原交叉偶联三氟烷基化反应,而合成了一系列对映体富集的α-三氟甲基酮衍生物。同时,将其用以一锅法还原反应,可获得具有β-CF3-取代的立体碳中心醇衍生物。值得注意的是,上述的策略具有优异的立体化学选择性、温和的反应条件、良好的官能团兼容性等特点,并可用于多种生物活性分子的后期修饰(Figure 1E)。首先,作者以2-萘甲酰氯1a与外消旋的三氟甲基化烷基溴2a作为模型底物,进行了相关不对称还原三氟烷基化反应条件的筛选(Table 1)。当以NiCl2·DME作为催化剂,L11作为配体,Mn粉作为还原剂,在1,4-二氧六环溶剂中反应,能以90%的收率和95%ee获得产物3。在获得上述最佳反应条件后,作者对不对称还原三氟烷基化反应的底物范围进行了扩展(Figure 2)。首先,苯甲酰氯的芳基对/间上含有一系列供电子与电中性基团时,均可顺利反应,获得相应的产物3-9、13-17与19-21,收率为80-91%,ee为94-97%。对于苯甲酰氯的芳基对位含有吸电子基团时,反应的收率有所下降,但对映选择性不受影响,如10-11。由于空间位阻的原因,邻甲基取代的苯甲酰氯,收率与对映选择性均受影响,如12。然而,对于芳基上含有它杂环取代的苯甲酰氯,仅有对位含有噻吩基取代的底物,获得优异收率与对映选择性的产物18,其余反应性均较差。其次,一系列不同取代的三氟烷基溴化物,在上述的条件下,均可顺利进行反应,获得相应的产物22-36,收率为55-83%,ee为90-97%。其中,对于不含任何杂原子的简单烷基链的三氟烷基溴(22-25)以及烷基链末端含有氯或甲苯磺酸酯基的三氟烷基溴(26-27),均与体系兼容。芳基上具有不同电性的取代基以及杂环芳烃衍生的三氟烷基溴底物(28-29和31-33),均可顺利进行反应。此外,该策略还可用于生物活性分子的后期修饰,如萘普生(37)、(S)-布洛芬(38)、吉非罗齐(39)、伊索克酸(40)、非布司他(41)、维生素E(42)。紧接着,作者发现,上述合成的α-三氟甲基化酮通过NaBH4还原,可进一步获得一系列手性β-三氟甲基醇衍生物43-80,具有中等至良好的收率、出色的对映选择性与非对映选择性(Figure 3)。因此,通过两步一锅法可快速合成一系列手性β-三氟甲基醇衍生物。令人惊讶的是,当使用邻甲基苯甲酰氯和三氟烷基溴进行不对称偶联反应时,获得收率偏低的产物52(52%),但对映选择性不受影响(94%)。总结:中国科学技术大学王细胜教授课题组报道了一种高效且通用的镍催化酰氯的不对称还原性交叉偶联三氟烷基化反应,实现了一系列手性α-三氟甲基化酮的对映选择性合成。同时,通过两步一锅法的策略,可获得具有β-CF3-取代的立体碳中心醇衍生物。此外,该反应具有反应条件温和、官能团兼容性良好、收率高、对映/非对映选择性出色等特点。值得注意的是,通过对生物活性分子的后期修饰,从而进一步证明了反应的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn