

导语
肿瘤是危害人民生命和健康的重大恶性疾病之一,化学药物目前仍是治疗肿瘤的最为主要的手段之一。因此,开展更为深入系统的抗肿瘤药物创制具有重要的现实和战略意义。在抗肿瘤药物开发过程中,中药资源是蕴含具抗肿瘤活性化合物的天然宝库,亦是发掘新一代抗肿瘤先导结构的重要源泉。天然源生物碱作为自然界中广泛分布的一类重要含氮天然产物,因其结构的丰富性和活性多样性,以及与受体结合的特异性功能,为发现新药先导结构提供了有价值的线索,成为人们寻找活性化合物的最佳向导,已引导和启发了很多重要的新药发明。尤其是喜树碱作为一个“经典”老兵,仍在在抗肿瘤药物开发方面续写着“新传”,以其为先导经优化获得了数十个上市或进入临床试验阶段的候选药物。近年来,兰州大学刘映前团队以喜树碱为为修饰和结构优化目标,综合运用多样性导向合成、生物电子等排、骨架跃迁、活性官能团导向设计以及活性合成子后修饰策略等分子优化操作,融合多层次化学结构特征系统开展了基于喜树碱类Top I抑制剂的新化学实体的设计合成与结构优化研究,已取得了一系列重要研究成果,获得了以YQL-9a、WCN-21、WCN-171和WCN-215等为代表的具有开发前景的高活性候选先导,同时,该团队也开展了非喜树碱类Top I抑制剂的先导发现与结构优化研究,获得了以YCJ-02、X-25等为代表的高活性先导,其系列相关成果已在药物化学高水平期刊Med. Res. Rev.、J. Med. Chem、Europ. J. Med. Chem、Bioorg. Chem.、Bioorg. Med. Chem.、Biochem. Pharmacol.等杂志上发表。
刘映前课题组简介:
刘映前教授团队以“天然药物化学生物学/药物化学”为主要研究方向,长期致力于中药与天然源生物活性功能分子的先导发现、多样性导向合成、药效评价及其应用开发研究,尤其是课题组聚焦“天然源生物碱”的功效挖掘和新药创制方面形成了一定的特色,获得了多个具应用前景的候选先导。其系列成果已在Med. Res. Rev.、J. Med. Chem、Europ. J. Med. Chem等杂志发表SCI论文近百篇,受邀以“中药及药用植物资源--生物碱 “专题在药物化学Top杂志Med. Res. Rev.撰写了专题性系列报道,作为副主编参编论著3部, 为《The Alkaloids: Chemistry and Biology》专刊撰写题为《Biology of quinoline and quinazoline alkaloids》章节内容。其相关成果申请国家发明专利100余件,PCT专利1件,申请软件著作权2项,成果转化5项。
刘映前教授简介:

刘映前 :博士/博士后,教授/博导,甘肃省飞天学者,甘肃省陇原青年创新创业团队负责人,甘肃省中藏药功效物质开发与利用行业技术中心负责人,天然药物化学生物学研究所所长。曾任药学院院长,甘肃省药学会副理事长。现兼任中国民族医药协会民族医药教育专业委员会副会长,世界中联中医与农业产业分会第一届专家委员会委员,中国生物医药整合联盟理事,中国民族医药协会芳香医药分会副主任委员,甘肃省院内制剂产业技术创新战略联盟副理事长,甘肃省化学会理事、甘肃省化学会药物化学主任委员和甘肃省药学会天然药物与医药产业经济主任委员等职务。近年来,课题组发表高水平SCI论文发表近百篇,申请国家发明专利100余件,PCT专利1件,申请软件著作权2项,成果转化5项。承担国家重点研发计划、国家自然科学基金、甘肃省重点研发计划、甘肃省科技创新专项等科技项目30余项,服务企业合作横向项目以及与企业联合的产学研课题60余项。先后获甘肃药学会药学发展一、二等奖、中华中医药学会科学技术奖(政策研究奖)、南京市科技进步三等奖等奖例。
有关喜树碱类生物碱及非喜树碱类Top I抑制剂的代表性科研成果总览与介绍:
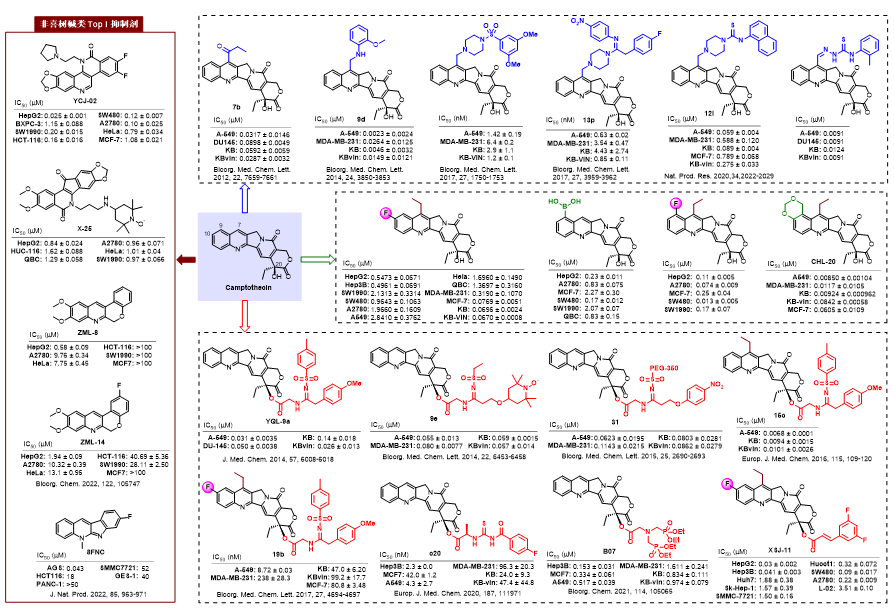
(1)代表性成果介绍-1:20(S)-喜树碱的磺酰脒衍生物的抗肿瘤活性评价及其机制研究:
本研究通过铜催化的三组分反应设计合成了一系列新型20(S)-喜树碱磺酰脒衍生物,与伊立替康相比,它们对A-549、DU-145、KB和多药耐药(MDR)KBvin肿瘤细胞系显示出相近或更强的细胞毒性。从机理上讲,YQL-9a通过选择性抑制拓扑异构酶(Topo)I和激活ATM/Chk相关的DNA损伤反应途径,显著诱导DNA损伤。在异种移植模型中,YQL-9a在5 mg/kg和10 mg/kg时表现出显著的活性,没有明显的不良反应。值得注意的是,与喜树碱(LD50 56.2 mg/kg,i.p.)和伊立替康(LD50 177.5 mg/kg,i.p.)相比,在300 mg/kg(i.p.)的高浓度给药下YQL-9a仍没有明显毒性。此外,YQL-9a以类似于喜树碱的方式抑制拓扑异构酶I活性,证实YQL-9a是一类新的拓扑异构酶I抑制剂,获得了以YQL-9a为代表的全新候选先导,为其进一步开发奠定理论基础。
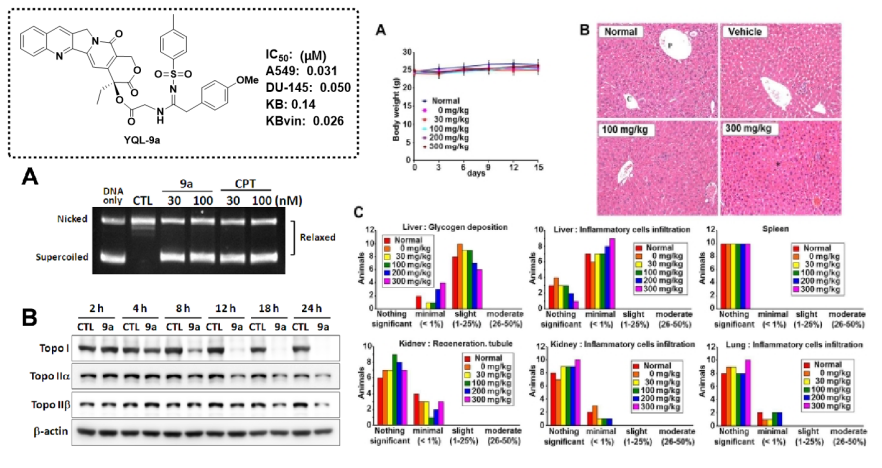
(2)代表性成果介绍-2:20(S)-喜树碱的酰基硫脲衍生物的抗肿瘤活性评价及其机制研究:
本研究设计合成了新型20(S)-喜树碱酰基硫脲衍生物,并评价其对六种肿瘤细胞系(Hep3B、MCF7、A549、MDA-MB-231、KB和KB vin)的体外细胞毒活性。其中,化合物c20具有显著的体外细胞毒活性,比拓扑替康更有效。从机制上讲,c20不仅能诱导A549细胞的细胞周期阻滞和细胞凋亡,而且以类似于拓扑替康的方式抑制拓扑异构酶I的活性。在异种移植和原发性肝癌小鼠模型中,c20显示出显著的体内抗癌活性,并且比拓扑替康更有效。此外,急性毒性试验表明,c20对FVB/N小鼠的肝脏、肾脏和造血系统没有明显毒性。获得了以c20为代表的全新候选先导,为其进一步开发奠定理论基础。
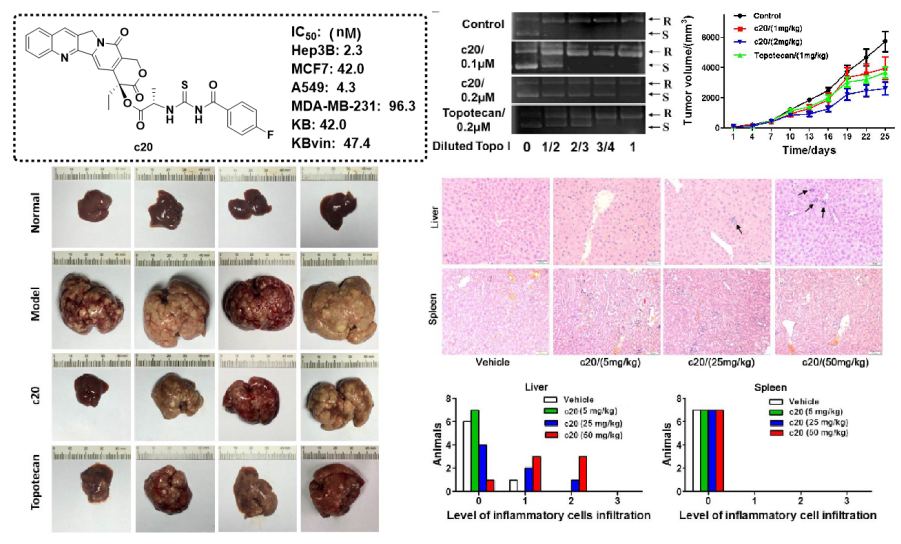
(3)代表性成果-3:20(S)-喜树碱的氨基膦酸酯衍生物的抗肿瘤活性评价及其机制研究
本研究通过FeCl3催化一锅法合成了新型喜树碱20(S)-氨基膦酸酯衍生物。与伊立替康相比,所有这些化合物对Hep3B、MCF-7、A-549、MDA-MB-231、KB和多药耐药(MDR)KB-vin细胞系显示出相近或更强的细胞毒性活性。其中,化合物B07显示出显著的细胞毒性,活性比伊立替康提高10倍。机制上,B07不仅诱导Hep3B和MCF-7细胞凋亡和细胞周期阻滞,而且以类似于伊立替康的方式抑制拓扑异构酶I活性。在异种移植和原发性肝癌小鼠模型中,B07显示出显著的抗肿瘤活性,并且比伊立替康更有效。此外,急性毒性试验表明B07对FVB/N小鼠的肝脏、肾脏和造血系统没有明显毒性。因此,这些研究表明化合物B07可能是一种潜在的拓扑异构酶I药候选药物,可用于进一步的临床试验。
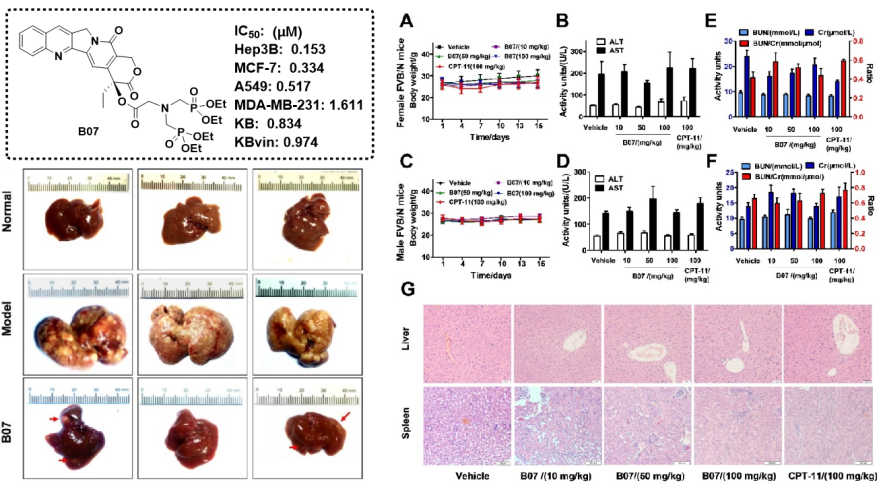
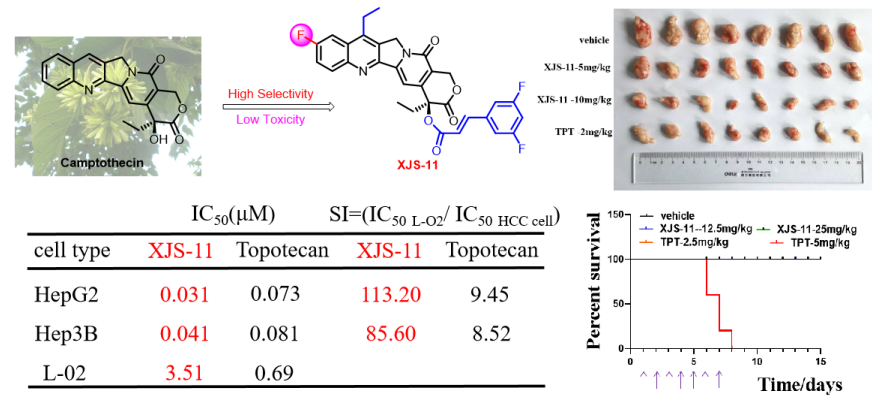
(4)代表性成果-4:7-乙基-10-氟-20-O-(肉桂酸酯)-喜树碱衍生物的抗肿瘤活性评价及其机制研究:本研究以课题组发现的高活性10-氟喜树碱为先导,设计合成了一系列新型7-乙基-10-氟-20-O-(肉桂酸酯)-喜树碱衍生物,并对多种肿瘤细胞系进行了细胞毒性评估,包括HepG2(肝细胞癌)、SW480(结直肠癌)、A2780(卵巢癌)和Hucct1(肝内胆管癌)等。体外细胞毒性试验结果表明,大多数喜树碱衍生物对受试肿瘤细胞系具有良好的细胞毒性活性。其中,化合物XJS-11对HepG2、SW480、A2780和Hucct1细胞株表现出广谱抑制活性,IC50值分别为0.03、0.09、0.22和0.32 μM。进一步研究表明,与阳性对照拓扑替康相比,化合物XJS-11对多种人类肝癌细胞(Sk-hep-1、Hep3B和Huh7)具有更有效的生长抑制作用,对永生化正常人类肝细胞系L02的细胞毒性更低。尤其是XJS-11对两种人肝癌细胞和永生化正常人肝细胞系(IC50(L-02)/IC50(HepG2)=113.20);IC50(L-02)/IC50(Hep3B)=85.60)比拓扑替康(IC50(L-02)/IC50(HepG2)=9.45;IC50(L-02)/IC50(Hep3B)=8.52)显示出更高的选择性毒性。在机制上,XJS-11可以类似拓扑替康的方式抑制Top I活性,诱导HepG2和Hep3B细胞的细胞周期阻滞和细胞凋亡。同时,XJS-11可以抑制异种移植和原发性肝癌小鼠模型中的肿瘤生长。此外,急性毒性试验表明,单次腹腔注射剂量为100 mg/kg或连续7天腹腔注射剂量为25 mg/kg,XJS-11均不会造成致命性或显著体重减轻。与拓扑替康不同,XJS-11对C57BL/6小鼠的肝脏、肾脏和造血系统没有明显毒性。该研究表明:XJS-11可作为新一代喜树碱候选先导来开发。
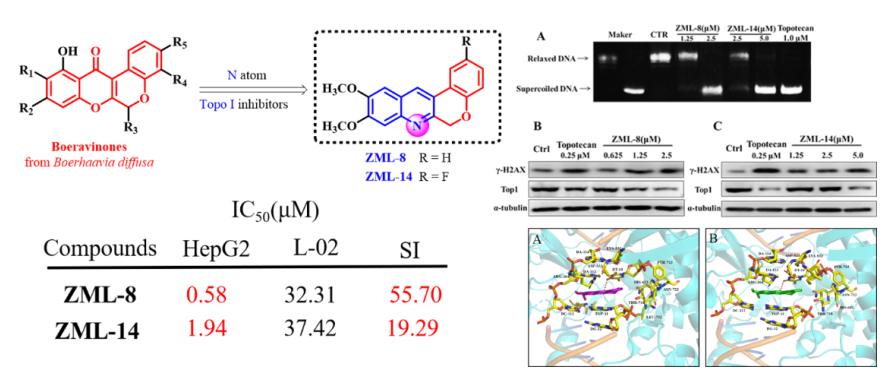
(5)代表性成果-5:Aza-boeravinone衍生物的抗肿瘤活性评价与作用机制研究:基于天然产物boeravinones的结构骨架,该团队采用“生物电子等排”和“Aza”结构优化策略设计合成了两个系列的6H-色烯并[3,4-b]喹啉衍生物,并且进一步评估了合成化合物对HepG2、A2780、Hela、HCT116、SW1990和MCF7等多种肿瘤细胞株的细胞毒活性。细胞毒活性筛选结果表明,化合物ZML-8和ZML-14对HepG2具有显著的抑制效果,IC50值分别为0.58 μM和1.94 μM。此外,化合物ZML-8和ZML-14对HepG2和L-02细胞的选择性高于对照药Topotecan。细胞机制研究表明,化合物ZML-8和ZML-14诱导HepG2细胞周期G2/M期阻滞、细胞凋亡和DNA损伤。此外,化合物ZML-8和ZML-14显著抑制Top I的酶活性,并且诱导Top I蛋白水平的降解。分子对接表明,化合物ZML-8和ZML-14显著的细胞毒活性是由于与Top1-DNA 复合物的良好相互作用。综上所述,化合物ZML-8和ZML-14作为用于治疗癌症的新一代非喜树碱拓扑异构酶I抑制剂,值得进一步开发。
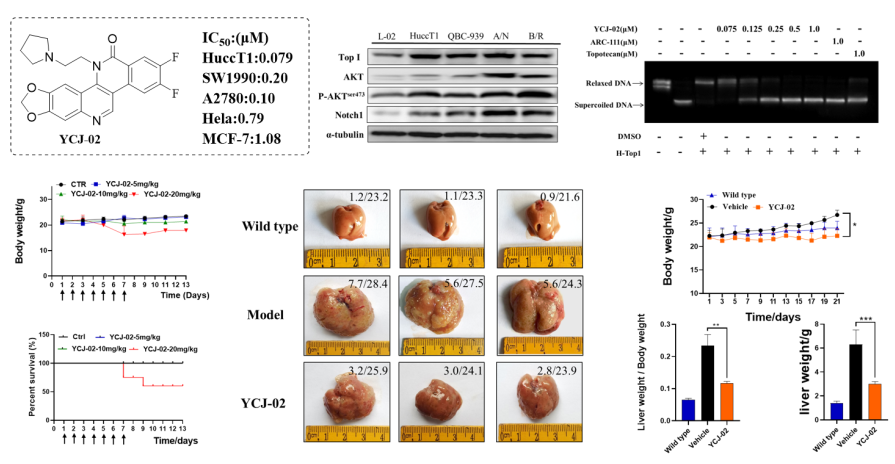
(6)代表性成果-6:双氟取代的ARC-111衍生物YCJ-02在肝内胆管癌(ICC)中的抗肿瘤活性评价及作用机制研究:本研究围绕苯并萘啶酮类化合物进行了广泛的构效关系(SAR)研究,并设计合成了一系列双氟取代的ARC-111衍生物。其中,化合物YCJ-02具有广谱的抗肿瘤活性,尤其对ICC细胞系HuccT1具有显著的抑制活性,IC50值为0.079 μM,且活性优于对照药ARC-111(0.12 μM)和Topotecan(0.46 μM)。因此,进一步评估了YCJ-02在体外抑制ICC细胞生长的潜力,并通过AKT/NICD诱导的原位小鼠ICC肿瘤模型验证其在体内的抗肿瘤活性。研究结果表明:Top I在ICC临床样本和细胞系中显著高表达,并且敲除Top I抑制ICC细胞的生长。YCJ-02显著抑制ICC细胞的增殖,且活性优于对照药ARC-111和Topotecan。YCJ-02诱导细胞周期G2/M期阻滞并增加p21、p53的表达;YCJ-02诱导细胞凋亡并伴随着Bax、Bad和Cleaved-caspase3的激活以及Bcl-2的降低;YCJ-02还通过增加γ-H2AX的表达诱导DNA损伤。YCJ-02可以抑制Top I的酶活性并通过蛋白酶体系统诱导其降解。YCJ-02显著抑制AKT/Notch诱导的小鼠原位ICC肿瘤生长并降低CK19、Ki-67、p-AKTser473、Notch1和Top I的表达。总之,YCJ-02是一个高效的Top I抑制剂,并且可能成为一个治疗ICC的有效药物,为以后的临床评估提供了一种合理的新型治疗策略。
(7)代表性成果-7:稳定氮氧自由基标记的茚并异喹啉类化合物的结构优化与抗肿瘤活性研究:本研究在茚并异喹啉类分子构效关系的基础上,通过在内酰胺侧链上的酰胺键引入氮氧自由基分子的策略设计合成了一系列稳定氮氧自由基标记的茚并异喹啉类衍生物。细胞毒性筛选结果表明,化合物X-25具有广谱的抗肿瘤活性,对HepG2、HCT-116、QBC-939、A2780、HeLa和SW1990的IC50分别为0.84 μM、1.62 μM、1.29 μM、0.96 μM、1.01 μM和0.97 μM。进一步的细胞机制研究表明,化合物X-25诱导HepG2细胞周期G/M期阻滞和细胞凋亡。此外,化合物X-25降低Top I的蛋白表达水平和通过增加γ-H2AX的表达诱导DNA损伤。体内研究结果表明,化合物X-25显著抑制了AKT/Ras诱导的小鼠原位HCC的生长,肝重和肝重比显著降低,且未见明显体重下降。这些结果表明,化合物X-25是一种潜在的非喜树碱类Top I候选药物,值得进一步研究和开发。

总结:
综上所述,课题组近年来以喜树碱类生物碱及非喜树碱类Top I抑制剂为先导,经优化获得了多个具开发前景的候选先导,研究取得的系列成果及重要进展为后续开发具有完整自主知识产权的抗肿瘤药物奠定基础,其发现的高活性先导分子有望开发为具有自主知识产权的全新抗肿瘤候选药剂。 研究工作得到了国家重点研发计划、国家自然科学基金、浙江省优势特色学科重点项目、甘肃省国际科技合作重点项目等项目的共同资助。该项研究也是课题组近年来依托甘肃省中藏药功效物质开发与利用行业技术中心,开展源于天然源中藏药资源进行全新抗肿瘤药物开发研究取得的一系列重要科研成果,对于推动中藏药功效物质开发与新药创制具有重要意义。
代表性文献导读:
[1] Mei-Juan Wang, Ying-Qian Liu,* Ling-Chu Chang, Chih-Ya Wang, Yong-Long Zhao, Xiao-Bo Zhao, Keduo Qian, Xiang Nan, Liu Yang, Xiao-Ming Yang, Hsin-Yi Hung, Jai-Sing Yang, Daih-Huang Kuo, Masuo Goto, Susan L. Morris-Natschke, Shiow-Lin Pan, Che-Ming Teng, Sheng-Chu Kuo, Tian-Shung Wu, Yang-Chang Wu, Kuo-Hsiung Lee*. Design, Synthesis, Mechanisms of Action, and Toxicity of Novel 20(S)-Sulfonylamidine Derivatives of Camptothecin as Potent Antitumor Agents. J. Med. Chem. 2014, 57, 6008~6018.
[2] Xiao-Bo Zhao, Dan Wu, Mei-Juan Wang, Masuo Goto, Susan L. Morris-Natschke, Ying-Qian Liu*, Xiao-Bing Wu, Zi-Long Song, Gao-Xiang Zhu, Kuo-Hsiung Lee*. Design and synthesis of novel spin-labeled camptothecin derivatives as potent cytotoxic agents. Bioorg. Med. Chem. Lett. 2014, 22, 6453~6458.
[3] Xiao-Bo Zhao, Masuo Goto, Zi-Long Song, Susan L. Morris-Natschke, Yu Zhao, Dan Wu, Liu Yang, Shu-Gang Li, Ying-Qian Liu*, Gao-Xiang Zhu, Xiao-Bing Wu, Kuo-Hsiung Lee*. Design and synthesis of new 7-(N-substituted-methyl)-camptothecin derivatives as potent cytotoxic agents. Bioorg. Med. Chem. Lett. 2014, 24, 3850~3853.
[4] Ying-Qian Liu, Wen-Qun Li, Susan L. Morris-Natschke, Keduo Qian, Liu Yang, Gao-Xiang Zhu, Xiao-Bing Wu, An-Liang Chen, Shao-Yong Zhang, Xiang Nan, Kuo-Hsiung Lee*. Perspectives on Biologically Active Camptothecin Derivatives. Med. Res. Rev. 2015, 35, 753-789.
[5] Zi-Long Song, Hai-Le Chen, Yu-Han Wang, Masuo Goto, Wen-Jing Gao, Pi-Le Cheng, Susan L. Morris-Natschke, Ying-Qian Liu*, Gao-Xiang Zhu, Mei-Juan Wang, Kuo-Hsiung Lee*. Design and synthesis of novel PEG-conjugated 20(S)-camptothecin sulfonylamidine derivatives with potent in vitro antitumor activity via Cu-catalyzed three-component reaction. Bioorg. Med. Chem. Lett. 2015, 25, 2690~2693.
[6] Zi-Long Song, Mei-Juan Wang, Lanlan Li, Dan Wu, Yu-Han Wang, Li-Ting Yan, Susan L. Morris-Natschke, Ying-Qian Liu*, Yong-Long Zhao, Chih-Ya Wang, Huan-xiang Liu*, Masuo Goto, Heng Liu, Gao-Xiang Zhu, Kuo-Hsiung Lee*. Design, synthesis, cytotoxic activity and molecular docking studies of new 20(S)-sulfonylamidine camptothecin derivatives. Europ. J. Med. Chem. 2016, 115, 109~120.
[7] Cheng-Jie Yang, Zi-Long Song, Masuo Goto, Pei-Ling Hsu, Xiao-Shuai Zhang, Qian-Ru Yang, Ying-Qian Liu*, Mei-Juan Wang, Susan L. Morris-Natschke, Xiao-Fei Shang, Kuo-Hsiung Lee*. Design, semisynthesis and potent cytotoxic activity of novel 10-fluorocamptothecin derivatives. Bioorg. Med. Chem. Lett. 2017, 27, 4694~4697.
[8] Cheng-Jie Yang, Zi-Long Song, Masuo Goto, Ying-Qian Liu*, Kan-Yen Hsieh, Susan L. Morris-Natschke, Yong-Long Zhao, Jun-Xiang Zhang, Kuo-Hsiung Lee*. Design, synthesis, and cytotoxic activity of novel 7-substituted camptothecin derivatives incorporating piperazinyl-sulfonylamidine moieties. Bioorg. Med. Chem. Lett. 2017, 27, 3959~3962.
[9] Gao-Xiang Zhu, Pi-Le Cheng, Masuo Goto, Na Zhang, Susan L. Morris-Natschke, Kan-Yen Hsieh,Guan-Zhou Yang, Qian-Ru Yang, Ying-Qian Liu*, Hai-Le Chen, Xiao-Shuai Zhang, Kuo-Hsiung Lee*. Design, synthesis and potent cytotoxic activity of novel 7-( N -[(substituted-sulfonyl)piperazinyl]-methyl)-camptothecin derivatives. Bioorg. Med. Chem. Lett. 2017, 27, 1750~1753.
[10] Jia You, Yuyuan Chen, Zubaeda M. Mohamed Alsayeh, Xing-yu Shen, Chun Li, Peng-xuan Zhao, Fei Chen, Ying-qian Liu*, Chuan-rui Xu. Nanocrystals of a new camptothecin derivative WCN-21 enhance its solubility and efficacy. Oncotarget, 2017, 8, 29808~29822.
[11] Cheng-Jie Yang, Bin Li, Zhi-Jun Zhang, Jian-Mei Gao, Mei-Juan Wang, Xiao-Bo Zhao, Zi-Long Song, Ying-Qian Liu*, Hu Li, Yu-yuan Chen, Kuo-Hsiung Lee, Susan L. Morris-Natschke, Chuan-rui Xu. Design, synthesis and antineoplastic activity of novel 20(S)-acylthiourea derivatives of camptothecin. Europ. J. Med. Chem. 2020, 187, 111971.
[12] Yu-Yuan Chen,Yin-Peng Bai, Bin Li, Xiao-Bo Zhao, Cheng-Jie Yang, Ying-Qian Liu*, Jian-Mei Gao, Jun Guo, Chun Li, Jing-Wen Peng, Zhong-Min Zhao, Zhi-Jun Zhang, Chuan-Rui Xu*. Design and synthesis of novel 20(S)-α-aminophosphonate derivatives of camptothecin as potent antitumor agents. Bioorg. Chem. 2021, 114, 105065.
[13] Yun-Hao Ma, Wan-Tong Ma, Zhong-Kun Zhou, Xiu Huang, Xin-Rong Jiang, Kang-Jia Du, Meng-Ze Sun, Hao Zhang,Hong Fang, Yi Zhao, Hong-Mei Zhu, Huan-Xiang Liu, Peng Chen*,Ying-Qian Liu*.Synthesis of 8-Fluoroneocryptolepine and Evaluation for Cytotoxic Activity against AGS Cancer Cells. J. Nat. Prod. 2022, 85, 963~971.
[14] Yong Zhou, Yin-Peng Bai, Mi Zhang, Jian-Mei Gao, Cheng-Jie Yang, Zhi-Jun Zhang*, Nan Deng, Lei Li, Ying-Qian Liu*, Chuanrui Xu,*. Design and Synthesis of Aza-boeravinone Derivatives as Potential novel Topoisomerase I Inhibitors. Bioorg. Chem. 2022, 122, 105747.
[15] Yin-Peng Bai, Cheng-Jie Yang, Nan Deng, Mi Zhang, Zhi-Jun Zhang*, Lei Li, Yong Zhou, Xiong-Fei Luo, Chuan-Rui Xu*, Bao-Qi Zhang, Yue Ma, Ying-qian Liu*. Design and Synthesis of Novel 7-Ethyl-10-Fluoro-20-O-(Cinnamic Acid Ester)-Camptothecin Derivatives as Potential High Selectivity and Low Toxicity Topoisomerase I inhibitors for Hepatocellular Carcinoma. Biochem. Pharmacol. 2022, DOI: 10.1016/j.bcp.2022.115049.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn