

在过去的几十年里,化学家们已从三尖杉属里分离报道了70多种三尖杉属二萜类化合物(Cephalotaxus diterpenoids1-9,图1),这些天然产物大多具有独特的环系和良好的生物活性。在结构上,这些天然产物包括三尖杉属C20二萜类化合物(如MannolideC(9))、三尖杉属C19环庚三烯酮类(如Harringtonolide(7)和Fortunolide A(8))、其它三尖杉属C19降二萜类化合物(如Cephanolide A(5)和Cephanolide C(6)),以及C18二降二萜类化合物(如Cephanolide A-C(1-3))。
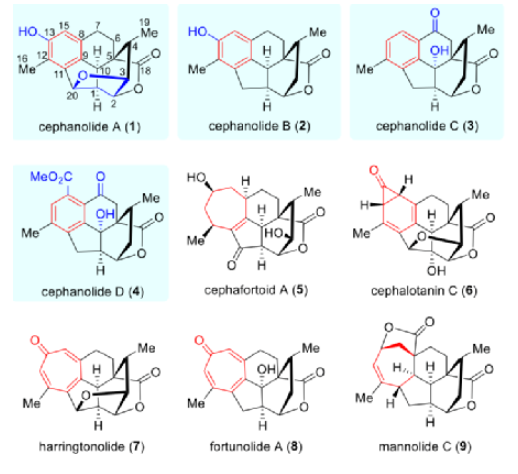
图1. 代表性的三尖杉属二萜类天然产物(图片来源:J. Am. Chem. Soc.)
2017年,岳建民院士团队从Cephalotaxus sinensis中分离出四种结构独特的三尖杉属二萜类Cephanolide A-D(1-4)。Cephanolide A-C(1-3)是A环-收缩的三尖杉属C18二降二萜,Cephanolide D(4)是一种A环收缩的降二萜。这四种天然产物是迄今为止发现的含苯环三尖杉属二萜的所有同源物,可能是从抗肿瘤三尖杉属环庚三烯酮类化合物中生物合成衍生的:三尖杉属环庚三烯酮(如Fortunolide A(8))中的环庚三烯酮部分的电环化产生含有环丙酮的中间体,随后经历Baeyer-Villiger型氧化和水解以提供苯环单元。
由于其独特的结构特点和良好的生物活性,三尖杉属二萜类Cephanolides A-D吸引了众多的合成化学家对其进行合成研究,其中,中国的化学家包括陕西师范大学的赵玉明课题组、华东师范大学的高栓虎课题组、复旦大学的蔡泉课题组以及北京大学的杨震课题组等都在该领域做出了卓越的贡献,展示了精彩的化学(图2)。
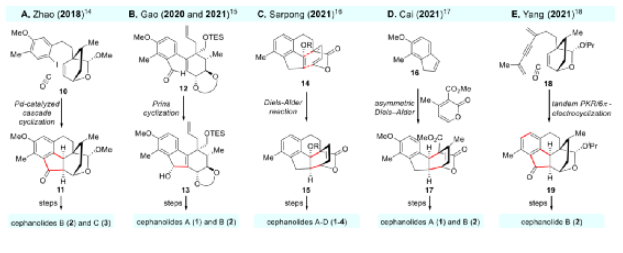
图2. 已报道的Cephanolides A-D的合成工作(图片来源:J. Am. Chem. Soc.)
翟宏斌课题组长期致力于三尖杉属二萜类化合物的合成,已完成C20二萜类Mannolide C(9)和C19环庚三烯酮Harringtonolide(7)的不对称全合成。由于Cephanolides A-D(1-4)都有一个共同的6-6-5-6四碳环骨架,其中嵌入了一个桥接的δ-内酯,但具有不同的氧化态,实现全合成的关键在于高效构建四环核心。作者认为Cephanolides A-D的四环核心应该可以从卤代烯炔I通过钯催化的部分分子间串联反应序列获得。串联反应过程始于I的氧化加成,然后是分子内碳钯化形成三环物种II。II优先与末端炔烃(如果后者比I更具反应性)反应生成III,它可以进行6-endo-trig碳钯化(形成IV)或6π-电环化(形成V)以提供所需的苯衍生物VI(图3A)。
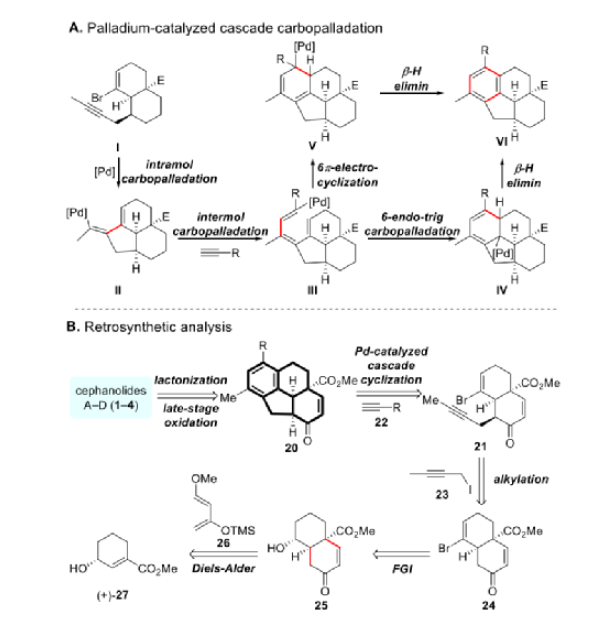
图3. 关键的串联反应及逆合成分析(图片来源:J. Am. Chem. Soc.)
Cephanolides A-D (1-4)的逆合成分析如图3B所示。所有四种目标分子都应该可以通过对共同四环核心20的后期氧化和内酯化来获得。化合物20可以从溴烯炔21和末端炔烃22通过上述串联反应序列生成。21可通过烯酮24的烷基化获得,烯酮24可以从25通过官能团互变(FGI)合成。6-6顺式稠环可以通过Danesefsky二烯(26)与手性不饱和酯27的Diels-Alder环加成获得。
具体合成路线如下:用异丁酸酐酰化已知的手性烯丙醇27以形成二酯28(图4)。Danishefsky二烯(26)与亲二烯体28的分子间Diels-Alder反应在180 °C无溶剂下顺利进行,在用K2CO3和MeOH脱酰后得到具有高非对映选择性(dr >20:1)的顺式双环片段25。28中的异丁酰基对该反应的非对映选择性至关重要。DMP氧化醇25,以93%的产率生成二酮29。在对反应条件进行广泛筛选后,二酮29 在与水合肼(1 eq.)在甲醇中回流时转化为单腙,再和三溴化吡啶鎓反应以中等产率获得溴代烯烃24。24在C1处与1-碘代-2-丁炔发生立体选择性单烷基化,值得一提的是,在用相应的溴化物取代碘化物23或在没有三乙基硼烷的情况下,不可避免地产生双烷基化副产物。接下来,单烷基化产物30中C1的构型通过连续的烯醇硅醚形成、TBAF去硅基化时立体选择性质子化而有效地翻转。
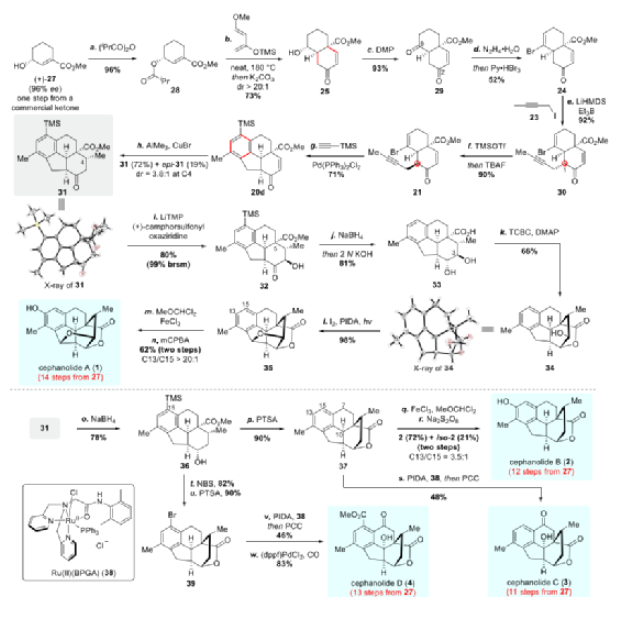
图4. Cephanolides A-D的全合成(图片来源:J. Am. Chem. Soc.)
有了溴烯炔21,作者将注意力转向了关键的钯催化的分子间串联反应序列以组装四环骨架。当使用三甲基硅基乙炔作为双碳源并以Pd(PPh3)2Cl2作为催化剂时,以60%的收率获得了四环20d。进一步筛选反应条件,当21与22e在Pd(PPh3)2Cl2和Et3N的存在下在DMF中100 °C下反应6 h时观察到最佳结果。该反应也可以克级规模进行,产率没有明显损失。
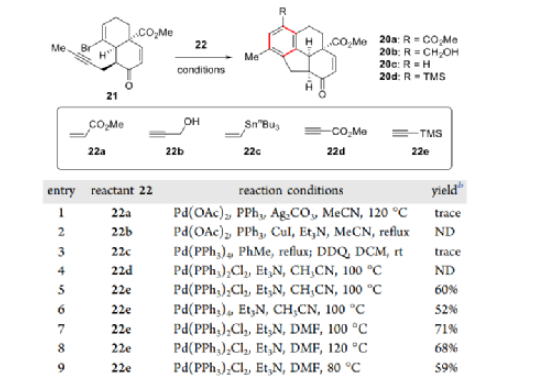
图5. 串联反应的条件筛选(图片来源:J. Am. Chem. Soc.)
在CuBr存在下,烯酮20d和Me3Al立体选择性Michael加成,以72%的产率提供酮酯31,同时以19%的产率(dr = 3.8:1)得到4-epi-31。31的结构经X-射线晶体学分析确证。
31的α-羟基化仅从β-面进行,并以80%的产率(基于起始原料回收的产率为99%)提供32。C3处出色的立体选择性更可能是由C5处的酯基引起的1,3-二直立键效应造成的,而不是由C4处的甲基所产生的空间位阻影响。NaBH4还原32的C2羰基随后在一锅中用2 N KOH皂化酯基,酸化后,在苯环上同时去硅基化,以81%的收率生成羧酸33。此时,完成Cephanolide A (1)的全合成就差内酯和四氢呋喃环的构建以及芳烃单元的羟基化。通过用TCBC/Et3N和DMAP处理实现33的化学选择性内酯化(不保护C3羟基),产生δ-内酯34,产率为66%。按照Sarpong等人的方案,对醇34进行Suárez氧化以构建THF环,从而以优异的产率得到六环35。1全合成的最后一个挑战是苯环上的区域选择性羟基化。作为Sarpong方案的补充,作者通过一个两步反应序列:(i)在FeCl3存在下用1,1-二氯甲基甲基醚对35进行傅克酰化(形成C13-甲酰化芳烃)和(ii)用mCPBA进行Baeyer-Villiger氧化重排(生成的甲酸酯中间体在反应条件下自发水解),从35开始经两步以62%的产率和高区域选择性(C13/C15 > 20:1)得到Cephanolide A (1)。1的合成样品的谱图数据与文献报道相符。
对于Cephanolide B(2)的全合成,化合物31与NaBH4的立体选择性还原得到仲醇36(78%),其和对甲苯磺酸反应,以90%的收率得到内酯37。化合物36的C2位羟基的构型通过相关2D NMR研究得到证实,该醇的整体结构通过单晶得到进一步验证。C13芳烃氧化通过类似于Cephanolide A的两步序列(即傅克甲酰化和Baeyer-Villiger氧化重排),得到Cephanolide B(C13/C15 = 3.5:1)。
Cephanolide C(3)从五环内酯37通过在C7和C10(三个可能的苄位中的两个)的选择性氧化获得。虽然赵玉明课题组在Cephanolide C的全合成中将DDQ应用于选择性苄基氧化(C10),但针对37,只回收了底物,并没有获得C10-羟基化产物,这可能是由于37中的C13(苯环上)缺少供电子的甲氧基所致。在Toma 等人的报道的启发下,作者随后研究了钴催化的TBHP介导的氧化方案。在这种情况下,目标分子3确实是通过C7和 C10的氧化生成的,产率仅为12%。用CrO3/3,5-二甲基吡唑在不同温度下氧化37,以28-38%的产率产生3,而用CrO3/AcOH或PCC氧化均不成功。2021年,Uchida 等人开发了一种钌催化的化学选择性和位点选择性C-H氧化,可用于没有给电子取代基的苄基氧化。五环37在Ru(II)(BPGA)/PIDA条件下氧化,3的产率为37%,同时产生少量的7,10-二羟基中间体。因此,在一锅中用Ru(II)(BPGA)(38)/PIDA和PCC依次处理五环37,以48%的产率提供Cephanolide C(3)。
与Cephanolide C(3)相比,Cephanolide D(4)在C15处具有额外的甲氧羰基官能团。用NBS将化合物36溴化,然后在酸性介质中进行内酯化,两步以74%的产率提供五环内酯39。类似于Cephanolide C(3)的合成,C7和C10的选择性苄位氧化是通过在一锅中用Ru(II)-(BPGA) (38)/PIDA和PCC连续处理来完成的,而不会脱掉底物中的溴原子。最后,Pd-催化的甲氧基羰基化,以83%的产率得到Cephanolide D(4)。
总结:翟宏斌课题组开发了一种高效的发散策略,从已知的手性醇27出发,经11-14步完成了Cephanolides A-D的不对称全合成。该合成的亮点包括:(i)底物控制的非对映选择性分子间Diels-Alder反应形成高度功能化的6-6顺式稠环,(ii)钯催化的形式双分子[2 + 2 + 2]环加成反应,通过涉及多个碳金属化的分子间串联反应序列快速安装关键的四环骨架,以及(iii)通过位置选择sp3(苄位)和sp2(苯环上)C-H氧化进行后期氧化多样化,从而实现了四种天然产物的发散性全合成。该合成工作将有助于各种三尖杉属二萜的大规模制备和进一步的生物活性研究。
参考消息:https://mp.weixin.qq.com/s/vRfmc3JWNxUtpMp_yrbQ_Q
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn