

Corey教授课题组在2021年曾报道过由硝酸四正丁基铵和三氟甲磺酸酐在CH2Cl2溶液中原位生成的TfONO2是合成硝基烯烃和选择性邻位硝化苯乙烯类化合物的高效试剂(Org. Lett. 2021, 23, 3399-3402.)。该试剂在从环戊烯合成C2-对称氮杂四喹烷1中特别有用。它也非常适合制备更复杂的硝基烯烃,如硝基雪松烯2(图1)。在此研究基础上,作者自然会想到研究相关的亚硝化试剂即三氟甲磺酸亚硝基酯,后者可类似地由n-Bu4N+NO2-和Tf2O生成。
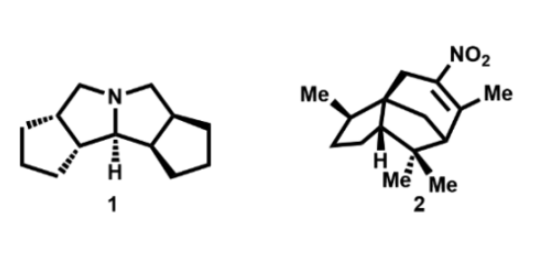
图1. TfONO2硝化试剂的应用(图片来源:Org. Lett.)
三氟甲磺酸亚硝基酯(TfONO)可由等摩尔量的三氟甲磺酸酐和四正丁基亚硝酸铵在CH2Cl2,-30 °C条件下制备得到,其19F NMR谱在δ -71.65处存在特征峰。减压蒸馏除去CH2Cl2,得到纯的TfONO,为黄色液体,可在0 °C下储存。由于原位制备的TfONO和蒸馏试剂得到相同的产物,因此通常用原位方法进行制备实验。
如图2所示,用原位制备的TfONO和雪松烯(3)反应,以87%的产率得到单体烯丙基亚硝基产物4,dr值为5:1,黄色液体,产物4的立体化学可由1H NMR NOE确定。另外,4作为单体它是稳定存在的,在1552 cm-1的红外波段处具有N=O双键特征吸收峰。
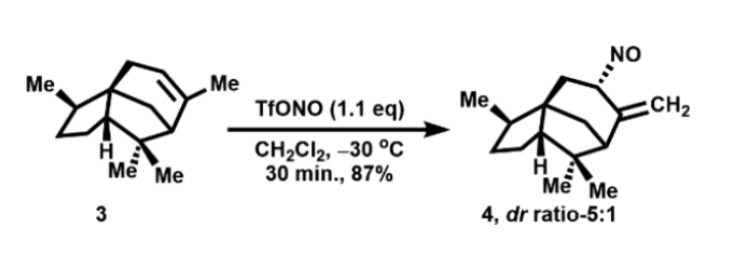
图2. TfONO对雪松烯的非对映选择性加成(图片来源:Org. Lett.)
单体亚硝基雪松烯衍生物4的高效制备为合成官能团化的雪松烯衍生物提供了便捷的途径,如图3中所示的化合物7-10。
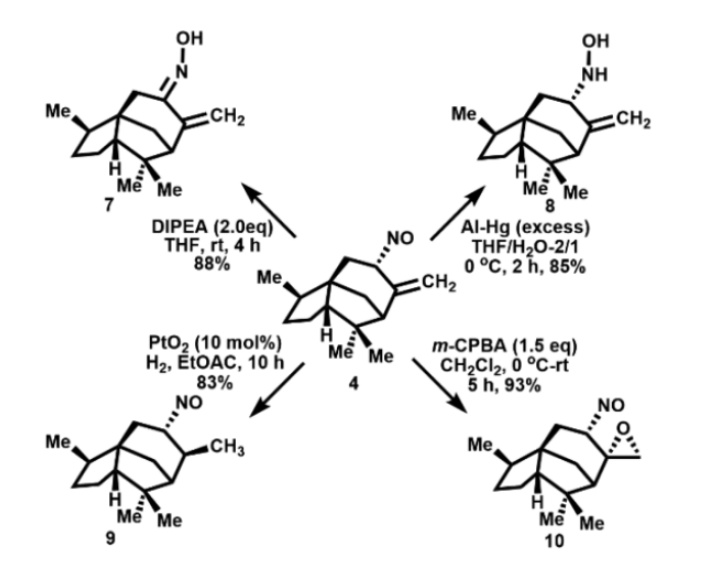
图3. 亚硝基雪松烯的衍生化(图片来源:Org. Lett.)
在-30 °C下,使用Tf2O和Bu4N+NO2-在CH2Cl2中以1:2的比例进行雪松烯的亚硝化时,与在相同反应条件下以1:1的比例观察到的过程完全不同(图4)。亚硝化产物是1,2-oxazete 11。11的结构和立体化学可通过1H和13C NMR、NOE、质谱和IR确定。其中,1,2-oxazete环的甲基与两个C-C键外的偕二甲基存在正的NOE相互作用,而1,2-oxazete 环的C=N双键在红外光谱1644 cm-1处产生强的吸收。这种烯烃的一步亚硝化形成 1,2-oxazete的方法在之前的合成工作中几乎没有报道过。
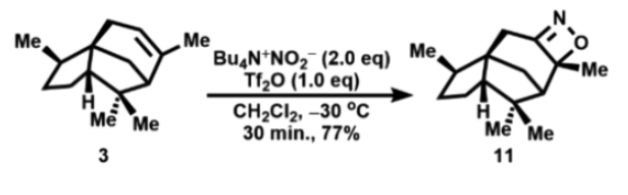
图4. 雪松烯一步转化成1,2-oxazete(图片来源:Org. Lett.)
在-30 °C的CH2Cl2中,雪松烯与1:1和2:1 Bu4N+NO2-/Tf2O亚硝化的不同结果表明,在后一种情况下,亚硝化试剂可能不是TfONO,而是亚硝酸酐O=N-O-N=O (12),由图5所示的序列形成。
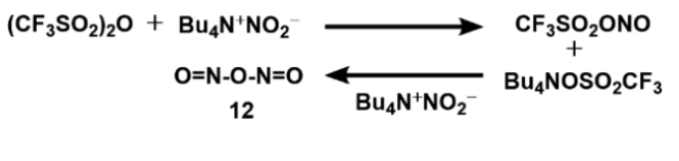
图5. 三氟甲磺酸亚硝基酯和亚硝酸酐的形成(图片来源:Org. Lett.)
这一设想进一步得到了实验的证实。首先,通过19F NMR谱跟踪Tf2O和Bu4N+NO2-(比例为1:2)在CH2Cl2中-30 °C下的反应。最初形成的三氟甲磺酸亚硝基酯在δ -71.65处有一个19F峰,同时在δ -78.24处有一个Bu4N+CF3SO3-的19F峰,但在 -30 °C约40分钟后,三氟甲磺酸亚硝基酯的峰消失,仅在δ -78.24处观察到一个由 Bu4N+CF3SO3引起的峰。亚硝酸酐也可通过以下方式制备:在-30 °C(无溶剂)下,将沉积在Celite 545上的过量Bu4N+NO2-(6 eq.)与(CF3SO2)2O(1 eq.)一起搅拌,然后将混合物置于高真空下,将挥发物蒸馏到接收器中冷却至-78 °C。这样就得到了淡黄色液体亚硝酸酐(12),它在-30 °C下至少可以稳定30分钟。红外光谱在1262 cm-1处有一个N=O双键吸收峰。液体在-10 °C开始沸腾。在0 °C或更高温度下,这种液体迅速分解为棕色NO2和(可能)NO。将雪松烯添加到制备的亚硝酸酐中反应时,以75%的分离产率得到1,2-oxazete 11。另外,亚硝酸酐与N,N-二甲基苯胺反应可以得到对亚硝基-N,N-二甲基苯胺。亚硝酸酐(12)的分离鉴定为进一步的研究应用奠定了基础。作者还通过等摩尔量的三氟甲磺酸酐和Bu4NONO在CH2Cl2中0 °C下反应,然后蒸发CH2Cl2并在真空下蒸馏得到纯三氟甲磺酸亚硝基酯。三氟甲磺酸亚硝基酯也是一种淡黄色液体,在室温条件下可稳定几小时;19F NMR:δ -72.04;13C NMR:δ -116.9 (q, J = 323.1);红外:1457、1230、1124 cm-1处存在特征峰。
大量实验表明,原位生成的三氟甲磺酸亚硝基酯和分离的试剂与一系列底物反应,在产物形成和产率方面没有区别。原位生成和分离的亚硝酸酐也是如此。
由1:1和1:2 Tf2O和Bu4N+NO2-原位生成的试剂与雪松烯(3)反应得到完全不同的产物,这一惊人发现需要合理的机制解释,作者推测以下反应途径: 3在TfONO条件下亚硝化得到离子对(13),然后甲基失去质子得到4(图6)。
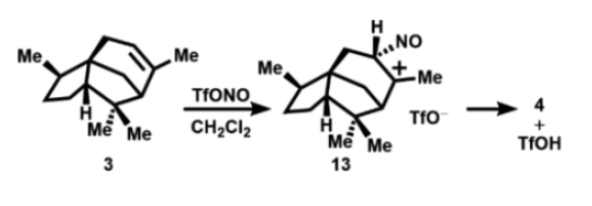
图6. 雪松烯的烯丙位亚硝基化形成4(图片来源:Org. Lett.)
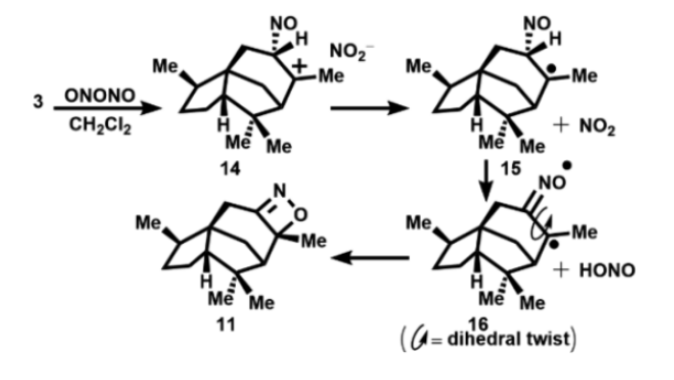
图7. 雪松烯形成1,2-oxazete的可能机制(图片来源:Org. Lett.)
作为进一步的假设,作者认为图7中所示的途径为从雪松烯(3)形成1,2-oxazete 11的合理机制。可能的第一步是3发生亚硝化,得到马氏选择性中间体14,随后发生电子转移,形成叔自由基15和稳定的NO2。氢原子从15转移到NO2产生副产物亚硝酸以及双自由基16,后者可以直接环化得到1,2-oxazete 11。15也可能环化为四元环N自由基,然后失去一个H原子形成11。
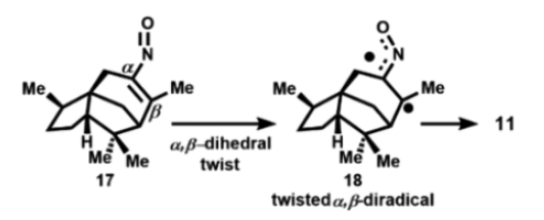
图8. 从雪松烯形成11的亚硝基/烯-双自由基途径(图片来源:Org. Lett.)
图8概述了涉及乙烯基亚硝基中间体(17)形成1,2-oxazete的另一种可能的机制。由于17的双键二面体的扭曲可以产生稳定的双自由基(18),然后可以环化形成1,2-oxazete 11。这种可能性似乎不太可能,因为唯一报道的由乙烯基亚硝基化合物形成1,2-oxazete的实例是19到20的热转化(图9),需在220 °C高温下,远高于从亚硝酸酐形成1,2-oxazete的反应温度(-30 °C)。
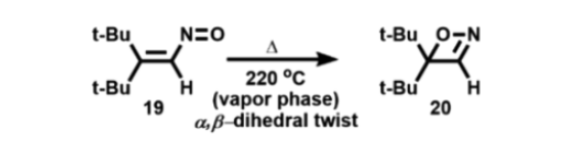
图9. 亚硝基烯19高温下形成1,2-oxazete(图片来源:Org. Lett.)
如图10所示,三取代烯烃的底物也能够兼容反应。这些稳定的油状产物的结构可以通过IR (1640-1650 cm-1处强C=N拉伸)、NMR和HRMS数据确证。
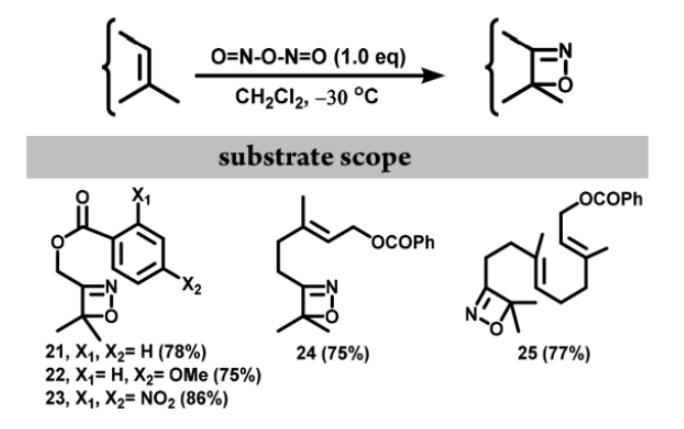
图10. 三取代烯烃直接转化为1,2-oxazetes(图片来源:Org. Lett.)
另外,一些三取代烯烃也能与TfONO反应生成烯丙基亚硝基化合物,如图11所示。化合物31用二异丙基乙胺处理产生2-苯基-2-环己烯酮肟,与由2-苯基环己烯酮和H2NOH制备的产物相同。
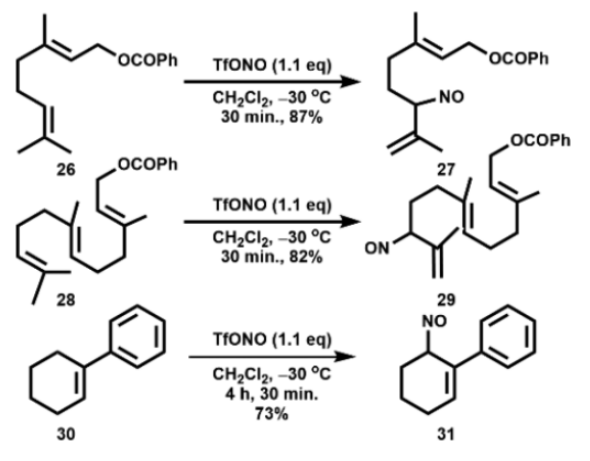
图11. 用原位制备的TfONO形成烯丙基亚硝化产物的底物扩展(图片来源:Org. Lett.)
TfONO还可将一系列烯烃底物转化为α,β-不饱和亚硝化产物,通常得到亚硝基二聚体,即R-ON=NO-R类型的偶氮二氧化物。这些产物可用于进一步转化。当在23 °C下用Zn-aq HCl处理33时,33会发生还原/水解,形成2-苯基丙醛(图12)。
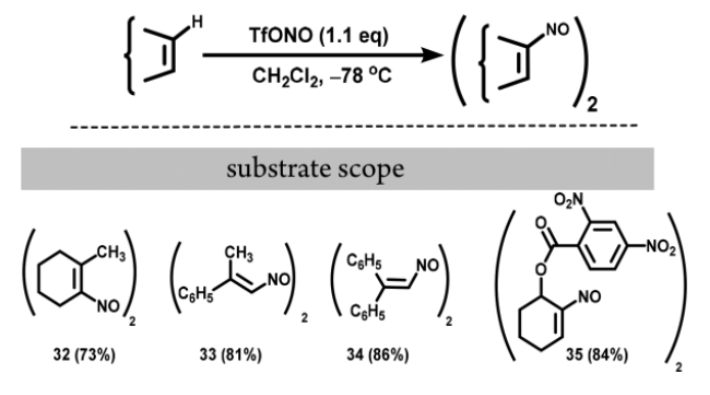
图12. 从烯烃得到烯基亚硝基二聚体(图片来源:Org. Lett.)
值得注意的是,TfONO与三种苯甲酸异戊烯基酯衍生物36、38和40在 CH2Cl2,-78 °C下的反应可以形成深蓝色单体烯丙基亚硝基化合物37、39和41(图13)。
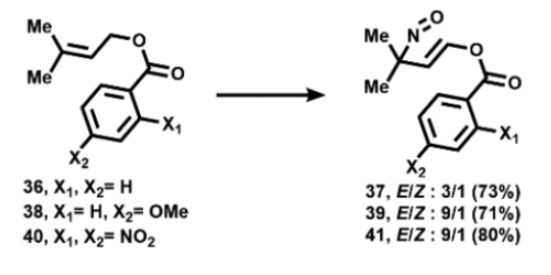
图13. 苯甲酸异戊烯基酯衍生物的反马氏亚硝化(图片来源:Org. Lett.)
如图14所示,由于苯甲酸酯邻位的相互作用促进了该试剂的亚硝化反应过程。
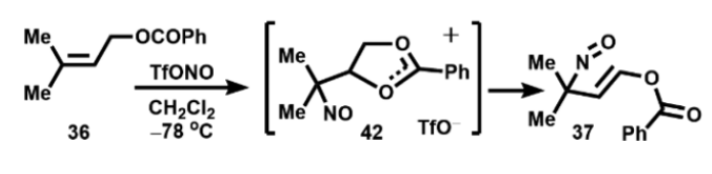
图14. 邻基效应加速亚硝化过程(图片来源:Org. Lett.)
当化合物37在室温、Pd-C催化剂和H2(1 atm)条件下下反应时,可以发生重排反应以70%的收率得到1,2-oxazete 21。没有H2时,该反应不能进行,而当使用D2时,该产物含有一个氘原子,位于酯基的α-位(图15)。
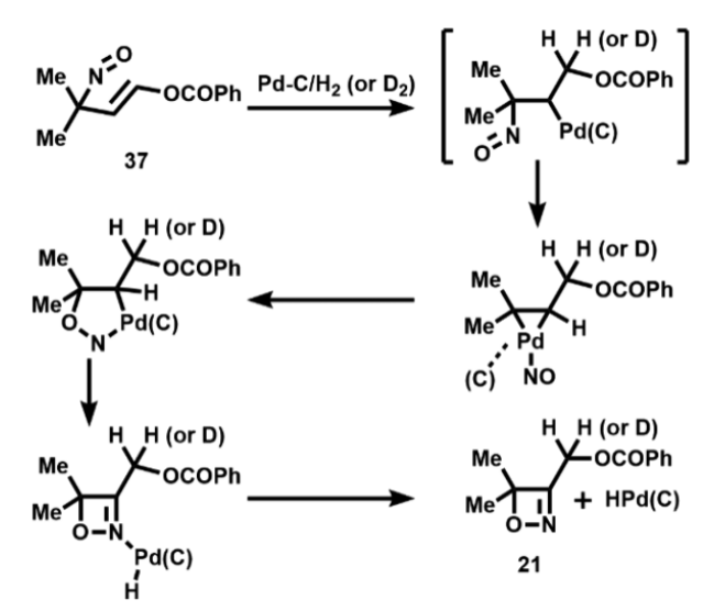
图15. Pd-C催化的oxazete形成机理(图片来源:Org. Lett.)
作者还研究了更复杂分子的亚硝化反应。尽管β-香树脂醇苯甲酸酯43中C-12位存在空间位阻,在该反应条件下也能够进行亚硝化得到44。在相同反应条件下胆固醇苯甲酸酯45的亚硝化形成加成/重排产物46(图16),该结果与先前报道的使用TfONO2的硝化反应相似。44用m-CPBA氧化可以形成12-硝基-β-香树脂醇苯甲酸酯47,其结构通过单晶确证。
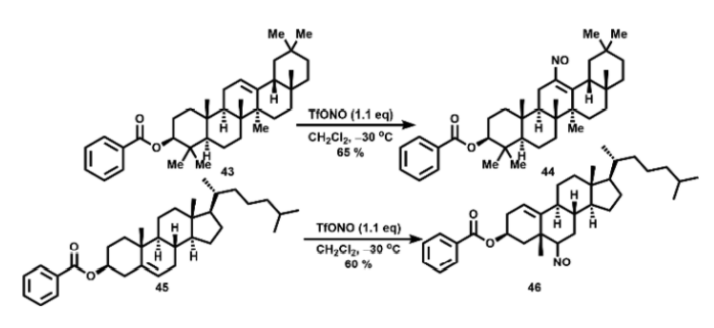
图16. 复杂底物的亚硝化(图片来源:Org. Lett.)
TfONO也能够实现不同取代芳环底物的亚硝化反应,不同供吸电子基均能够兼容反应的进行,但对于强吸电子基如:五氟苯和1,3-二硝基苯,反应不能发生。
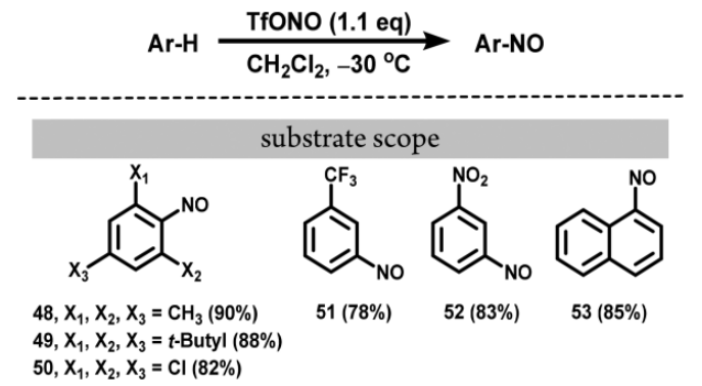
图17. 芳香底物的直接亚硝化(图片来源:Org. Lett.)
总结:Corey先生这篇论文报道了:(1)一种简单方便的方法来生成有用的亚硝化试剂三氟甲磺酸亚硝基酯和亚硝酸酐;(2)这些试剂的分离和表征;(3)它们与烯烃底物的反应途径截然不同;(4)一种从烯烃直接合成1,2-oxazetes的新方法;(5)一种新型Pd-C/H2催化的烯丙基亚硝基化合物向1,2-oxazetes的转化以及(6)一种缺电子芳族底物在TfONO下的有效直接亚硝化。Corey教授课题组发展了一例新型高效的亚硝化试剂,该试剂制备简单,底物兼容性好。同时,作者针对不同底物亚硝化的反应过程进行了细致的研究,并提出了合理的机制。另外,从该份工作中体现出的Corey先生孜孜不倦的科研精神以及严谨细致的科研态度值得我们去尊敬和学习。
参考资料:https://mp.weixin.qq.com/s/sm_FP8iHuEh7KurXRHX0NQ
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn