

羟胺尤其是手性羟胺及其衍生物在生物的生理活动中扮演着非常重要的角色,是一些药物以及其它生物活性化合物的重要构筑单元(图1a)。然而,手性羟胺由于合成极其困难而报道极少。因此,这类化合物的合成一直受到科学家们的广泛关注。一直以来,过渡金属催化的不对称氢化反应由于其原子经济性高和催化效果优异而被广泛应用于各种手性分子的合成中,解决了绝大部分种类的含有不饱和键底物的高效氢化转化。然而,通过肟(C=N-OH)的不对称催化氢化制备手性羟胺(C-N-OH)一直是不对称氢化反应中悬而未决的挑战。究其原因主要有两点:1)肟分子的C=N双键反应活性较低,过渡金属催化剂较难实现这类双键的氢化还原;2)肟和羟胺分子中的氮氧原子上的孤对电子之间存在较强的排斥作用,使得它们的N-O键容易发生断裂,进而导致在氢化反应中直接生成手性胺类化合物。目前报道的一些过渡金属催化肟的不对称氢化反应大多如此(图1b)。到目前为止也只有两例以相对稳定的肟醚为底物进行氢化还原生成非手性和手性羟胺醚产物的报道(Angew. Chem. Int. Ed. 2014, 53, 13278;Science 2020, 368, 1098)。
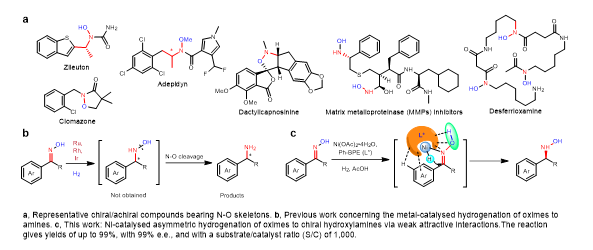
图1含有N−O骨架代表性化合物以及肟的氢化
上海交通大学化学化工学院张万斌教授课题组一直致力于过渡金属催化的不对称氢化研究,开发了以稀有金属铑、钌、铱、钯和丰产金属镍、钴为催化剂的不对称氢化反应(部分代表工作,稀有金属:Angew. Chem. Int. Ed. 2013, 52, 2203; Angew. Chem. Int. Ed. 2014, 53, 1901; Angew. Chem. Int. Ed. 2015, 54, 2260-2264; Nat. Commun. 2018, 9, 5000; Angew. Chem. Int. Ed. 2019, 58, 11505; Angew. Chem. Int. Ed. 2021, 60, 23602;丰产金属:Angew. Chem. Int. Ed. 2019, 58, 7329; Angew. Chem. Int. Ed. 2019, 58, 15767; Angew. Chem. Int. Ed. 2020, 59, 5371; Nat. Commun. 2020, 11, 5935; Angew. Chem. Int. Ed. 2021, 60, 16989)。近来,他们首先在稀有金属催化不对称氢化反应中,发现催化剂与底物之间会形成一些不同于共价作用的π/HC…π/HC弱相互作用(Pd: Angew. Chem. Int. Ed. 2013, 52, 11632; Angew. Chem. Int. Ed. 2016, 55, 8444; Nat. Commun. 2018, 9, 5000; iScience 2020, 23, 100960; Rh: Angew. Chem. Int. Ed. 2019, 58, 11505; ACS Catal. 2020, 10, 3232),这些弱相互作用在不对称催化氢化反应中起到类似于其在生物体内的酶催化反应中的作用,可以有效降低催化反应的活化能并减少副反应的发生。尤其是基于这些弱相互作用,他们成功地实现了多例具有挑战性的丰产金属Ni和Co催化的高效不对称氢化反应(Ni: Angew. Chem. Int. Ed. 2019, 58, 7329; Angew. Chem. Int. Ed. 2020, 59, 5371-5375; Nat. Commun. 2020, 11, 5935; Co: Angew. Chem. Int. Ed. 2019, 58,15767),使得相关丰产金属催化不对称氢化反应具有了工业化应用的可能。基于此,他们设计了一种镍催化肟的不对称氢化反应,期望利用上述弱相互作用来降低肟的氢化反应能垒,同时利用这种作用来稳定肟分子的氮氧键,从而实现手性羟胺的不对称合成(图1c)。
首先,作者以化合物(E)-苯甲酮肟为模板底物,进行了不同条件的测试。在对不同配体进行考察时发现,当使用富含π电子体系的(S,S)-Ph-BPE时,反应可以取得97%的转化率和93%的对映选择性,而不含π电子体系的(R,R)-iPr-BPE仅能取得9%的转化率。当溶剂中不加乙酸时,反应以当量的方式进行,说明酸有助于催化剂与产物的解离。此外,作者还考察了乙酸的当量对反应的影响(图2)。
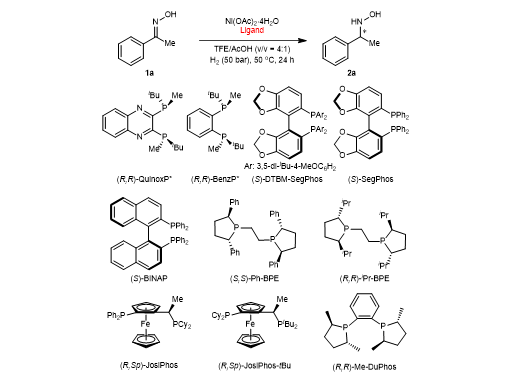
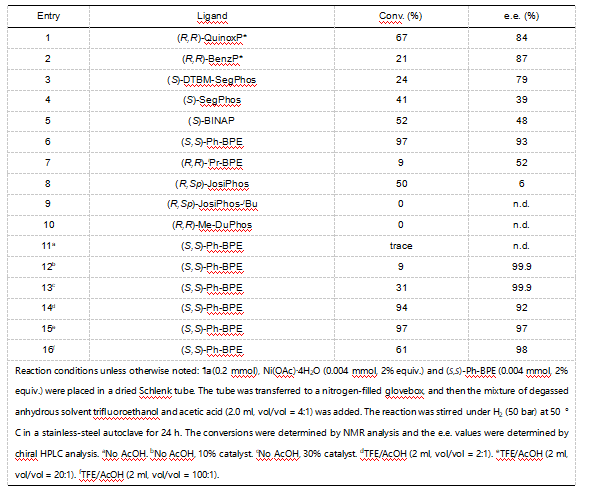
图2部分条件优化
接下来,作者对该反应的底物范围进行了考察(图3)。结果表明,无论是芳基上取代基位置变化,还是取代基的给电子和吸电子类型变化,甚至是取代基数目变化,所有这些底物均能给出优秀的对映选择性(2a-v)。同时,改变芳基为萘基,或者改变甲基为其他烷基,以及双烷基取代的底物也能保持高对映选择性(2w-ab)。值得注意的是,对于含有Z/E-构型混合的底物,该反应也能给出良好的结果(2a, 2ac-ae)。随后,作者进一步考察了肟醚类底物的适应性,其反应也表现优秀(2af-aw)。
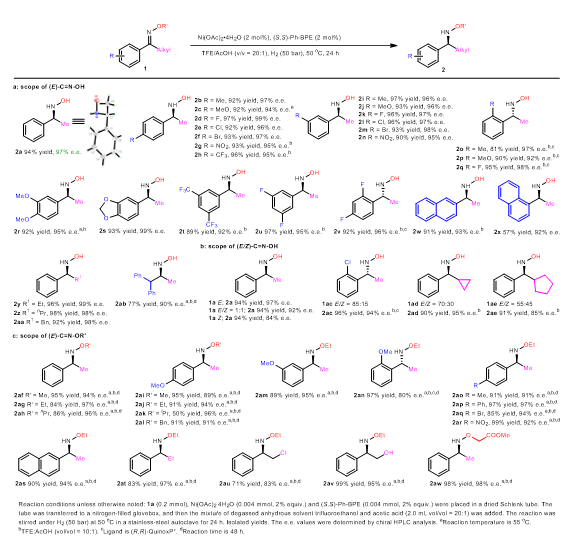
图3底物范围
此外,令人高兴的是,肟醚类底物1av在优化的条件下可以实现转化数(S/C)为1000的克级规模反应。最后,作者对得到的部分手性羟胺化合物进行了衍生化,如:所得产物2av可以用来合成环磺酰胺或者环磷酰胺类化合物(图4)。
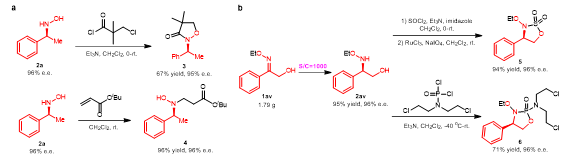
图4催化效率及应用研究
作者又通过DFT计算对反应机理进行了探索。考虑到底物在反应中存在Z/E构型互变现象,作者首先计算了Z-1a和E-1a两种构型分别与催化剂接近过程中的四种途径的能量变化。结果表明E-1a的两个途径的能量要明显低于Z-1a的(图5a)。这个结论也可以从分析两种构型的结构中初步得出,在E-1a中,其苯环可以与催化剂之间形成π相互作用而降低能量,而在Z-1a中,由于苯环与羟基发生分子内OH…π作用导致其不能参与“催化剂-底物”分子间的π相互作用(图5b)。
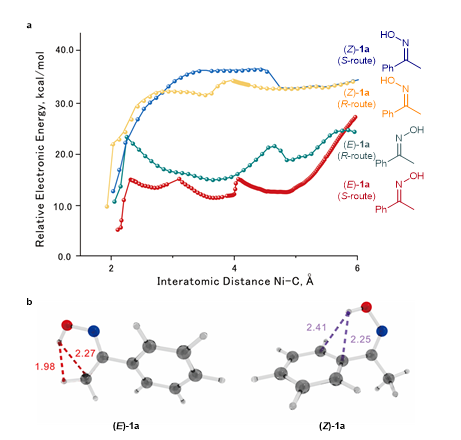
图5四种途径的能量变化
为了探索该反应的整个催化循环过程,尤其是氢转移过程中的对映选择性,作者进一步计算了E-1a的两个途径中的中间体能量变化(图6)。反应从镍氢物种7开始,通过分子间的π相互作用形成中间体8,然后经过过渡态TS1形成氢转移中间体9,随后结合一分子氢气形成10,并在催化剂作用下经过TS2异裂H-H键形成中间体11。中间体11并不能直接解离出产物和催化剂,而是在结合一分子乙酸形成中间体12,然后断裂Ni-N键形成中间体13,并进一步解离出产物和镍氢物种完成整个循环过程。可以看出,在过渡态TS1和TS2中,催化剂与底物之间形成了以CH‧‧‧HC和CH‧‧‧π为主的许多弱相互作用,其中在TS1(S)中,催化剂与底物之间产生的弱相互作用的数量要明显多于TS1(R),这使得他们之间的能量差值达到6.3 kcal/mol,足以说明反应更倾向于S路径。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn