

(图片来源:Angew. Chem. Int. Ed.)
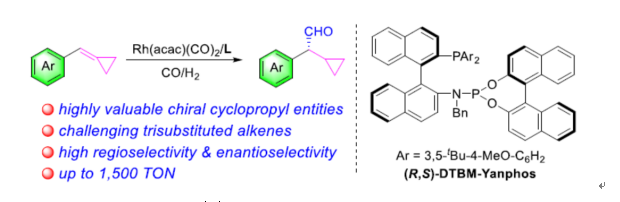
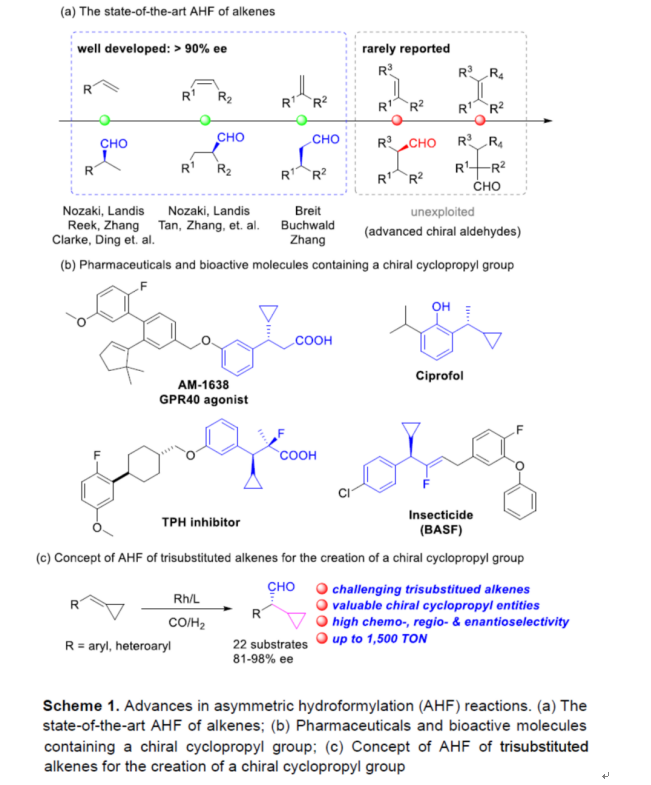
过渡金属催化不对称氢甲酰化(AHF)反应是一种清洁且100%原子经济性构建手性醛分子的方法。迄今为止,化学家们已对单取代、1,2-和1,1-二取代烯烃的不对称氢甲酰化反应,进行了大量的研究(Scheme 1a)。1993年,Takaya和Nozaki课题组报道了第一个具有里程碑意义的手性配体Binaphos,随后也开发了一系列用于AHF反应的手性配体,如双氮杂膦、Ph-BPE、Yanphos、Bobphos、Bettiphos、BenzP以及其他膦配体。然而,由于固有的低反应性以及难以实现对映选择性的控制,从而导致三取代烯烃的AHF仍有待进一步的开发。同时,在三取代烯烃AHF反应中,除了专一性策略以外,反应均生成外消旋的醛化合物。因此,开发一种高效的三取代烯烃AHF反应有重要意义。
含有环丙基单元的手性碳广泛存在于各类药物和生物活性分子,如GRP40激动剂、色氨酸羟化酶(TPH)抑制剂、全身麻醉剂环泊酚和手性杀虫剂(Scheme 1b)。然而,对于此类手性分子的构建通常采用低原子经济性的手性拆分方法,从而导致一定的损失。近年来,化学家们也开发出了多种不对称催化AHF策略,如协同光氧化还原和铜催化、不对称还原、对映选择性重排和1,4-加成反应等,但存在对映选择性差和催化剂负载量高等弊端。
近日,南方科技大学张绪穆团队报道了铑-二膦催化环丙基官能团化三取代烯烃的高度化学、区域和对映选择性氢甲酰化反应,从而合成了一系列含有环丙基取代的手性醛衍生物(Scheme 1c)。其中,使用一种改良的新型Yanphos配体,具有广泛的底物范围以及优异的选择性。
(图片来源:Angew. Chem. Int. Ed.)
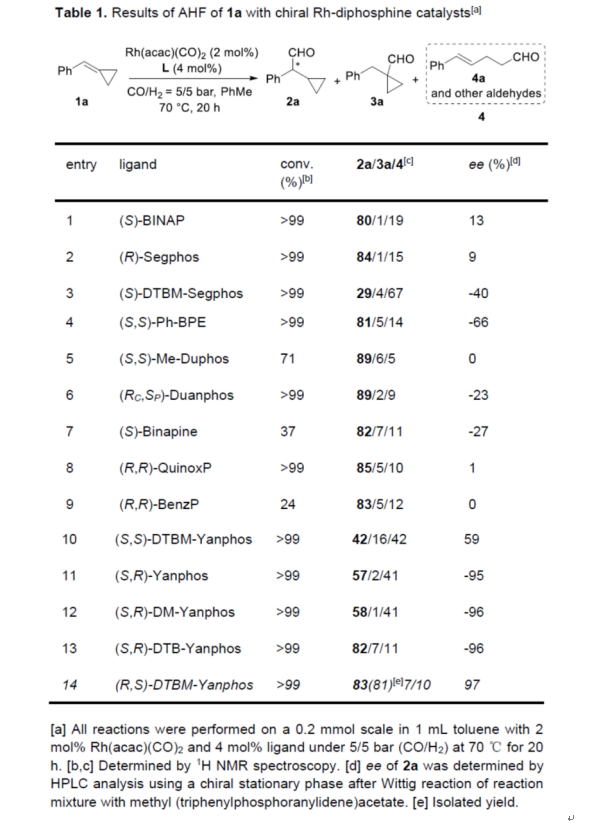
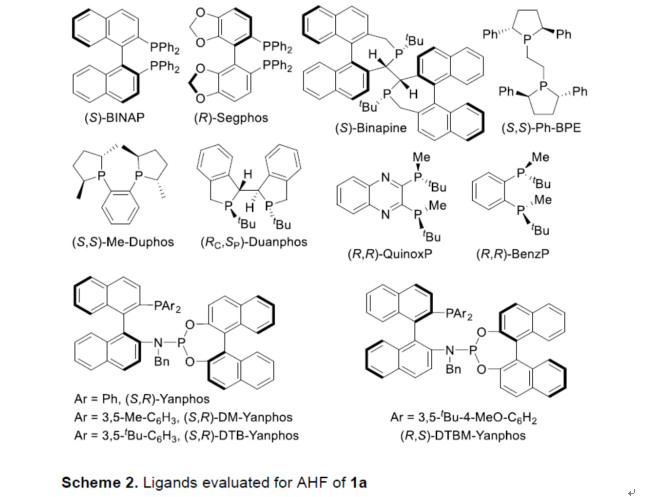
首先,作者以简单的三取代烯烃1a作为模型底物,进行了相关不对称氢甲酰化反应条件的筛选(Table 1)。当以Rh(acac)(CO)2作为催化剂, (R,S)-DTBM-Yanphos作为配体,在CO/H2(5/5 bar)的氛围中于甲苯溶剂中70 oC下反应20 h,可以83%的收率得到产物2a,ee为97%。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
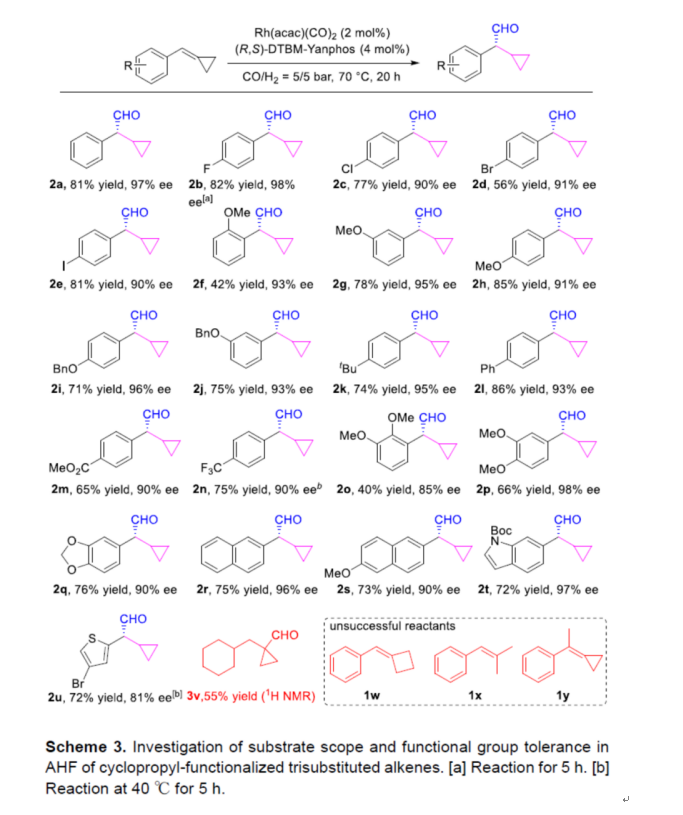
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 3)。首先,当底物1中的芳基上含有不同电性的取代基时,均可顺利反应,获得相应的产物2a-2q,收率为40-86%,ee为85-97%。其中,由于空间位阻,导致芳基邻位含有取代基的底物收率偏低,如2f与2o。值得注意的是,对于含有吸电子基(2b,2n)的底物,需更短的反应时间才能确保反应具有优异的对映选择性和令人满意的收率。因此,在工艺优化过程中应考虑醛产物的外消旋化问题,其中可使用流体化学来解决上述问题。其次,含有萘基和吲哚基取代的底物,也与体系兼容,获得相应的产物2r-2t,收率为72-75%,ee为90-97%。含有噻吩基取代的底物,需在相对较低的反应温度下才能获得具有良好对映选择性的产物2u。然而,环己基烷基化底物(1v)、环丁基和无环三取代烯烃(1w,1x)以及环丙基官能化四取代烯烃(1y),未能顺利进行反应。
(图片来源:Angew. Chem. Int. Ed.)
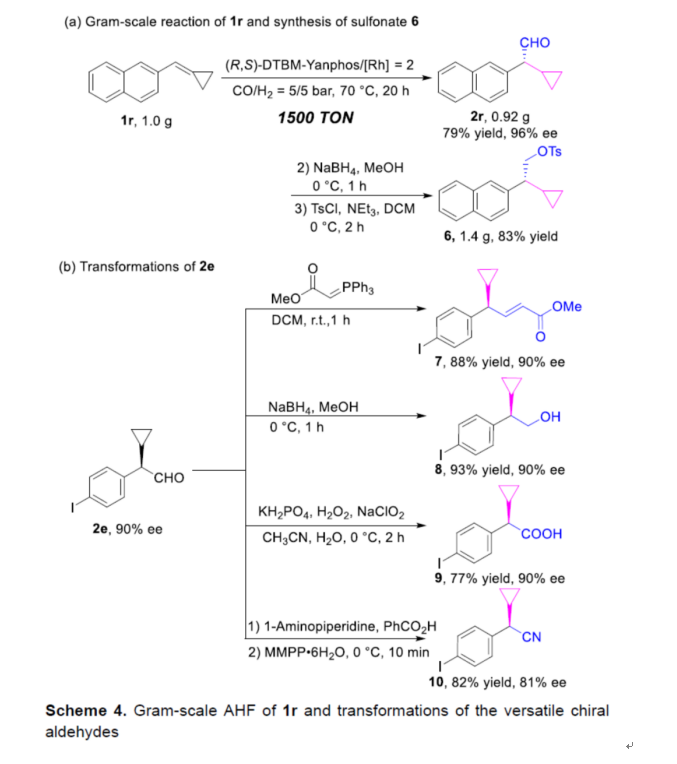
紧接着,作者对反应的实用性进行了研究(Scheme 4)。首先,1r的克级规模实验,同样能够以79%收率和96%ee得到手性醛产物2r,且TON为1500。2r经还原与Ts保护后,可获得高收率的手性磺酸酯6。其次,含有碘官能团的手性醛产物2e,经Wittig反应可生成α,β-不饱和手性环丙基化合物7,且对映选择性不会损失。2e经还原,可生成手性醇8,收率为93%,ee为90%。2e经氧化,可生成手性羧酸9,收率为77%,ee为90%。此外,通过一锅氢甲酰化/缩合/aza-Cope消除过程,可获得手性氰化合物10,收率为82%,ee为81%。
(图片来源:Angew. Chem. Int. Ed.)
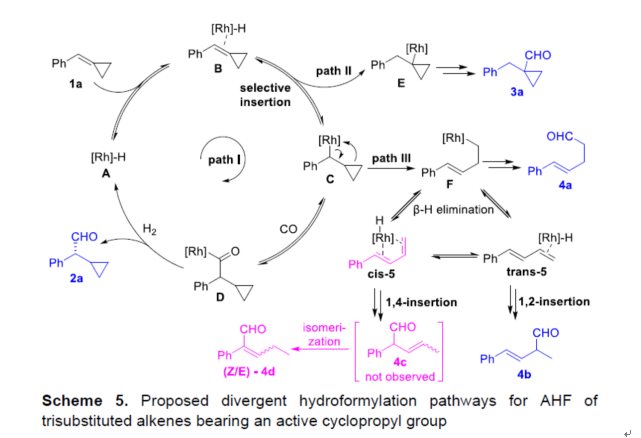
基于相关文献的查阅,作者提出了一种合理的催化循环过程(Scheme 5)。首先,底物1a与A配位生成中间体B,经选择性插入生成中间体C或E(path II,这是生成3a的竞争性途径)。中间体C经氢甲酰化反应(path I),可生成手性醛产物2a,并再生催化剂A。同时,在path III中存在竞争性的副反应,即中间体C经开环氢甲酰化反应,生成开环氢甲酰化醛化合物4a。其中,中间体F还可能进行β-H消除,生成trans-5或cis-5(可在催化条件下相互转化)。trans-5经1,2-插入过程,生成化合物4b。cis-5经1,4-插入与异构化过程,生成化合物(Z/E)-4d。因此,trans-5和cis-5之间很可能发生快速的异构化过程。
(图片来源:Angew. Chem. Int. Ed.)
总结:南方科技大学张绪穆团队报道了铑催化环丙基官能团化三取代烯烃的高度化学、区域和对映选择性氢甲酰化反应,从而合成了一系列含有环丙基取代的手性醛衍生物。其中,使用改良的Yanphos配体,命名为(R,S)-DTBM-Yanphos,可使反应具有出色的对映选择性。此外,通过克级规模实验和产物后期的衍生化实验,进一步证明了反应的实用性。机理研究表明,该发散性氢甲酰化反应可能涉及独特的开环氢甲酰化过程。
Li, S., Zhang, D., Zhang, R., Bai, S. and Zhang, X. (2022), Chemo-, Regio- and Enantioselective Hydroformylation of Cyclopropyl-Functionalized Trisubstituted Alkenes. Angew. Chem. Int. Ed.. https://doi.org/10.1002/anie.202206577
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn