

癌症是人类健康的巨大威胁,由于癌细胞具有高度侵袭性,癌细胞转移是癌症患者死亡的主要诱因。因此,转移抑制是许多癌症相关疗法的主要关注点。随着超分子纳米组装的发展,原位自组装纳米纤维在癌细胞中表现出长期保留特性并显著抑制其转移行为。因此,通过合理设计外源性或内源性刺激反应的肽偶联物,将其用于原位构建纳米纤维以全面抑制肿瘤转移是可行的。
此外,对于癌症转移形成的远端肿瘤的抑制在临床癌症治疗中也很重要。近年来,通过化学疗法和免疫疗法的结合,化学免疫疗法被广泛用于来提高癌症治疗效率、逆转耐药性并最大限度地减少副作用。值得注意的是,越来越多的证据表明,化疗药物诱导的癌细胞凋亡/坏死可有效激活免疫系统以产生与肿瘤相关的新抗原。具体而言,化疗诱导的癌细胞免疫原性细胞死亡(ICD)促进了抗原从细胞中的释放。然后,释放的抗原被成熟树突状细胞(DC)吸收,并随后激活细胞毒性T淋巴细胞(CTL)以杀死癌细胞。不过,这种化疗后的免疫反应在抑制肿瘤转移方面不够理想。因此,癌症免疫治疗(即免疫检查点阻断)与自噬抑制增强化疗的组合对肿瘤生长、转移和侵袭具有显著的抑制作用。基于此,梁高林课题组设计了一种具有纳米刷-纳米粒子-纳米纤维转变特性的“三叉戟”前药分子Nap−CPT−HCQ−Yp,通过细胞内纳米纤维的形成抑制原发性肿瘤转移,并通过化学免疫疗法抑制远端肿瘤的生长,从而在空间上抑制肿瘤转移。
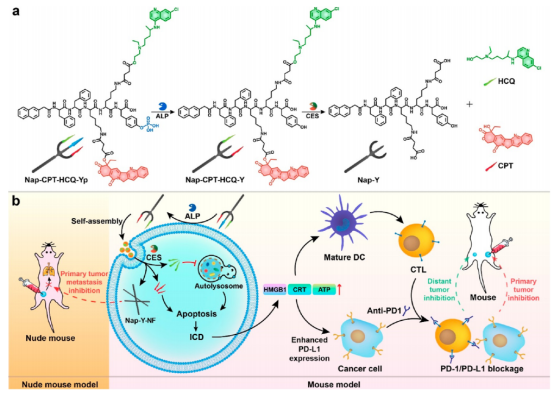
图 1. 三叉戟前药分子结构及作用示意图(图片来源:J. Am. Chem. Soc.)
三叉戟前药分子Nap−CPT−HCQ−Yp自组装肽骨架中包含三个功能性“矛”:(1)磷酸酪氨酸基团,作为碱性磷酸酶(ALP)催化的底物;(2)喜树碱(CPT,一种化疗药物);(3)羟氯喹(HCQ,一种自噬抑制剂)。其中,CPT和HCQ通过细胞内羧酸酯酶(CES)可催化裂解的酯键与肽支架结合。Nap-CPT-HCQ-Yp在浓度高于6.3 μM时形成纳米刷结构。在癌细胞膜上与ALP作用去磷酸化后,Nap-CPT-HCQ-Yp首先转化为Nap-CPT-HCQ-Y,纳米刷转变为纳米粒子。癌细胞内吞后,Nap-CPT-HCQ-Y在细胞质中进行CES水解,纳米粒子进一步转化为纳米纤维Nap-Y-NF,同时伴随着CPT和HCQ的释放。首先,Nap-Y-NF纳米纤维的细胞内形成抑制了癌细胞的迁移和侵袭能力。其次,释放的HCQ通过抑制癌细胞的自噬来抑制癌细胞的自我保护过程,使它们对CPT的化学治疗作用更加敏感。此外,自噬抑制增强化疗诱导癌细胞凋亡/坏死,并伴有片段产生。这些片段随后诱导癌细胞的ICD,促进抗原从细胞中释放。然后,释放的抗原被成熟的树突状细胞(DCs)吸收和呈递,导致CTL激活以杀死癌细胞。然而,化疗诱导的ICD提高了癌细胞上PD-L1的表达。PD-L1与CTL上的PD-1结合,降低了CTL的杀伤能力。为了解决这个问题,作者用检查点阻断疗法补充了上述策略,以引发全身免疫反应,从而有效抑制原发性肿瘤和远端肿瘤(图1)。
首先,作者通过HPLC分析证明了Nap−CPT−HCQ−Yp具有良好的稳定性以及验证了三叉戟前药对ALP和CES的双重响应性,并且利用TEM表征验证了前药分子在酶触发下的纳米刷-纳米粒子-纳米纤维转变。在10 μM的浓度下,Nap-CPT-HCQ-Yp最初自组装成不均匀的纳米刷构型,经ALP去磷酸化24 h后,纳米刷进一步转化为平均直径为86.8±29.4 nm的 Nap-CPT-HCQ-Y纳米粒子,之后通过CES水解24 h后,形成的纳米粒子最终转化为平均宽度为14.2±3.9 nm的Nap-Y-NF纳米纤维。此外,作者还在体外研究了Nap-CPT-HCQ-Yp的酶促凝胶特性(图2)。
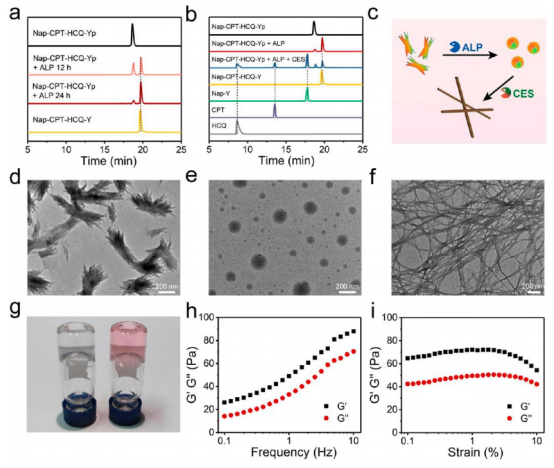
图 2. 酶处理前后三叉戟前药分子的表征(图片来源:J. Am. Chem. Soc.)
接着,作者在过表达ALP和CSE的4T1细胞中对酶促纳米结构转变的概念进行了验证(图3)。Nap-CPT-HCQ-Yp可以有效地进入细胞,并最初主要位于溶酶体中,后续会发生溶酶体逃逸行为。通过Bio-TEM观察到前药分子处理前后4T1细胞中的溶酶体结构发生明显的异常,表明三叉戟分子形成的纳米纤维Nap-Y-NF可以破坏溶酶体结构,从而促进从溶酶体中逃逸。而且,实验证明Nap-CPT-HCQ-Yp的内化涉及ATP依赖性转运和小窝依赖性内吞作用。在与细胞孵育8 h时,在细胞质中发现了大量的纳米纤维,表明大部分Nap-CPT-HCQ-Yp已转化为Nap-Y并自发形成纳米纤维Nap-Y-NF。此外,作者还设计了划痕伤口愈合试验证明了纳米纤维的形成可以抑制癌细胞迁移。
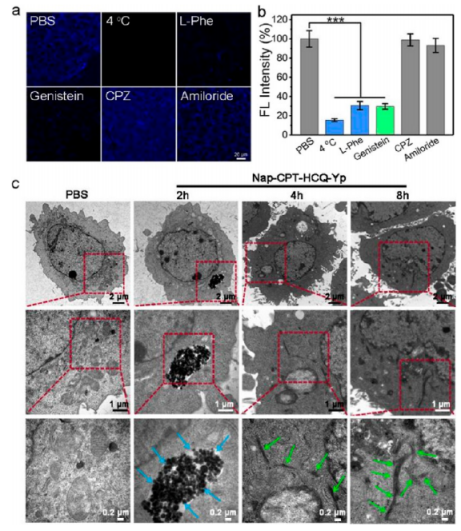
图 3. Nap-CPT-HCQ-Yp的细胞摄取、定位和细胞内纳米结构转变(图片来源:J. Am. Chem. Soc.)
接着,作者结合细胞毒性和蛋白质印迹分析试验验证了自噬抑制策略显著提高了三叉戟分子Nap-CPT-HCQ-Yp对癌细胞的化疗效果,甚至比两种游离药物CPT和HCQ的效果更好。然后,作者进一步探讨了Nap-CPT-HCQ-Yp处理的凋亡癌细胞是否可以触发它们的下游ICD,并通过酶联免疫吸附测定(ELISA)和流式细胞术研究了ICD相关生物标志物的水平,证实了Nap-CPT-HCQ-Yp的治疗可以触发癌细胞有效地产生ICD(图4)。
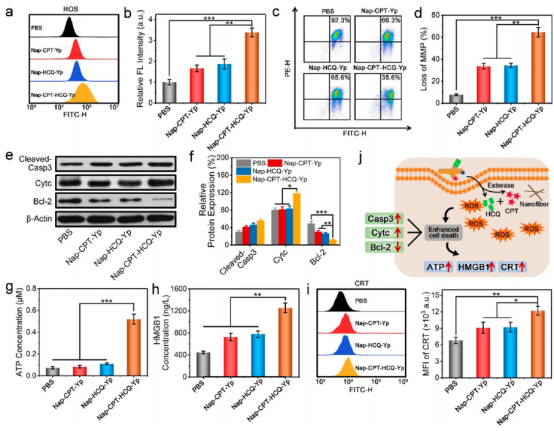
图 4. Nap-CPT-HCQ-Yp的细胞治疗机制和诱导的免疫原性细胞死亡(图片来源:J. Am. Chem. Soc.)
然后,作者评估了前药在体内抑制肿瘤转移的效果。与对照组相比,Nap−CPT−HCQ−Yp处理的小鼠肿瘤得到了明显的抑制,并且可以最显著地抑制肿瘤的肺转移。在治疗过程,Nap−CPT−HCQ−Yp还表现出优异的生物安全性。值得注意的是,由于Nap-CPT-HCQ-Yp注射略微提高了肿瘤PD-L1的表达,作者进一步评估了Nap-CPT-HCQ-Yp和免疫检查点阻断PD-1抗体对4T1荷瘤小鼠的协同化学免疫治疗功效。结果表明,“Nap-CPT-HCQ-Yp + aPD-1”的组合对原发性肿瘤的抑制效果最好。而且通过对包括CRT和HMGB1在内的相关生物标志物进行免疫荧光染色研究了体内ICD的产生,证实了通过组合“Nap-CPT-HCQ-Yp + aPD-1”治疗有效产生ICD。此外,作者还在该组合治疗的原发性肿瘤中观察到最大量的活化细胞毒性T细胞,表明组合策略最大限度地激活了原发性肿瘤的免疫反应。重要的是,Nap-CPT-HCQ-Yp和免疫检查点阻断PD-1抗体的组合还实现了对远端肿瘤生长的显著抑制(图5)。
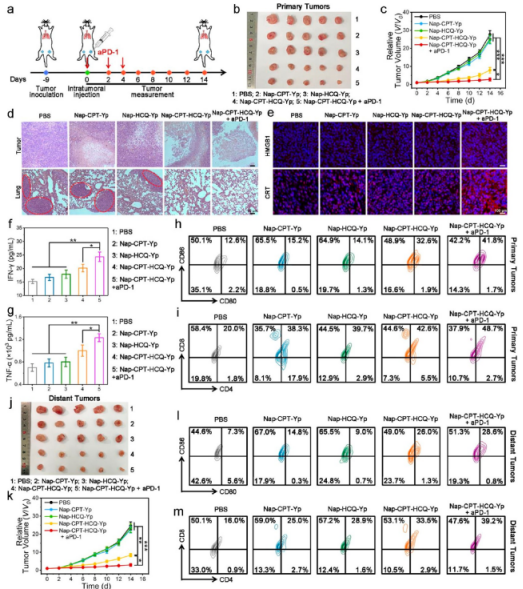
图 5. 体内自噬抑制增强化疗联合aPD-1抗体抑制原发性和远端肿瘤生长(图片来源:J. Am. Chem. Soc.)
总结:东南大学梁高林教授团队合理设计了一种具有纳米刷-纳米粒子-纳米纤维过渡特性的“三叉戟”分子Nap-CPT-HCQ-Yp,在碱性磷酸酶和羧酸酯酶连续作用下,Nap-CPT-HCQ-Yp经历纳米刷-纳米粒子-纳米纤维转变,并伴随着CPT和HCQ的释放。形成的细胞内纳米纤维有效抑制癌细胞的转移和侵袭行为。同时,释放的CPT和HCQ通过自噬抑制增强化疗协同诱导显著的治疗效果。此外,Nap-CPT-HCQ-Yp的化学疗法增强了免疫原性细胞死亡,导致毒性T细胞的活化。最后,检查点阻断疗法和Nap-CPT-HCQ-Yp介导的化学疗法相结合可引发全身抗肿瘤免疫,从而在乳腺癌肿瘤模型中实现对原发性肿瘤和远处肿瘤的有效抑制。该工作为设计“智能”多功能前药以空间抑制肿瘤转移提供了一种简单可行的策略。
文章详情:
Trident Molecule with Nanobrush–Nanoparticle–Nanofiber Transition Property Spatially Suppresses Tumor Metastasis
Ge Gao, Yao-Wen Jiang, Wenjun Zhan, Xiaoyang Liu, Runqun Tang, Xianbao Sun, Yu Deng, Lingling Xu, and Gaolin Liang*
https://doi.org/10.1021/jacs.2c05743

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn