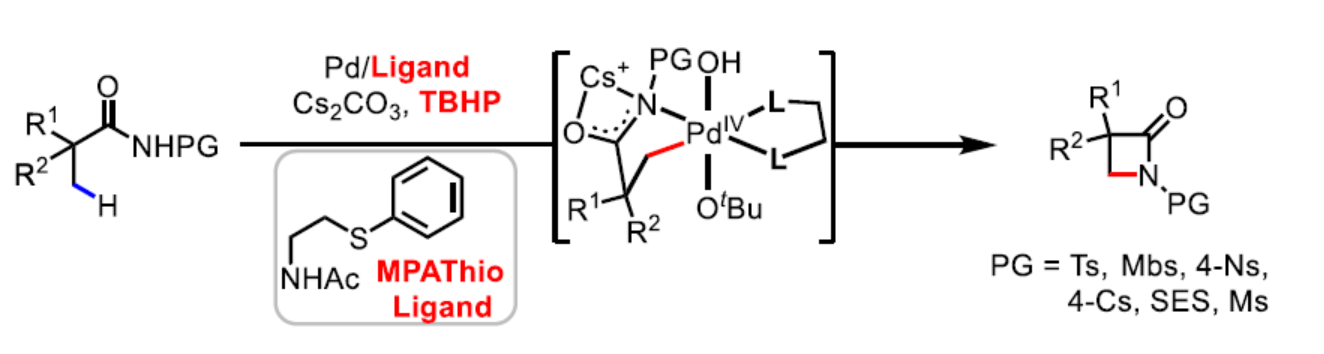
(图片来源:Angew. Chem. Int. Ed.)自1928年弗莱明(Fleming)发现青霉素以来,β-内酰胺骨架广泛存在于各类抗生素中。经典的β-内酰胺抗生素通常由双环组成,但单环β-内酰胺衍生物(称为monobactams)也表现出一定的生物学活性(Scheme 1A)。在合成β-内酰胺的方法中,酰胺β-C(sp3)-H键的内酰胺化反应是一种合成β-内酰胺的有效方法,其中使用廉价的脂肪族羧酸(Scheme 1B)。2013年,史炳锋课题组报道了脂肪族酰胺β-内酰胺化反应的第一个例子,其中使用双齿2-(吡啶基)异丙基(PIP)胺作为导向基团(DG)。随后,化学家们主要集中于各种DGS的设计以及第一排过渡金属催化剂的开发,涉及采用喹啉(吡啶)基-酰胺基的双齿DGS,以促进环金属化和随后的C-N还原消除过程。最近,有文献报道关于配体促进β-内酰胺化反应的策略,其中使用双齿DGs,但反应需使用银盐和苟刻条件(微波辐照或高达160 oC)。过去的二十年来,Pd(II)/Pd(IV)-催化碳-碳和碳-杂键的形成策略急剧发展。与Pd(II)-催化领域相比,Pd(IV)最多可与六个配体配位,从而使反应更为多样化。2020年,余金权课题组报道了首例游离羧酸β-C(sp3)-H键的内酰胺化反应,其中使用TBHP作为氧化剂和β-氨基酸作为配体,从而合成一系列高张力的β-内酰胺衍生物(Nature 2020, 577, 656.)。2021年,余金权课题组开发了2-羟基吡啶配体促进Pd(II)-催化氨基酸衍生天然酰胺γ-C(sp3)-H键的内酰胺化反应,其中使用TBHP作为终端氧化剂,但该配体对β-C-H键的内酰胺化却没有反应性(J. Am. Chem. Soc. 2021, 143, 21657.)。近日,余金权课题组报道了一种基于磺酰基保护基团(Ts、Mbs、Ns、Cs、SES和Ms)的脂肪族酰胺β-C(sp3)-H键的内酰胺化反应。其中,使用单保护的氨基乙硫醚配体对于反应至关重要(Scheme 1C)。与其它C-H键的活化策略相比,该策略具有反应条件温和、易于扩展、出色的选择性以及使用实用的氧化剂和保护基团等特点。通过后期衍生化实验,可获得一系列生物学上具有价值的化合物,如β-氨基酸,γ-氨基醇和氮杂环丁烷。
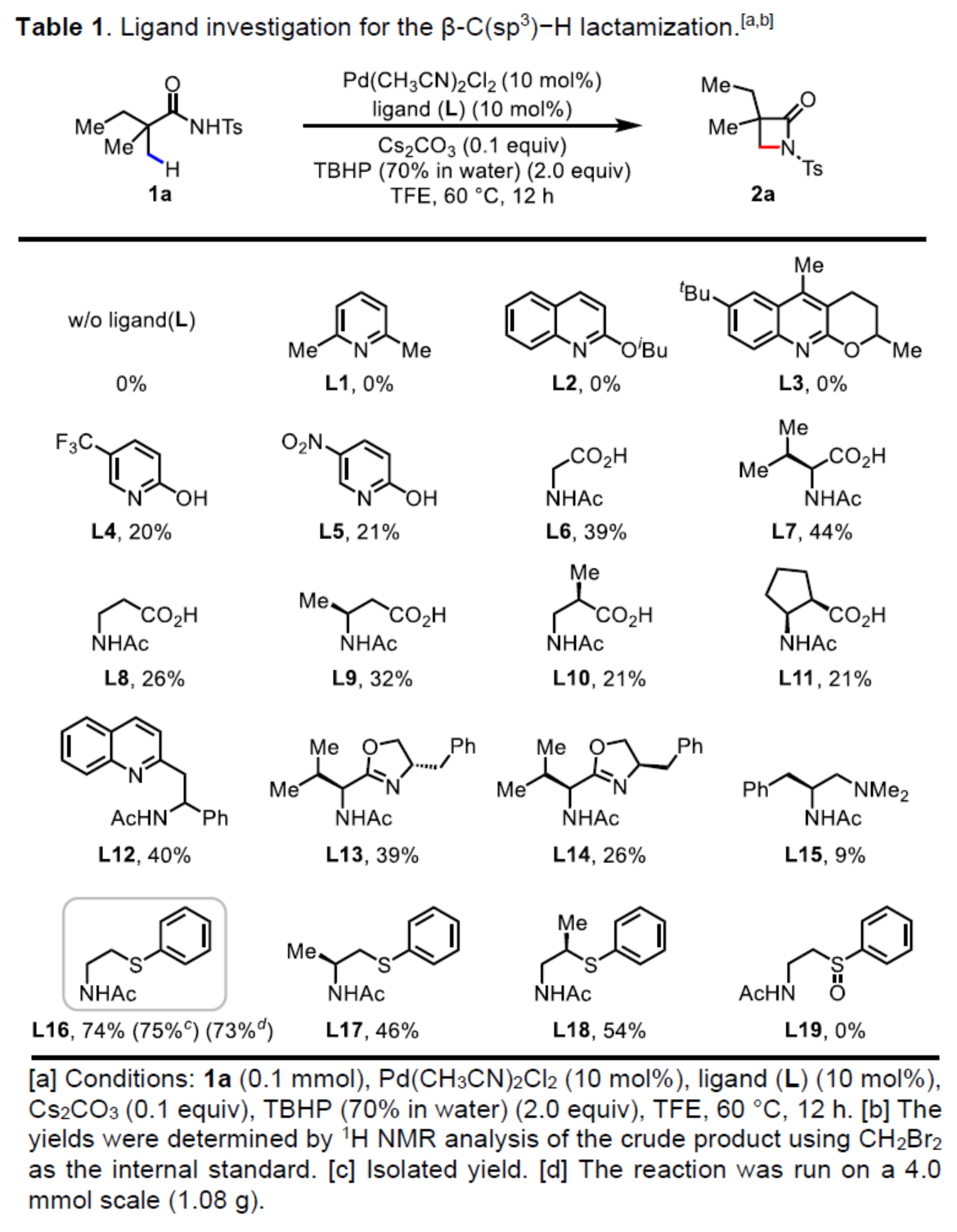
(图片来源:Angew. Chem. Int. Ed.)首先,作者以N-Ts保护的脂肪族酰胺1a作为模型底物,进行了相关β-C(sp3)-H键内酰胺化反应的配体筛选(Table 1)。当以Pd(CH3CN)2Cl2作为催化剂,L16作为配体,Cs2CO3作为碱,TBHP作为氧化剂,在TFE(2,2,2-三氟乙醇)溶剂中60 oC下反应12 h,可以75%的收率得到β-内酰胺产物2a。
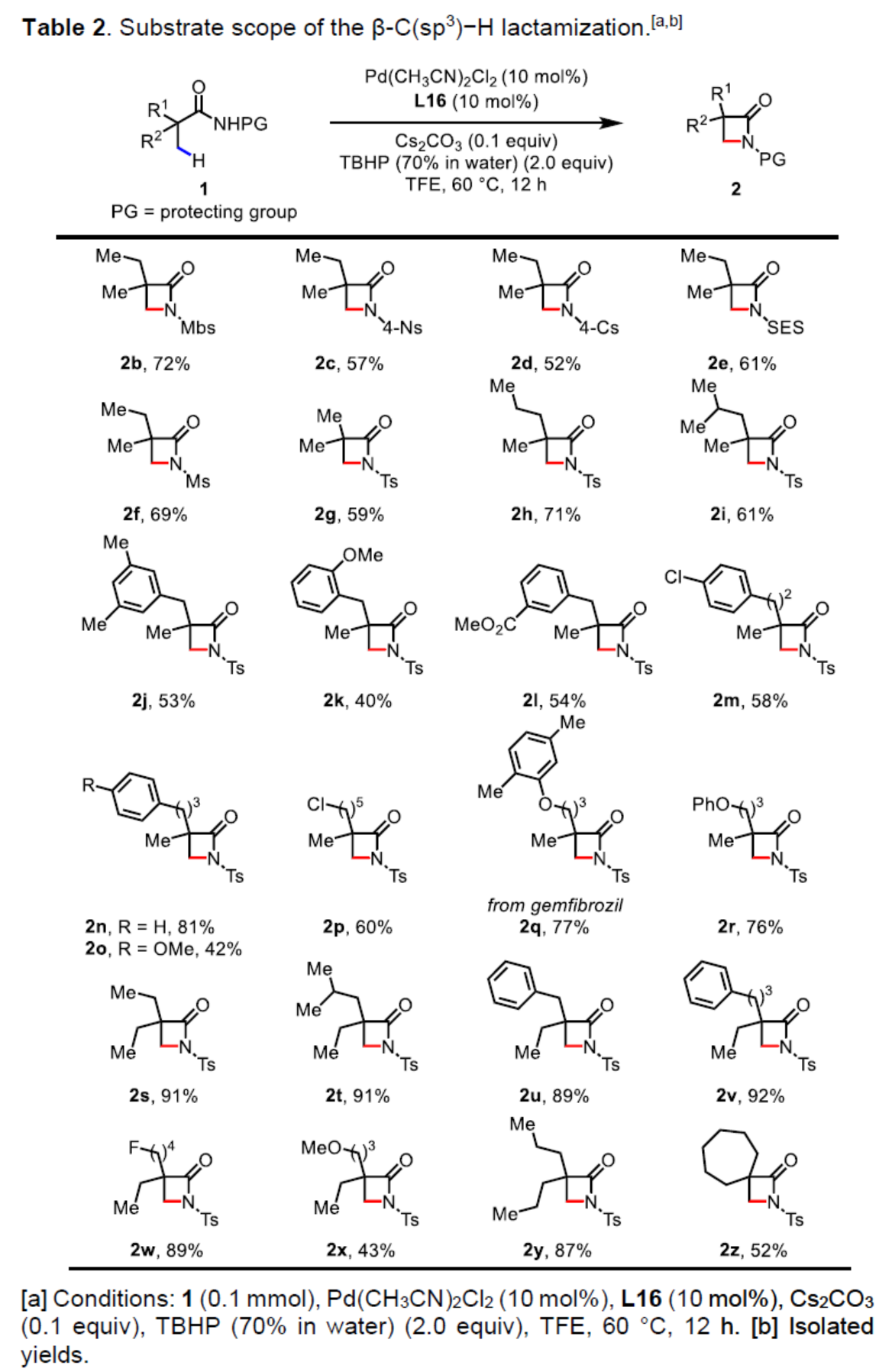
(图片来源:Angew. Chem. Int. Ed.)在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,当底物1中的保护基团从Ts改为Mbs、4-Ns、4-Cs、SES、Ms时,均可顺利反应,获得相应的β-内酰胺产物2b-2f,收率为52-72%。其次,含有α-偕-二甲基以及各种脂肪族链的脂肪族酰胺,均与体系兼容,获得相应的β-内酰胺产物2g-2y,收率为40-91%。其中,含有苯基(2j-2o,2u和2v)取代的底物也与TBHP体系兼容,虽然可能存在潜在反应性的芳基或苄基C-H键。同时,衍生自吉非贝齐(gemfibrozil,一种降血脂的口服药物)的脂肪族酰胺1q,可以77%的收率获得相应的β-内酰胺产物2q。此外,通过该策略还可合成螺旋β-内酰胺产物2z,收率为52%。对于反应性较低的底物,可回收大多数起始原料。副产物包括开环的氨基酯或氧化产物,类似于使用配体L10观察到的结果。使用略有不同的反应条件,带有α-氢的底物可获得β-氨基酯产物(如2ae’)。位阻较少的β-内酰胺很容易与醇进行开环。在该条件下,底物1al中的亚甲基C-H键没有反应性。
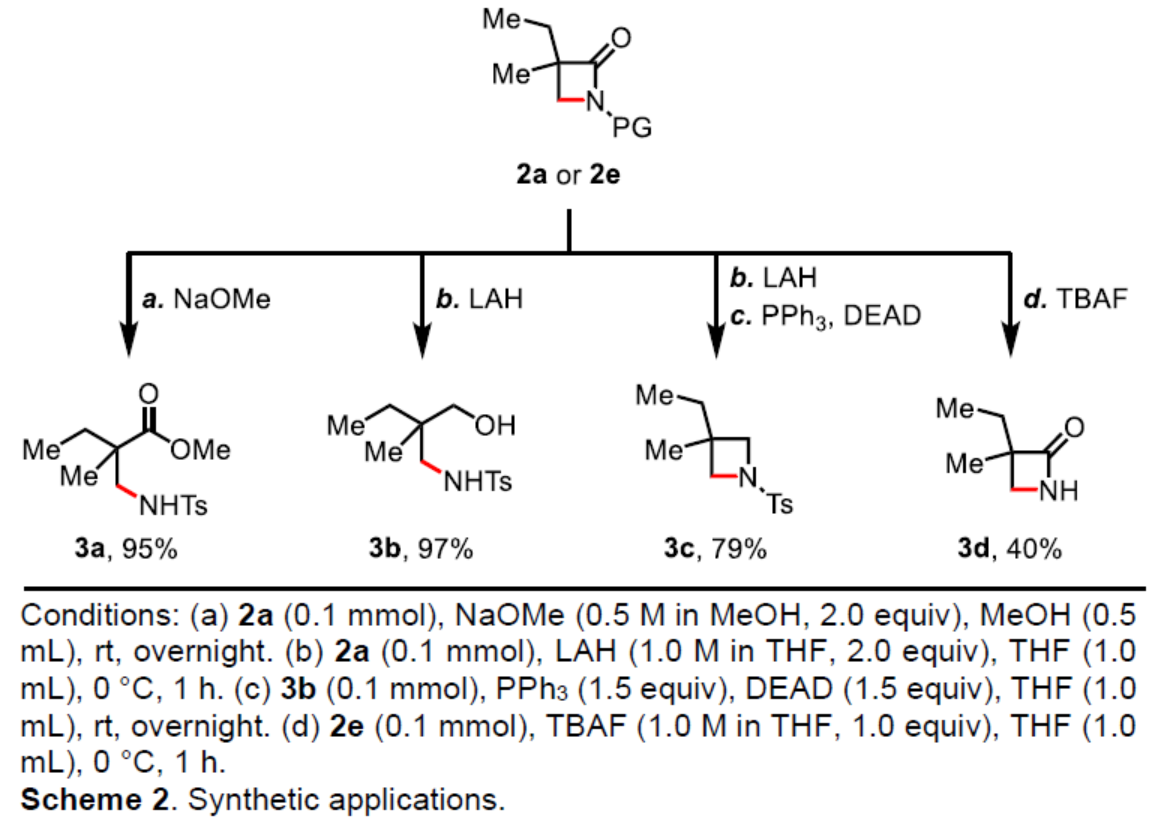
(图片来源:Angew. Chem. Int. Ed.)与其它C-H键活化策略相比,该策略具有多个关键的优势:(1)使用廉价的TBHP作为唯一的氧化剂;(2)反应对空气和水分不敏感;(3)反应扩展性高。同时,考虑到一级C-H键的还原消除,该策略作为一种互补的方法,可用于合成β-无取代的β-内酰胺化合物,这是使用DGs在β-内酰胺化反应中通常无法实现的。紧接着,作者对反应的实用性进行了研究(Scheme 2)。首先,2a经NaOMe促进的开环反应,可以95%的收率获得β-氨基酯化合物3a。2a经LAH促进的还原反应,可以97%的收率获得γ-氨基醇化合物3b。3b可进一步经Mitsunobu反应,可以79%的收率获得氮杂环丁烷化合物3c。其次,在THF中使用TBAF对2e进行脱保护,可以40%的收率获得化合物3d。
(图片来源:Angew. Chem. Int. Ed.)总结:美国Scripps研究所余金权课题组报道了一种MPathio配体与钯(II)催化剂促进的脂肪族酰胺的β-内酰胺化反应。其中,使用TBHP作为唯一的氧化剂以及使用基于磺酰基作为保护基团。此外,合成的β-内酰胺产物可进一步衍生化为一系列具有价值的化合物,如β-氨基酸、γ-氨基醇和氮杂环丁烷。
文献详情:
Zhe Zhuang,Shuang Liu,Jin-Tang Cheng,Kap-Sun Yeung,Jennifer X. Qiao,Nicholas A. Meanwell,Jin-Quan Yu. Ligand-Enabled β-C(sp3)−H Lactamization of Tosyl-Protected Aliphatic Amides Using a Practical Oxidant. Angew. Chem. Int. Ed. 2022. https://doi/10.1002/anie.202207354.








