

(图片来源:J. Am. Chem. Soc.)
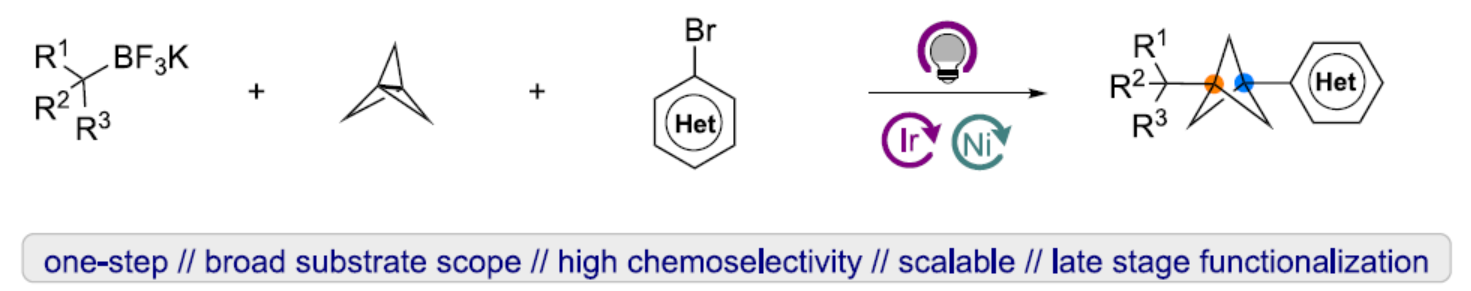
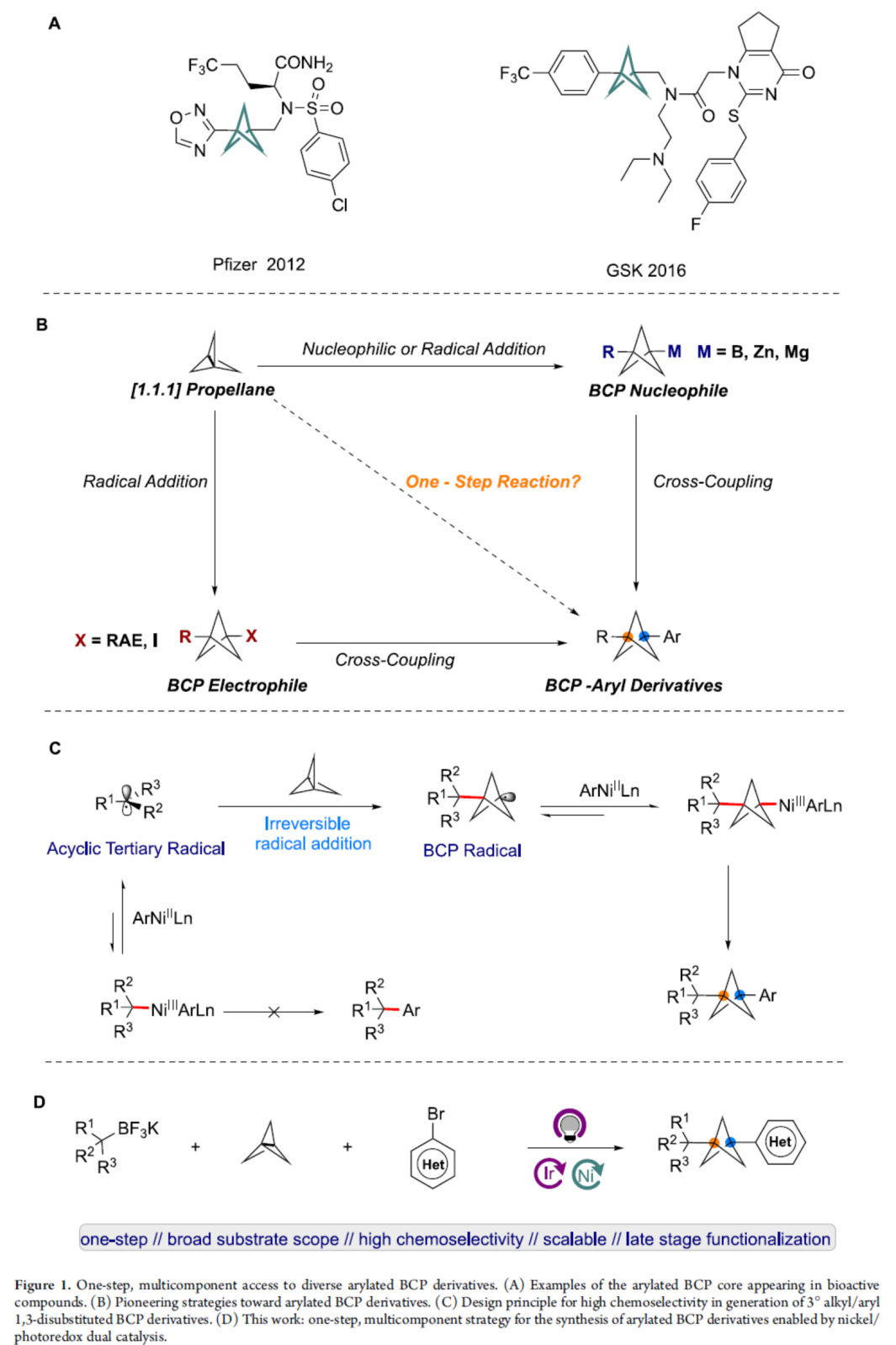
在现代药物发现中,生物等排体取代是改善药物和候选药物各种物理化学性质的重要途径。其中,双环[1.1.1]戊烷(BCP)骨架是一种对位二取代芳基生物等排体,也是叔丁基或炔烃生物等排体,具有有利的药代动力学特性,如被动渗透性、水溶性、代谢稳定性等。芳基取代的BCP衍生物是药学上重要的骨架(Figure 1A),但其合成仍具有难度。其中,通过[1.1.1]螺桨烷的多步反应是制备芳基取代BCP衍生物的常用方法(Figure 1B)。例如,化学家们报道了芳基卤化物和BCP亲核试剂(衍生自[1.1.1]螺桨烷)之间的Kumada-、Negishi-和Suzuki-型偶联反应,但需合成和使用反应性有机金属试剂,导致官能团兼容性差。同时,Baran和Anderson课题组还报道了芳基金属试剂与BCP氧化还原活性酯或碘化物的交叉偶联反应,但对于BCP亲电试剂合成至少需从[1.1.1]螺桨烷经一步反应。并且,大多数反应均集中于α-一级或-二级芳基-BCPs的制备上,且需多步操作。然而,仅有少数合成α-季碳BCP-芳基衍生物的方法,且仅限于特定的子结构。作者认为,成功的MCR(Multicomponent reactions,多组分反应)方法的一个关键因素是对[1.1.1]螺桨烷的选择性烷基加成,而不是直接加成到镍中心,这利用了无环三级烷基自由基和BCP自由基在镍催化剂捕获方面明显不同的反应性。无环三级自由基更容易从Ni(III)中心解离形成Ni(II)和无环烷基三级自由基,而对于环状三级烷基自由基,能量学有利于Ni(III)配合物的形成。基于这一假设,光生成的三级烷基自由基经不可逆的自由基加成至[1.1.1]螺桨烷中而非镍中心,生成BCP自由基。随后,用镍催化剂进行自由基捕获,生成形式的Ni(III)配合物,该配合物经还原消除生成芳基化BCP产物(Figure 1C)。近日,美国宾夕法尼亚大学Gary A. Molander课题组报道了一种镍/光氧化还原双重催化[1.1.1]螺桨烷、芳基卤与烷基三氟硼酸钾盐的三组分双碳官能团化反应,合成了一系列芳基化双环[1.1.1]戊烷衍生物(BCPs)(Figure 1D)。
(图片来源:J. Am. Chem. Soc.)
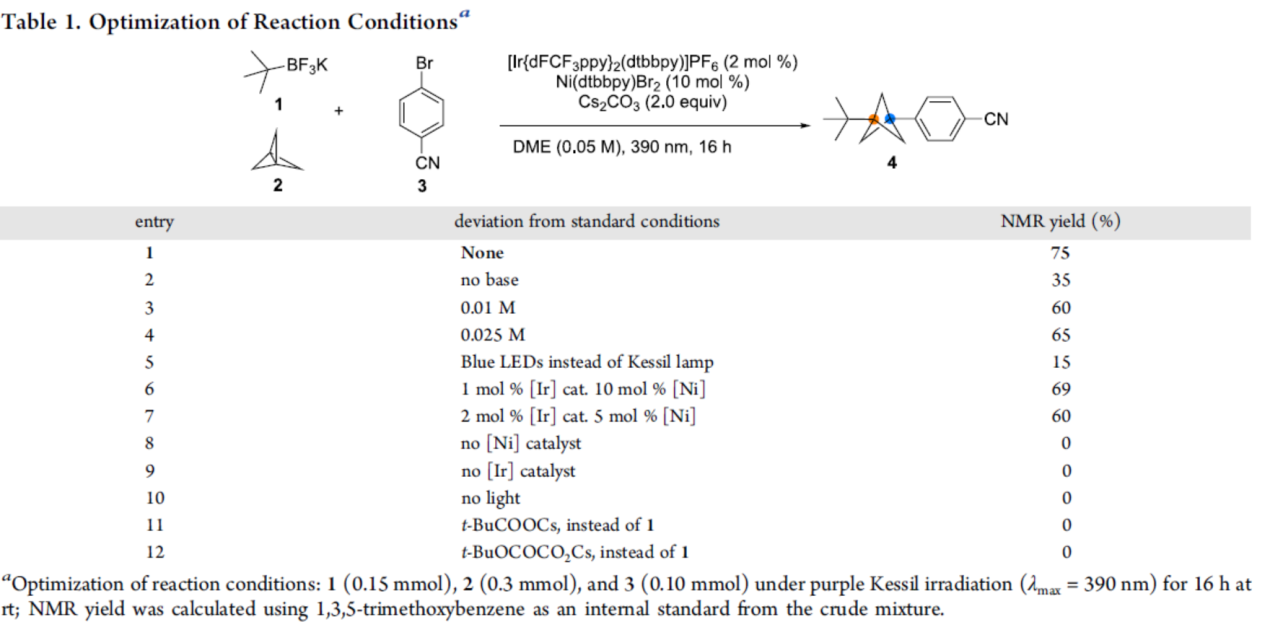
首先,作者以t-BuBF3K(1)、螺桨烷2与4-溴苄腈3作为模型底物,进行了相关三组分偶联反应条件的筛选(Table 1)。当以[Ir(dFCF3ppy)2dtbbpy]PF6作为光催化剂,Ni(dtbbpy)Br2作为金属催化剂,Cs2CO3作为碱,DME作为溶剂,可在390 nm LED辐射下25 oC反应16 h,可以75%的收率得到芳基化双环[1.1.1]戊烷产物4。
(图片来源:J. Am. Chem. Soc.)
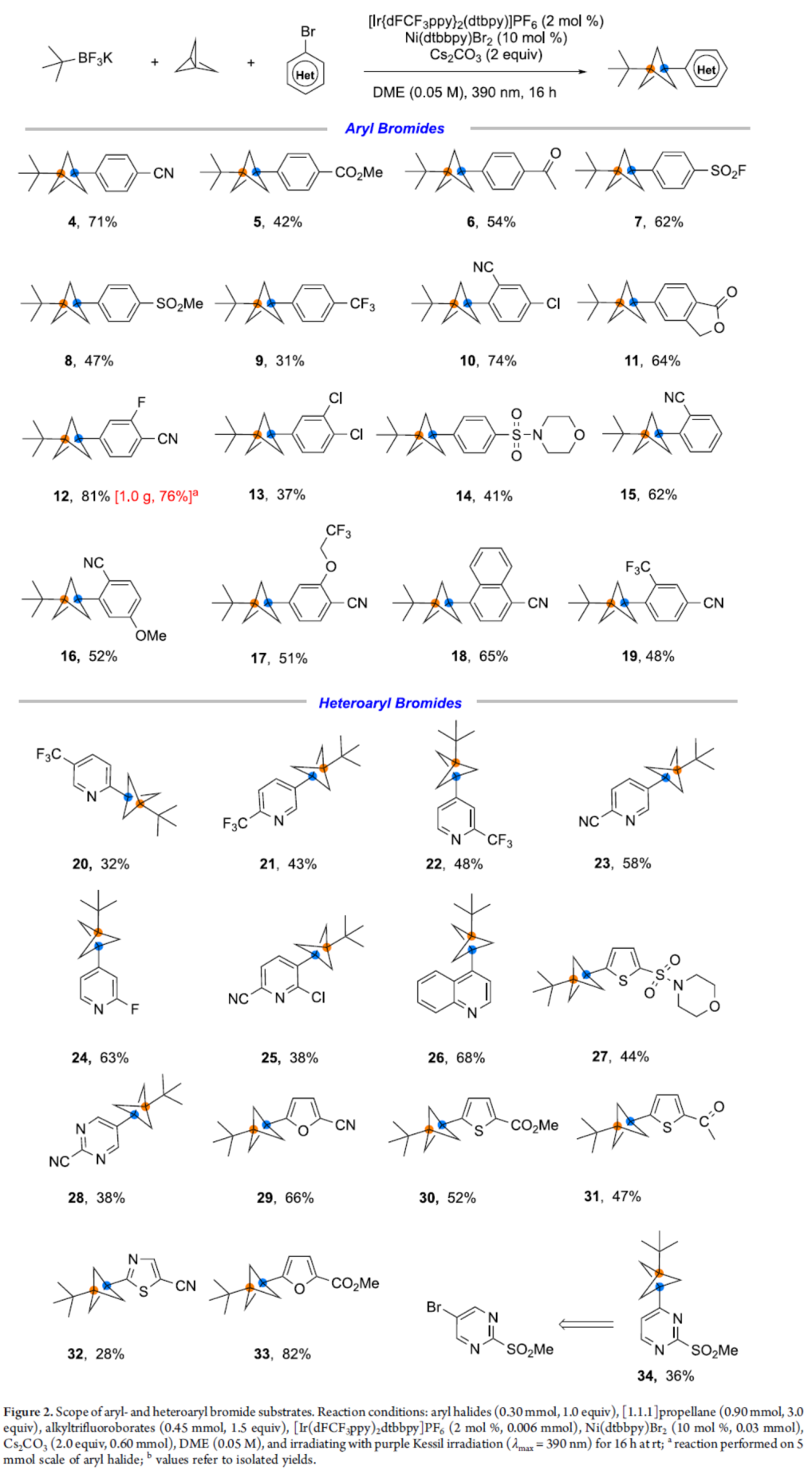
在获得上述最佳反应条件后,作者对(杂)芳基溴底物范围进行了扩展(Figure 2)。首先,一系列具有不同电性取代的芳基溴,均可顺利反应,获得相应的产物4-19,收率为31-81%。值得注意的是,一系列活性基团,如腈基、酯基、羰基等,均与体系兼容。克级规模实验,可以76%的收率获得产物12。其次,杂芳基溴,如吡啶基、嘧啶基、呋喃基、喹啉基、噻唑基、噻吩基等,均与体系兼容,获得相应的产物20-33,收率为28-82%。此外,当以5-溴-2-(甲基磺酰基)嘧啶为底物时,可获得36%收率的非预期产物34,可能是由于竞争性 Minisci-型反应导致。
(图片来源:J. Am. Chem. Soc.)
紧接着,作者对三级烷基三氟硼酸盐的底物范围进行了扩展(Figure 3)。研究表明,一系列不同取代的烷基三氟硼酸盐,均可顺利反应,获得相应的产物35-46,收率为25-64%。其中,含有羰基、酯基、烯基等活性基团的底物,均可与体系兼容。
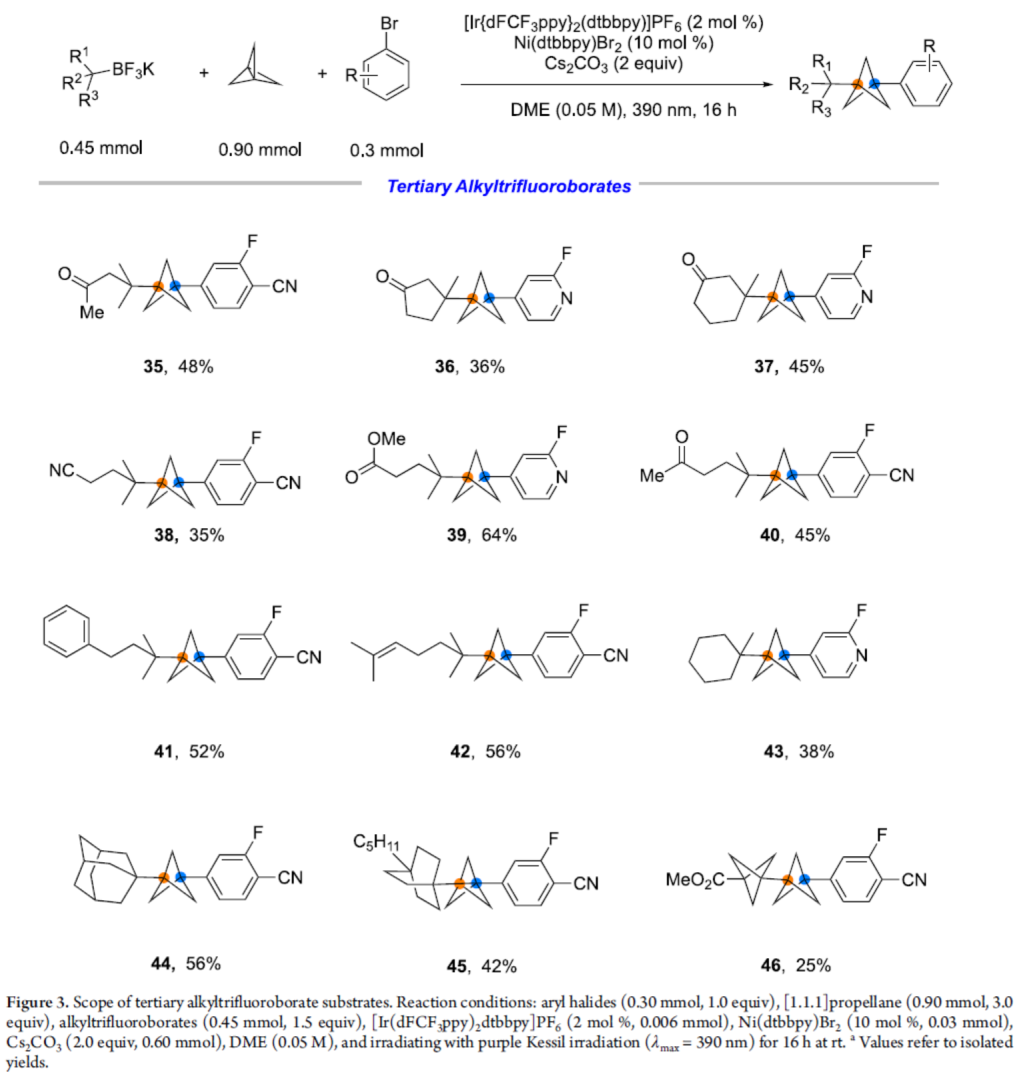
(图片来源:J. Am. Chem. Soc.)
为了进一步证明反应的实用性,作者对一些复杂的药物分子进行了后期衍生化实验,获得相应的产物47-52,收率为35-58%(Figure 4)。
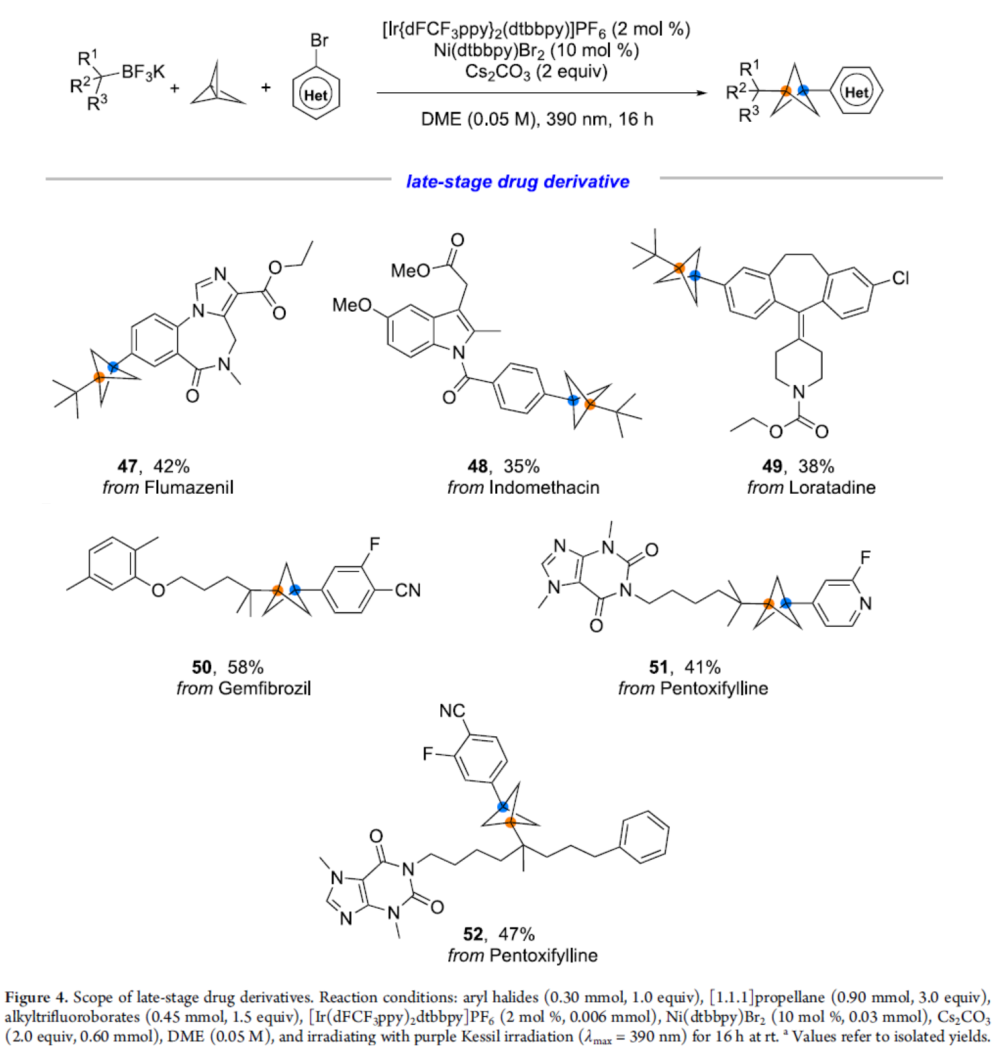
(图片来源:J. Am. Chem. Soc.)
此外,作者还对反应机理进行了相关的研究(Figure 5)。首先,二级(环己基)和三级(叔丁基)自由基之间的竞争性实验表明,三级自由基只参与该MCR过程,而二级自由基仅参与双组分反应(Figure 5A)。其次,BCP和三级(叔丁基)自由基之间的竞争性实验表明,BCP桥头自由基更容易与镍催化剂结合进入交叉偶联催化循环,而无环三级自由基则非常缓慢(Figure 5B)。此外,使用马鞭烯酮衍生的烷基三氟硼酸盐,可获得开环产物57,从而表明MCR过程涉及自由基途径(Figure 5C)。
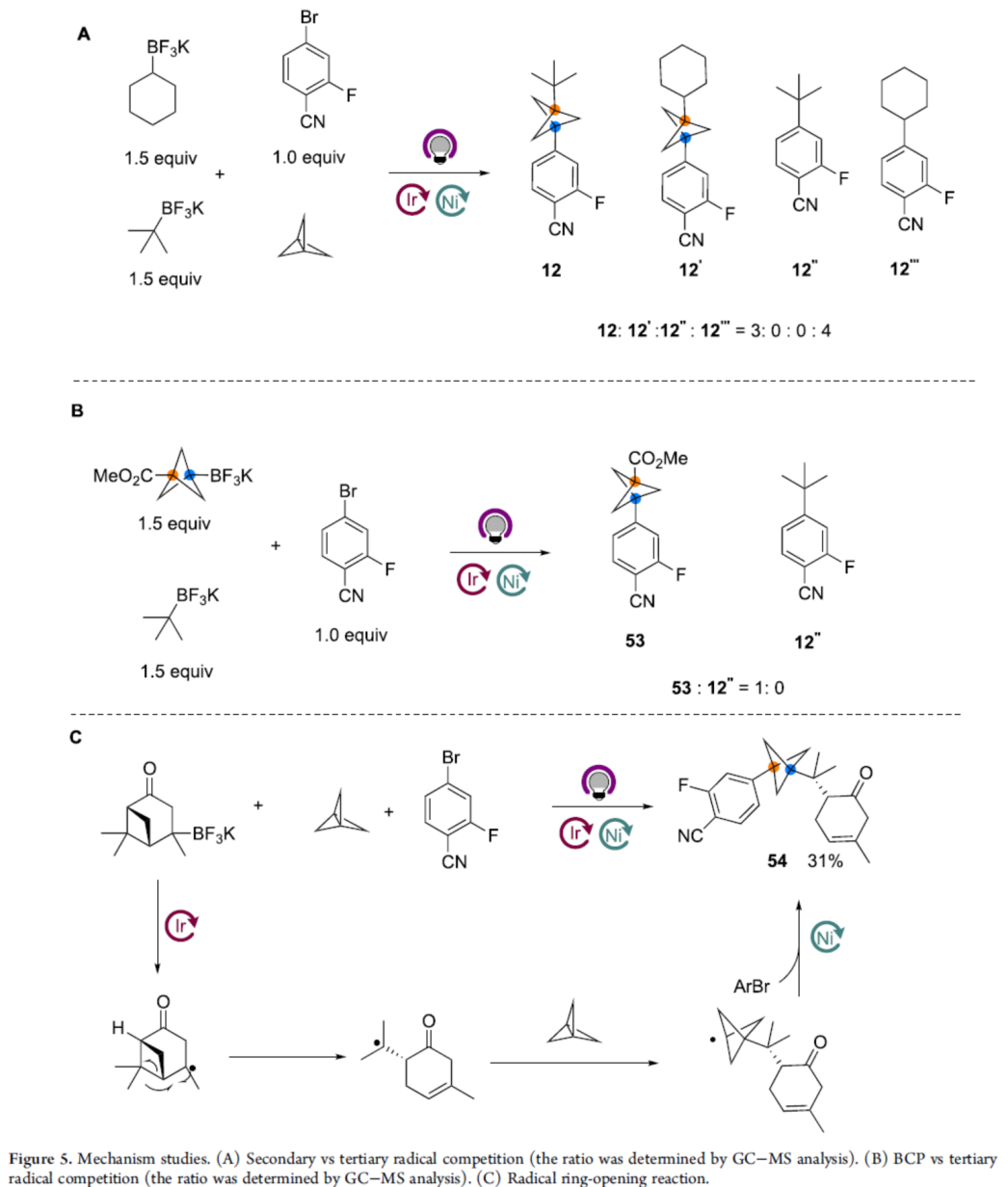
(图片来源:J. Am. Chem. Soc.)
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 6)。首先,烷基三氟硼酸盐试剂与Ir* II的单电子氧化生成三级烷基自由基V。自由基V可与[1.1.1]螺桨烷进行不可逆的自由基加成,生成BCP自由基VI,可被Ni(0)配合物VII捕获生成烷基镍(I)配合物VIII。随后,VIII与(杂)芳基溴进行快速的氧化加成,生成Ni(III)配合物X,其经过还原消除,可获得目标偶联产物和Ni(I)配合物XI。此外,反应还存在另一种途径,即Ni(0)配合物VII还可与(杂)芳基溴反应,生成Ni(II)配合物IX,可捕获BCP自由基VI以生成Ni(III)配合物X。随后,Ni(III)配合物经快速且高效的C-C键形成,从而生成芳基化BCP产物。
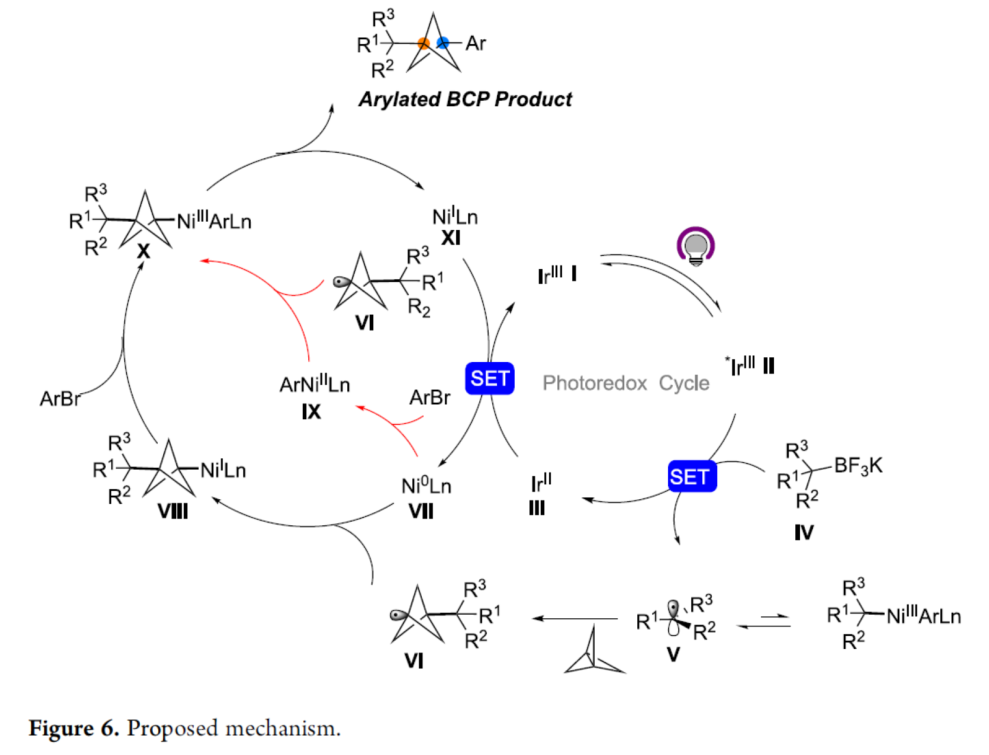
(图片来源:J. Am. Chem. Soc.)
总结:美国宾夕法尼亚大学Gary A. Molander课题组报道了一种镍/光氧化还原双重催化实现一步三组分自由基偶联反应,合成了一系列芳基化双环[1.1.1]戊烷衍生物,且避免了对[1.1.1]螺桨烷的预官能团化处理。同时,通过该策略可在一个步骤中形成两个C-C键以及三个季碳中心。此外,该策略具有反应条件温和、底物范围广泛、官能团兼容性高等特点。
文献详情:
Weichen Huang, Sebastian Keess, and Gary A. Molander*.Dicarbofunctionalization of [1.1.1]Propellane Enabled by Nickel/Photoredox Dual Catalysis: One-Step Multicomponent Strategy for the Synthesis of BCP-Aryl Derivatives.JACS.https://doi.org/10.1021/jacs.2c05304

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn