髓细胞白血病-1 (MCL-1) 属于B细胞淋巴瘤-2 (BCL-2) 蛋白家族成员之一,可作为细胞凋亡的调节因子,参与调节细胞存活等生理过程。MCL-1的过度表达存在于在各种血液瘤和实体瘤中,使得MCL-1成为治疗癌症的潜在靶标。近年来,随着对MCL-1的结构基础和致病机理的大量研究,许多制药公司都致力于MCL-1高效抑制剂的研发。迄今为止,药物化学家已经陆续报道了多种不同类型的MCL-1抑制剂,其中活性和安全性最为优异的是由杨森制药公司(Janssen Pharnarceutcia)研发的JNJ-4355(Figure 1),其最显著的特征之一是其存在联芳基手性轴,且这个四取代的 Csp2-Csp2键对化合物的活性至关重要。联芳基阻旋异构化合物越来越广泛地出现在药物分子、有机催化剂及手性配体之中。鉴于此,联芳基阻旋异构体的不对称合成受到了一定的关注,目前常见的合成方式包括联芳基化合物的不对称交叉偶联;外消旋或前手性联芳基化合物的不对称修饰(如动力学拆分等);中心手性向轴手性的传递及联芳基化合物的去对称化等。然而,过渡金属催化的交叉偶联反应因底物位阻、合成步骤冗长、条件严苛等因素严重阻碍其反应活性和选择性,使得四邻位取代联芳基骨架的构建仍然是有机化学领域的一大难题。因此,发展高效合成联芳基阻旋异构体的方法长期以来一直是有机化学家的研究重点。
近日,杨森制药公司的Katharina Neufeld研究员发展了一类手性Suzuki-Miyaura偶联/酶动力学拆分相结合的合成联芳基阻旋异构体的方法,并成功实现了JNJ-4355的高效合成。相关成果发表在ACS Catal.上(DOI: 10.1021/acscatal.2c02090)。
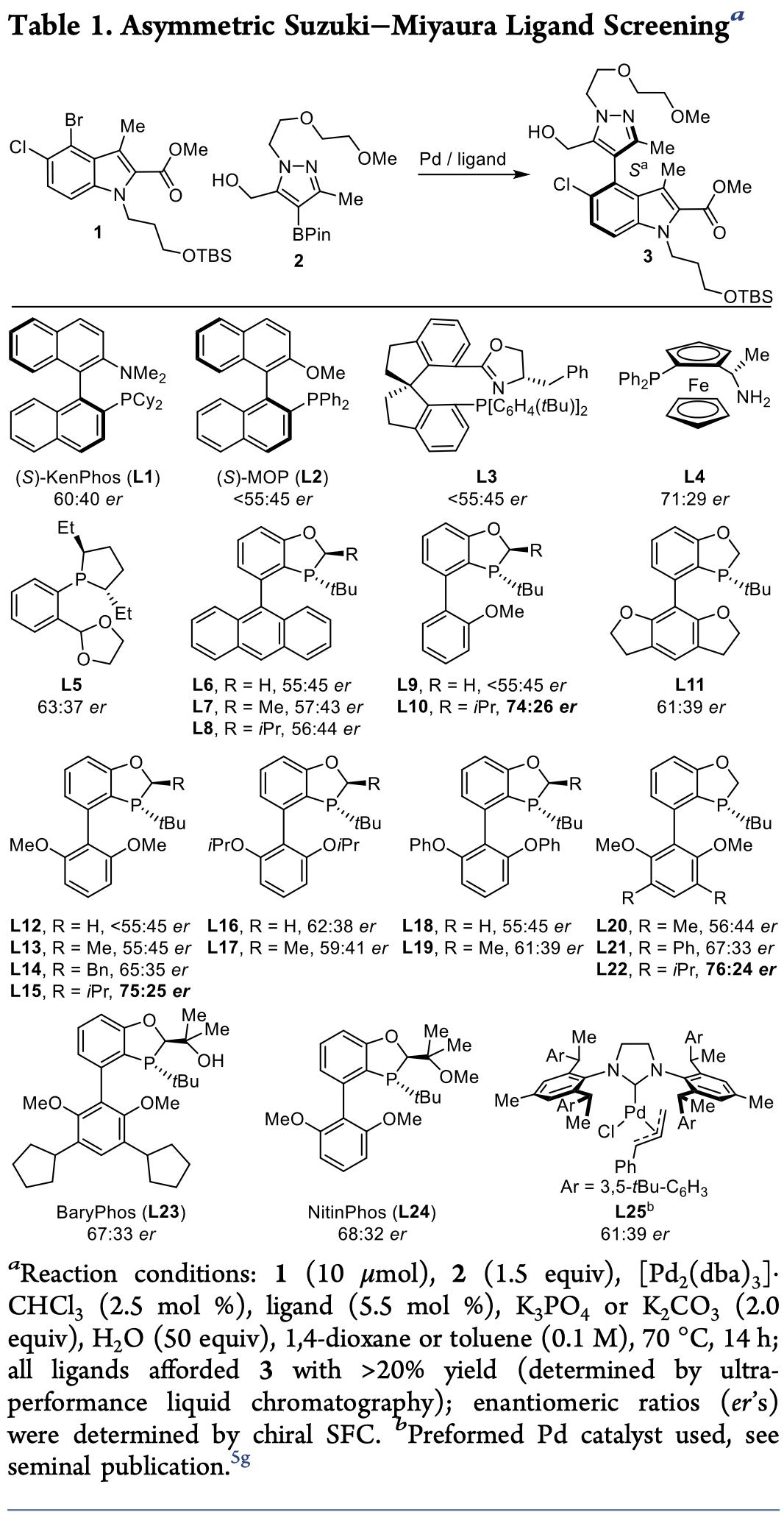
基于HTE技术,作者以N-取代吲哚(1)和吡唑硼酸(2)作为模型底物,对催化剂的配体进行了筛选(Table 1)。首先,作者发现以(S)-KenPhos (L1)、(S)- MOP (L2)和L3为配体时,反应仅以60:40er值和< 55:45 er值得到目标产物3。接着,作者在相同反应条件下,将配体替换成二茂铁配体L4和单苯环配体L5时,发现反应对映选择性略有提高。然后,作者继续对一系列手性联芳基单膦配体(L6-L24)进行筛选,发现以L10和L15为配体时,产物的选择性显著提高,但均无法同时达到最优的产率、非对映选择性和对映选择性,而以L22为配体时,反应能够在保持良好产率的同时显著提高选择性。
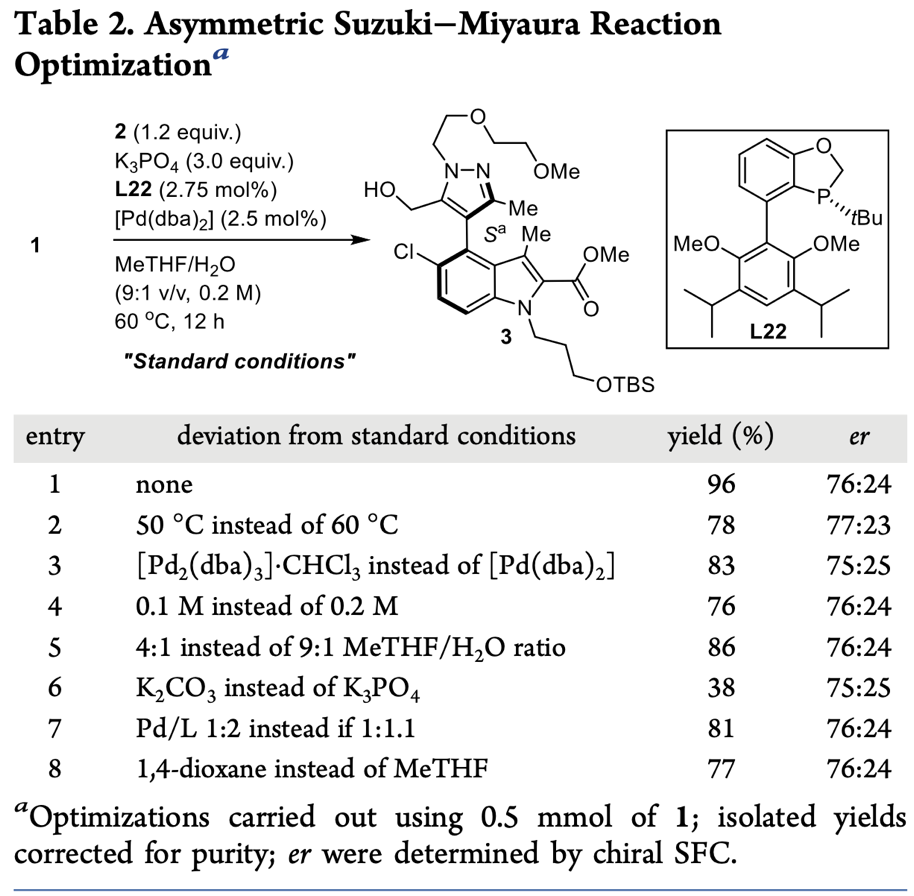
基于筛选的最优配体,作者继续对碱和反应溶剂进行了筛选(Table 2)。首先,作者发现以[Pd(dba)2]为催化剂和K3PO4为碱时,反应能以96%的分离产率和76:24 er值得到产物3。接着,作者在相同反应条件下,分别将催化剂和碱替换成[Pd(dba)2].CHCl3和K2CO3时,发现反应能保持优异的选择性得到产物,但其反应产率显著降低。然后,作者改变催化剂与配体用量比,发现反应产率同样下降(81%)。最后,作者又尝试改变溶剂或反应浓度,反应以76%-86%的分离产率得到目标产物。经过筛选,作者确定了[Pd(dba)2]为催化剂(2.5 mol%)、L22(2.75 mol%)为配体、K3PO4为碱和MeTHF/H2O为溶剂的最佳反应条件。
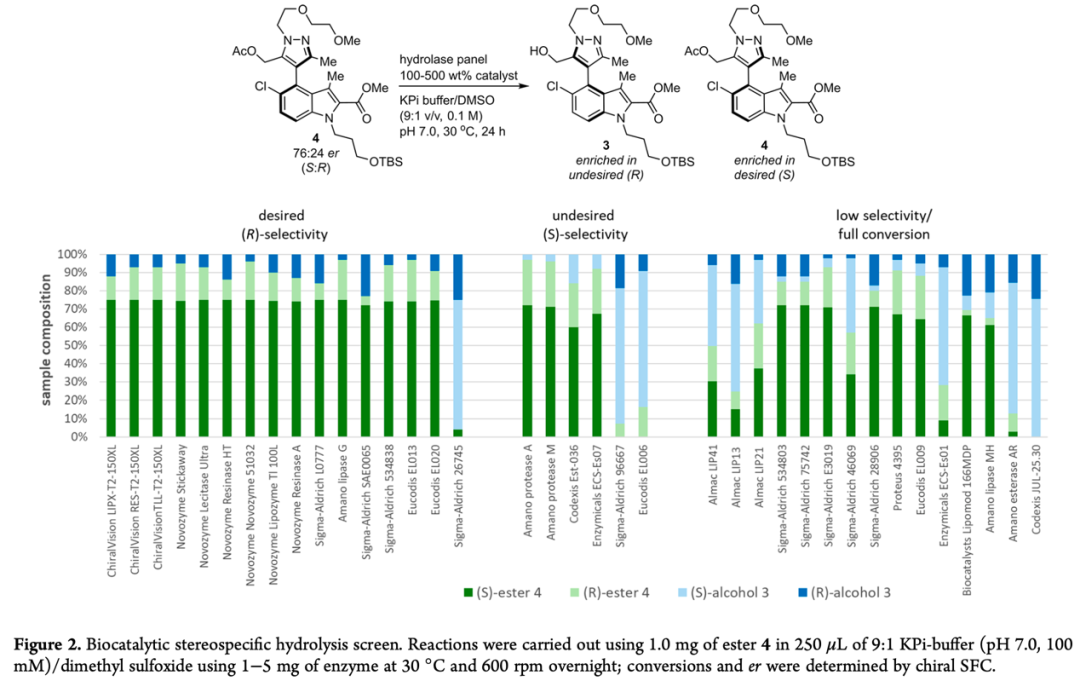
虽然通过手性Suzuki-Miyaura偶联反应能够以高产率得到化合物3,但其对映选择性仍有待提高,因此,作者猜想是否能够先将化合物3乙酰化,再利用生物催化水解得到手性丰富的S构型产物,从而达到分离的目的。基于此,作者对300余种商业可得的水解酶进行了筛选(Figure 2)。结果显示,其中ChiralVision LIPX-T2-150XL (lipase Lipex 100L)、ChiralVisionRES-T2-150XL (lipase Resinase HT)和ChiralVision TLL-T2-150XL (lipase from Thermomyces lanuginose)三种催化剂表现出优异的选择性。
为了验证三种催化剂的选择性,作者对多种不同的酰基供体进行了筛选(Figure 3)。结果显示,以丙酸乙烯酯作为酰基化供体时,三种催化剂均表现出优异的选择性,尤其是ChiralVision LIPX-T2-150XL。
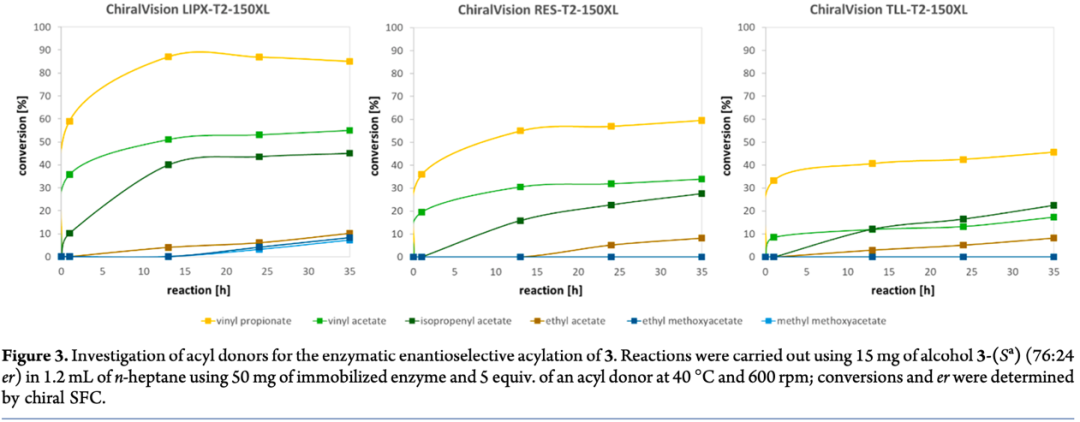
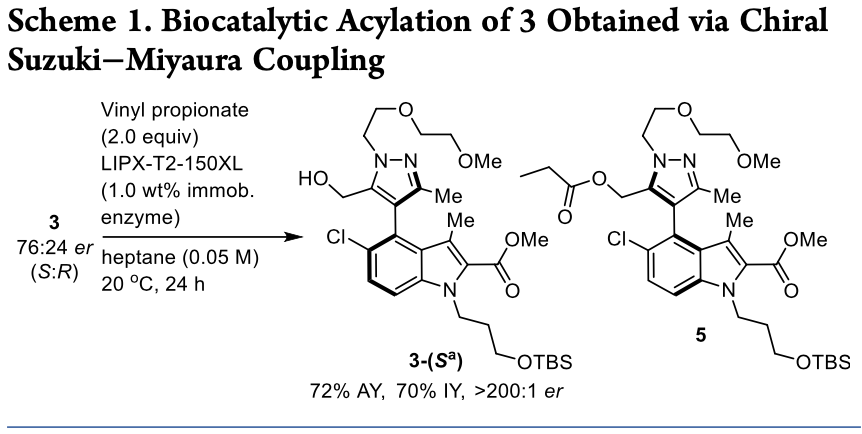
接下来,作者以化合物3为底物,将丙酸乙烯酯作为酰基供体,利用ChiralVision LIPX-T2-150XL为生物催化剂,成功的以70%的分离产率和>200:1的er值得到目标构型产物3-(Sa)。
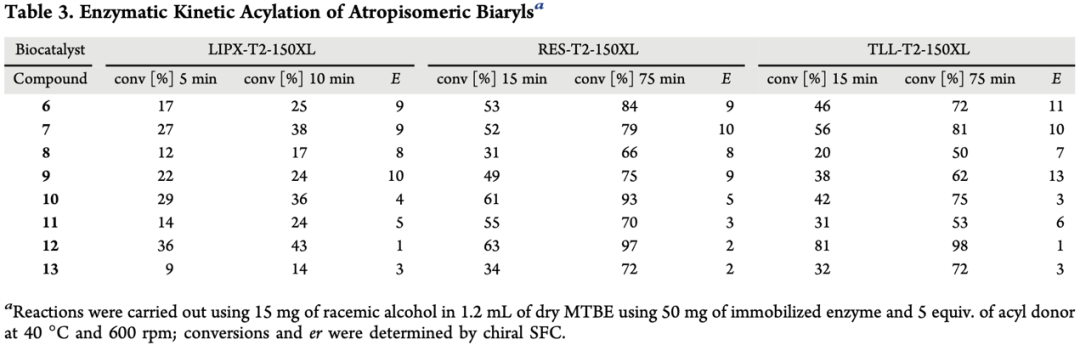
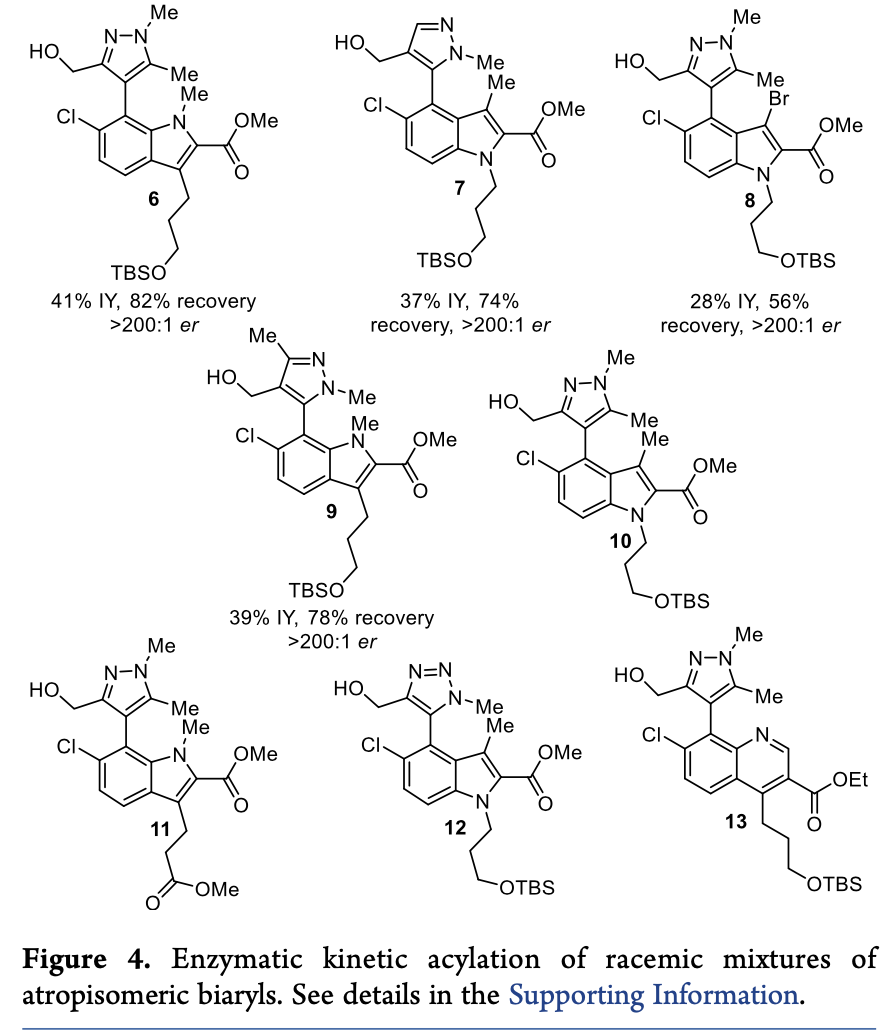
紧接着,为了验证该拆分方法是否具有普适性,作者考察了多种不同结构的联芳基阻旋异构体底物(Table 3 & Figure 4)。结果显示,相比于化合物3,这些化合物不仅乙酰化的转化率显著降低,且E值均小于10。作者猜想乙二醇取代基对于反应选择性具有至关重要的作用。然后,作者利用相同反应条件,对化合物6-9进行了拆分,虽然反应分离产率较低(28%-41%),但能够保持优异的对映选择性(>200:1)。
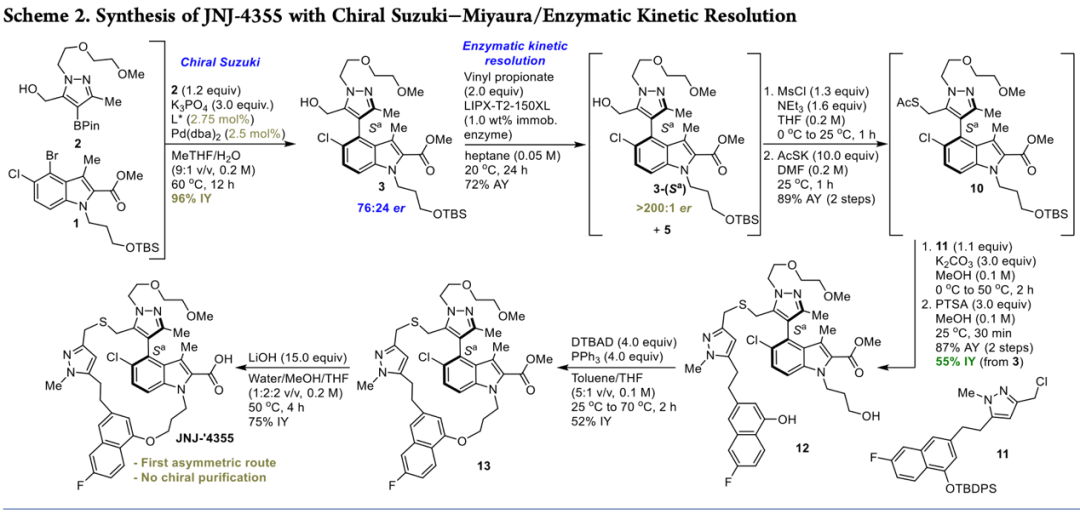
最后,作者利用开发的方法成功实现了JNJ-4355的高效合成(Scheme 2)。首先,以N-取代吲哚(1)和吡唑硼酸(2)作为反应底物,在标准条件下,以96%的分离产率得到化合物3,再经酶动力学拆分以>200:1的对映选择性得到目标化合物3-(Sa)。然后,化合物3-(Sa)经羟基磺酰化和亲核取代以两步89%的产率得到化合物10,再经亲核取代和PTSA脱保护基以87%的产率得到关键中间体12。最后,化合物12经分子内Mitsunobu反应得到化合物13,再经碱性条件水解得到目标产物。
总结:杨森制药公司的Katharina Neufeld研究员报道了一类手性Suzuki-Miyaura偶联/酶动力学拆分相结合的合成联芳基阻旋异构体的方法,并成功实现了JNJ-4355的高效合成。该反应不仅条件温和、官能团兼容性好以及立体选择性高,在药物化学和有机合成中具有一定实用性。
[1] LaPlante, S. R.; Fader, L. D.; Fandrick, K. R.; et al. Assessing Atropisomer Axial Chirality in Drug Discovery and Development. J. Med. Chem.2011, 54, 7005-7022.
[2] Bringmann, G.; Price Mortimer, A. J.; Keller, P. A.; et al. Atroposelective Synthesis of Axially Chiral Biaryl Compounds. Angew. Chem., Int. Ed. 2005, 44, 5384-5427.
[3] Beutner, G.; Carrasquillo, R.; Geng, P.; Hsiao, Y.; Huang, E. C.; et al. Adventures in Atropisomerism: Total Synthesis of a Complex Active Pharmaceutical Ingredient with Two Chirality Axes. Org. Lett.2018, 20, 3736-3740.
文献详情:
Matthieu Jouffroy* and Katharina Neufeld*.Synthesis of Atropisomeric Biaryls via Chiral Suzuki–Miyaura/Enzymatic Kinetic Resolution.
ACS Catal.2022.https://doi.org/10.1021/acscatal.2c02090












