

正文
由于全球老年人痴呆症患病率不断上升以及对社会的影响越来越大,阿尔茨海默症(AD)已经引起了越来越多的关注,其中对AD发病机制和诊断方法的研究一直处于医学和脑科学的前沿。目前,AD的诊断主要基于使用多种常规神经心理学测试和医疗器械(CT、PET、MRI)进行的临床评估。此外,临床上还包括对血浆或脑脊液中的生物标志物的检查,以估计疾病的发展进程。但是,这些方法都很难满足AD诊断所需的敏感性、特异性和非侵入性。
荧光成像因其高灵敏度、微创和实时响应的特性而在生物分析领域引起了广泛的关注。在此背景下,针对AD生物标志物设计的荧光探针将为AD诊断和病理分析提供强有力的工具。当前,对AD早期诊断的研究大多集中在Aβ肽或tau蛋白上,而很少能够在活体水平上揭示氧化应激与AD之间的复杂关系。作为超氧自由基和一氧化氮的组合产物,过氧亚硝酸盐(ONOO-)是一种典型的氧化应激反应物种,已有证据表明,ONOO-通过引发神经毒性和神经炎症在AD的发病机制中起重要作用。但是,迄今为止,还没有ONOO-荧光探针可用于AD的活体脑成像。造成这种困境的一个主要原因可能是当前探针的血脑屏障(BBB)穿越能力不足。此外,由于大脑中产生的ROS种类繁多,也要求探针对ONOO-具有优异的选择性。鉴于此,刘志洪教授团队通过结构调节策略合理设计了一种新颖的ONOO-激活的近红外发射荧光探针Rd-DPA3,旨在研究过氧亚硝酸盐与AD之间的复杂关系,实现AD进展过程的体内诊断和评估(图1)。
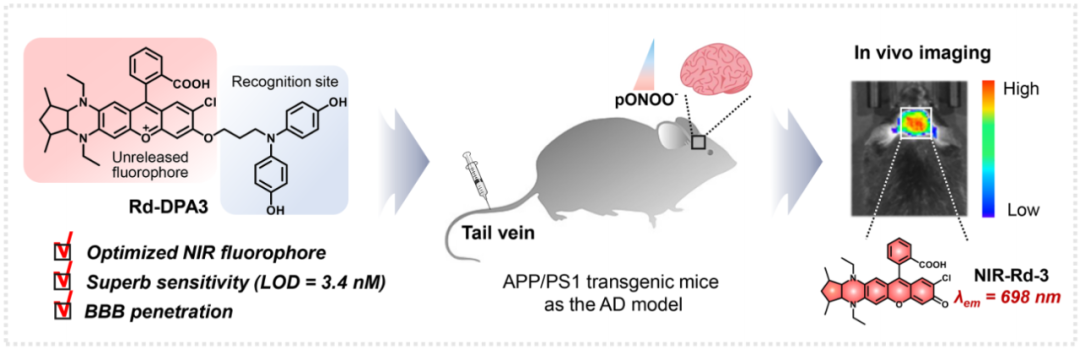
图 1. 探针Rd-DPA3的结构及作用示意图(图片来源:Angew. Chem. Int. Ed.)
在探针分子的构建中,首先基于前期工作中发展的二氨基取代的Rhodol染料(NIR-Rd-1和NIR-Rd-2),作者利用刚性五元环锁定类哌嗪类二氨基结构并接枝氯原子开发了一种新型Rhodol染料NIR-Rd-3,其具有更长的近红外发射波长。此外,考虑到ONOO-的强氧化性和亲核性,4, 4'-氮杂二基二苯酚被创新性地开发为对ONOO-具有高选择性的识别基团,进而连接到NIR-Rd-3荧光团上获得了ONOO-可激活的荧光探针Rd-DPA3。接着,作者首先通过滴定实验验证了探针Rd-DPA3对ONOO-的响应性能。在没有ONOO-存在的条件下,Rd-DPA3的最大吸收峰位于602 nm,同时在702 nm处显示微弱的荧光。而在加入ONOO-反应后,Rd-DPA3在700 nm处的荧光显著增强,同时吸收蓝移至572 nm。重要的是,Rd-DPA3对ONOO-表现出优异的灵敏度和选择性,检测限低至3.4 nM,其他干扰物质(金属离子,pH,ROS, 蛋白质)均不会引起探针在700 nm处的荧光增强。在不同pH条件下,探针均具有良好的稳定性,并且能够维持对ONOO-出色的响应能力(图2)。
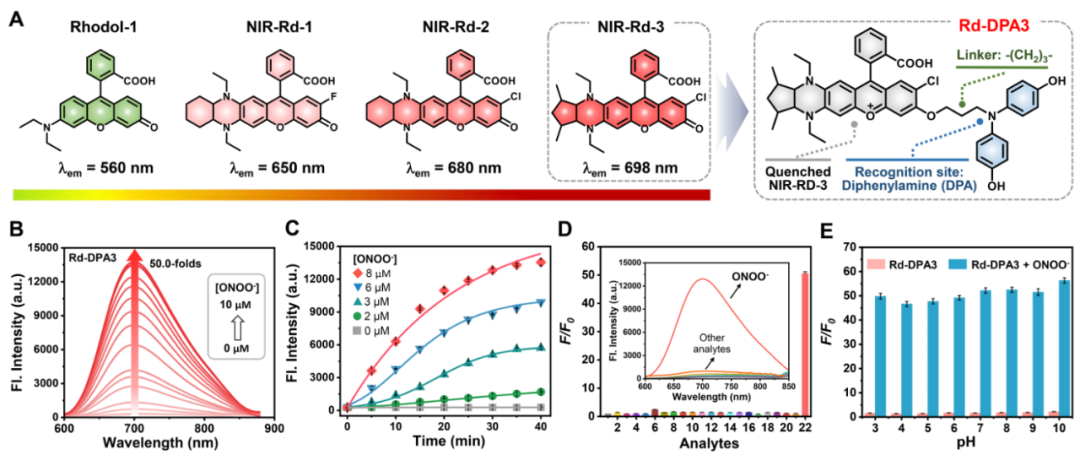
图 2. Rd-DPA3对ONOO-的光谱响应(图片来源:Angew. Chem. Int. Ed.)
然后,作者进一步通过高分辨质谱研究了Rd-DPA3与ONOO-的反应机制。实验结果证明,在单分子Rd-DPA3中,ONOO-首先进攻双氨基酚部分形成烷基胺修饰的荧光团,随后烷基胺基团继续与ONOO-发生1, 3-消除反应生成NIR-Rd-3。对于Rd-DPA3,4, 4'-氮杂二基二酚基团不仅是ONOO-的反应位点,而且还可以通过PeT效应有效地淬灭NIR-Rd-3的荧光。此外,密度泛函理论(DFT)计算也与作者提出的检测机制一致(图3)。
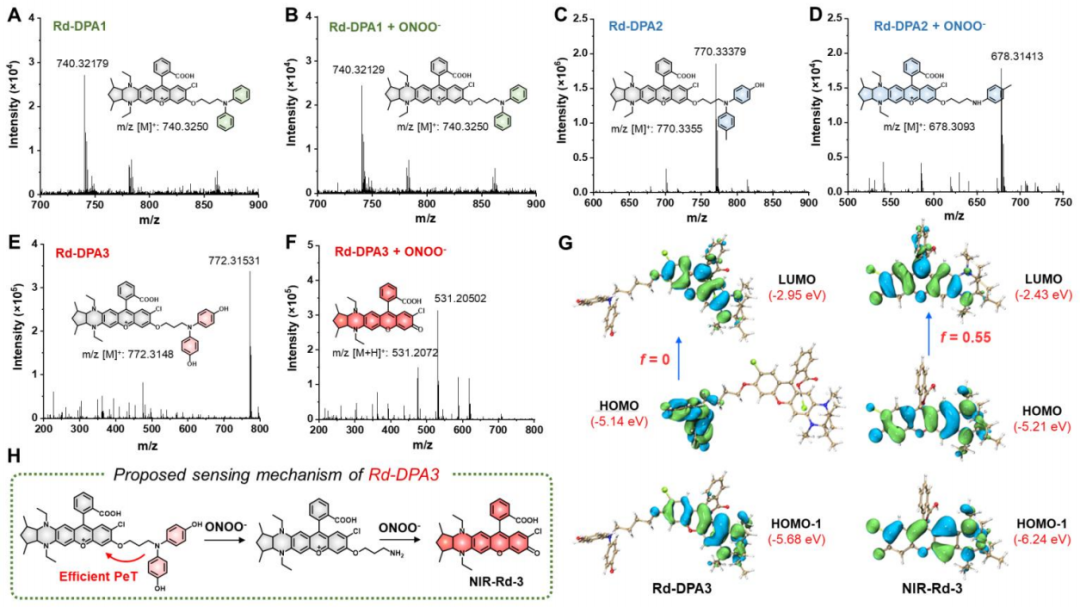
图 3. Rd-DPA3与ONOO-反应机制的探究(图片来源:Angew. Chem. Int. Ed.)
接着,作者在活细胞中研究了探针Rd-DPA3的成像能力。首先,实验结果表明该探针具有良好的生物相容性和线粒体定位性能,并且可以选择性地反映活细胞中外源性和内源性ONOO-浓度的变化。由于金属离子(Fe2+, Cu2+等)稳态的紊乱与AD的进展密切相关,作者进一步通过在PC12细胞中添加Fe2+,模拟AD过程中由于金属离子稳态失衡所导致氧化应激的细胞模型。。结果显示,随着Fe2+浓度的增加,细胞内荧光逐渐增强,表明在Fe2+诱导的氧化应激过程中产生了ONOO-。值得注意的是,加入尿素(UA,一种高效的ONOO-清除剂)后,PC12细胞中的红色荧光信号急剧降低,这表明UA有效降低了细胞内ONOO-水平。同时,这些实验结果证明了Rd-DPA3能够监测AD细胞模型中ONOO-的波动(图4)。
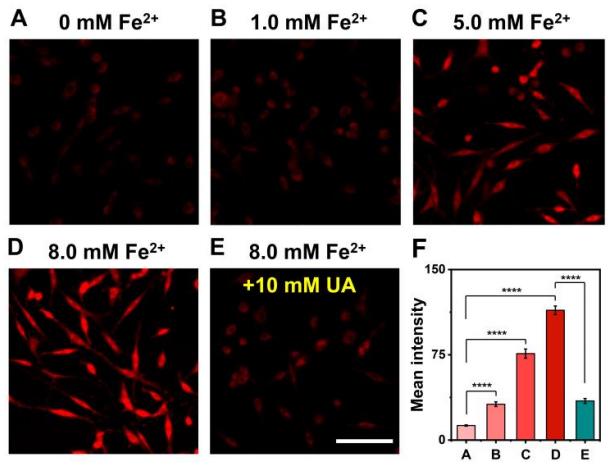
图 4. AD细胞模型中ONOO-的监测(图片来源:Angew. Chem. Int. Ed.)
随后,作者进行了活体成像的研究。首先,作者评估了探针的血脑屏障(BBB)穿透能力。经计算,55.54%的Rd-DPA3成功穿透了人工模拟BBB,显示出探针在体内脑成像的巨大潜力。然后,探针经过尾静脉注射到各个实验组的小鼠模型中。在AD模型小鼠中,荧光强度在0-6小时内显着升高,并在6-11小时内保持稳定;相比之下,在对照组中只能观察到轻微的荧光增强,从而证明ONOO-的过度表达是AD的标志之一。此外,为了确认注射后探针集中在小鼠大脑中,解剖小鼠大脑进行了离体NIR成像。体外成像结果表明,AD模型脑部的荧光强度远高于对照组,进一步证实了探针在脑中的BBB穿越能力和ONOO-检测性能。同时,在氯碘羟喹或姜黄素(两种著名的治疗阿尔茨海默病的化学药物)处理的AD小鼠中,脑部的实时荧光成像表明ONOO-表达在0-12小时下降到低水平。这样的结果表明Rd-DPA3可以通过测量大脑中的ONOO-水平来帮助药理学家研究药物在治疗阿尔茨海默病中的作用机制(图5)。除此之外,作者进一步对不同年龄AD大脑中ONOO-的积累进行了研究。3个月,8个月和12个月大的AD模型小鼠分别被注射了Rd-DPA3,并记录了小鼠的实时成像。结果显示,来自大脑的荧光信号随着年龄的增长而显著增加,为AD大脑中ONOO-的年龄依赖性积累提供了体内证据(图6)。
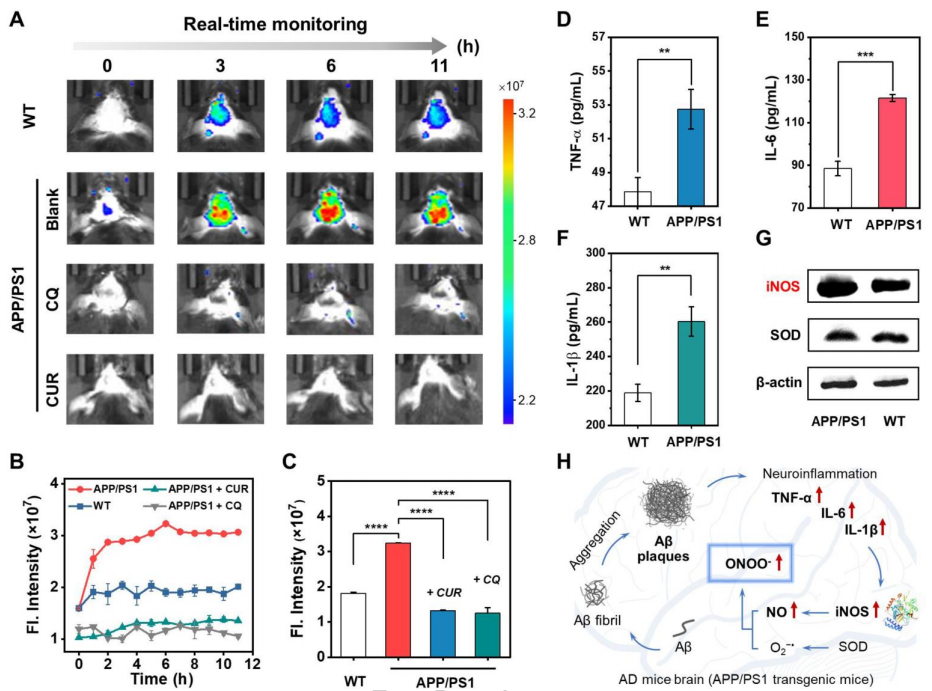
图 5. AD小鼠中ONOO-的体内成像(图片来源:Angew. Chem. Int. Ed.)

图 6. ONOO-在年龄相关AD小鼠中的体内成像(图片来源:Angew. Chem. Int. Ed.)
总结
湖北大学刘志洪教授团队通过结构调节优化策略合理设计了一种过氧亚硝酸盐(ONOO-)可激活的荧光探针Rd-DPA3,其表现出优异的灵敏度和选择性。在细胞水平上,Rd-DPA3能够靶向线粒体并监测活细胞中ONOO-浓度在氧化应激过程的变化。此外,由于Rd-DPA3优异的BBB穿透能力,首次在AD小鼠模型的大脑中成功实现了ONOO-浓度波动的实时体内成像,并证明了阿尔茨海默症(AD)小鼠大脑中ONOO-含量会随年龄的增长呈现依赖性积累。该研究结果有力地支撑了ONOO-可以作为AD的生物标志物,进一步促进了我们对AD诊断和治疗的认识,为新型ONOO-探针设计和AD诊断提供了新的方向。
文献详情:

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn