

(图片来源:J. Am. Chem. Soc.)
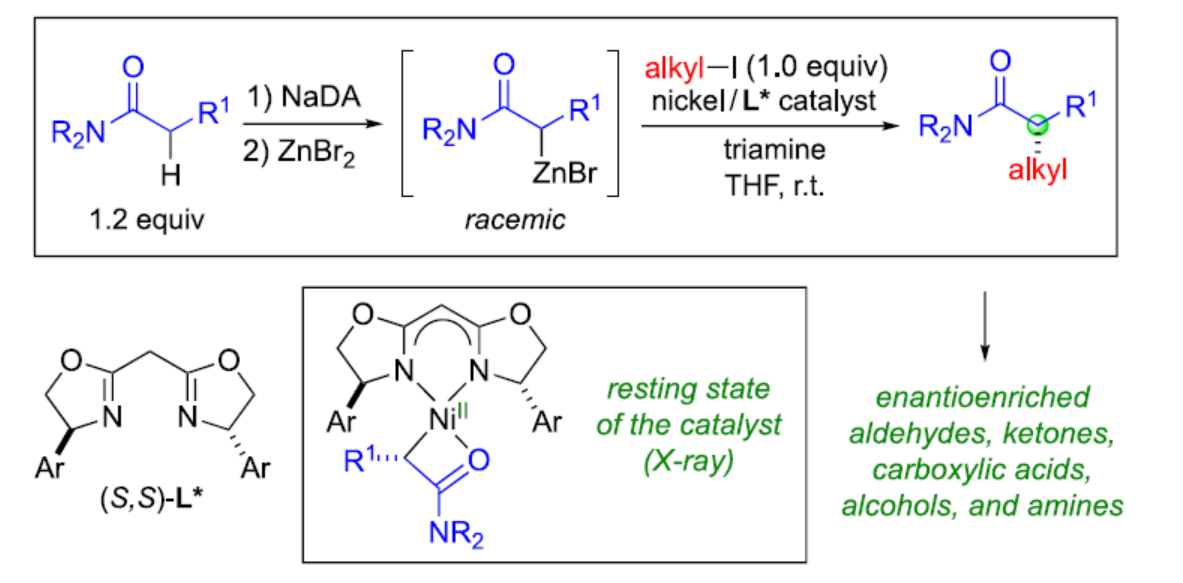
含有α-手性中心的羰基骨架广泛存在于各类生物活性分子中,因此对于此类骨架的构建一直是有机合成的长期目标(Figure 1A)。烯醇化物的α-烷基化反应是构建此类化合物最为直接的方法。目前,Evans、Myers等团队通过使用化学计量的手性辅助剂,实现了羰基衍生物的非对映立体选择性α-烷基化反应(Figure 1B)。然而,通过使用手性催化剂实现对映选择性α-烷基化反应仍有待进一步的研究。此外,对于不对称催化α-烷基化反应,主要集中于一些特定的底物。近日,加州理工学院Gregory C. Fu课题组报道了一种镍催化酰胺与非活化烷基亲电试剂的催化对映选择性α-烷基化反应,合成了一系列含有α-手性中心的酰胺衍生物,涉及外消旋Reformatsky试剂的形成过程(Figure 1C)。同时,通过后期衍生化实验,可获得一系列具有价值的手性化合物
(图片来源:J. Am. Chem. Soc.)
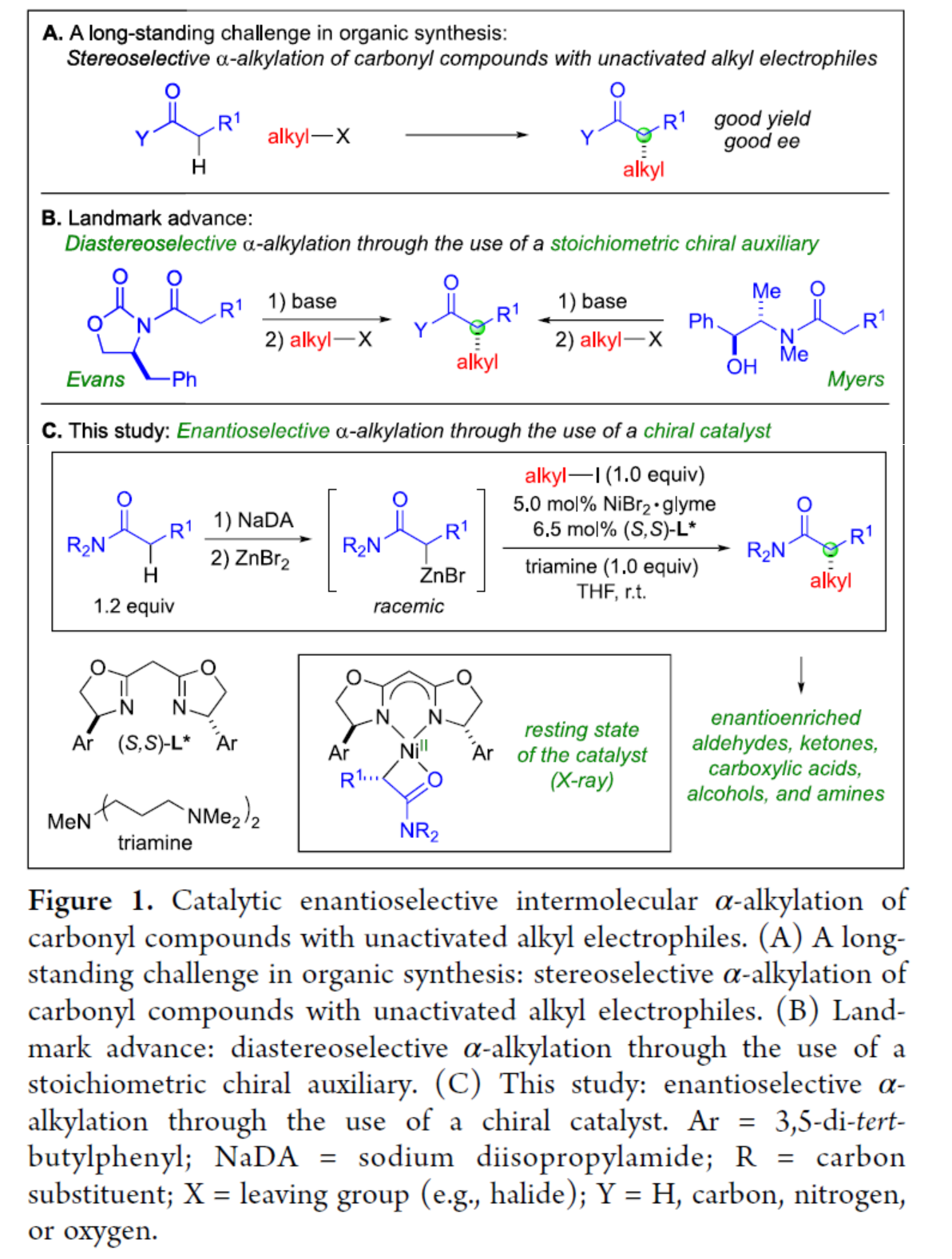
最初,作者采用外消旋Reformatsky试剂作为亲核试剂,在Method A条件下与烷基碘进行反应,合成了一系列手性α-烷基化产物。随后,作者采用酰胺为底物,通过去质子化生成相应Reformatsky试剂,再经原位镍催化的不对称α-烷基化反应,可通过一锅法,以相似的收率和对映选择性获得手性α-烷基化产物。同时,在对底物范围扩展时发现(Figure 2A),当酰胺底物R1为各种烷基时,均可顺利反应,获得相应的产物1-9,收率为33-92%,ee为71-94%。其中,对于氮杂环丁烷带有手性中心的底物,反应的立体化学不受影响,如产物8和9。其次,一系列非活化的烷基碘底物,均与体系兼容,获得相应的产物10-23,收率为38-88%,ee为90-94%。其中,克级规模实验,同样能够获得与小试相似的结果,如10。此外,合成的手性α-烷基化产物可进一步转化为一系列对映体富集的化合物,如羧酸、醇、醛、酮和胺的衍生物(Figure 2B)。
(图片来源:J. Am. Chem. Soc.)
紧接着,作者对反应的机理进行了研究(Figure 3)。首先,通过对外消旋有机锌亲核试剂Zn-2的晶体学分析揭示了固态二聚羰基-桥接的C-金属化结构(Figure 3A)。二聚体Reformatsky试剂是异手性(heterochiral)的,具有手性中心碳的C2-C3-C4、C2-C3-Zn1和C4-C3-Zn1键角范围为106°-115°。同时,通过NMR对Reformatsky试剂的研究发现,Zn-2的结构与C-金属化结构一致,与O-结合的锌烯醇化物不一致。在红外光谱中,Zn-2在1597 cm-1处具有明显的吸收峰,归因于羰基的C=O拉伸。其次,通过紫外-可见光谱发现,NiC是偶联反应过程中催化剂的静止状态(Figure 3B)。同时,UV-vis光谱显示λmax = 449 nm,作者认为镍(II)配合物可能是造成这种吸光度的原因。因此,作者合成了镍(II)配合物(Figure 3C)。NiA经LiHMDS处理,可获得98%收率的NiB,并且显示出不同于催化偶联的UV-vis光谱,但与使用一当量Reformatsky试剂Zn-2与NiA反应时生成的光谱基本相同,从而表明在催化开始时通过Zn-2对NiA的去质子化形成了NiB。NiB可进一步反应,生成NiCEt和NiCOMe配合物。这两种烷基镍(II)配合物的紫外可见光谱与催化偶联的光谱非常相似,并与这种配合物在反应过程中处于催化剂的静止状态是一致的。同时,作者还对NiCOMe配合物进行了相关的X-射线晶体结构分析。通过1H NMR对NiCEt的分析表明,在α-碳上存在两种差向异构体,比例为4:1。NOESY实验表明,主要的非对映异构体有利于在α-碳上形成S构型。此外,非对映异构体(S与R)可相互转化,可使差向异构体的混合物(4:1)以高对映选择性获得相应的α-烷基化产物。
(图片来源:J. Am. Chem. Soc.)
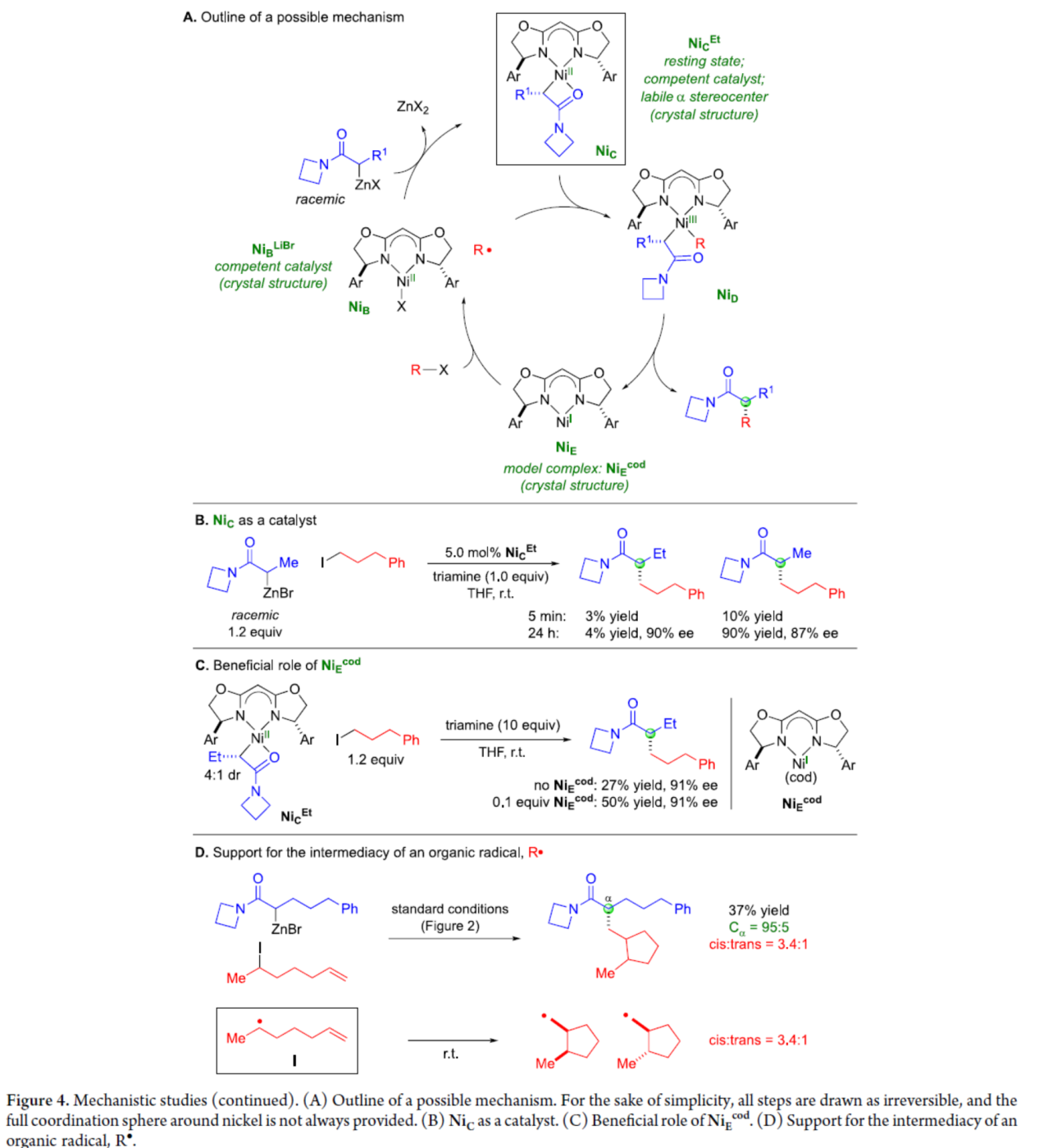
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 4A)。首先,NiBr2·glyme、L*和Reformatsky试剂反应生成NiC,这是镍在催化偶联过程中的静止状态。镍(I)金属自由基NiE从亲电试剂(R-X)中攫取一个卤原子,得到烷基自由基(R•)和NiB(可与Reformatsky试剂反应生成NiC)。烷基自由基R•与NiC偶联,生成二烷基镍-(III)配合物NiD。NiD经还原消除,可生成对映体富集的α-烷基化产物并再生镍(I)配合物NiE。
其次,当使用了NiCEt作为催化剂的对比实验表明,NiCEt和Reformatsky试剂之间的有机基团交换相对于NiCEt形成碳-碳键的速率,并未迅速发生(Figure 4B)。在NiCEt与烷基亲电试剂的反应体系中加入NiEcod时,反应的收率明显提高,表明NiEcod配合物可促进碳碳键的形成(Figure 4C)。此外,当使用6-碘庚烯与Reformatsky试剂的反应,进一步证明了反应形成了有机自由基中间体R•(Figure 4D)。
(图片来源:J. Am. Chem. Soc.)
总结:加州理工学院Gregory C. Fu课题组报道了一种使用手性镍催化剂,实现了外消旋Reformatsky试剂与非活化烷基亲电试剂的对映汇聚性偶联反应,合成了一系列含有α-手性中心的酰胺衍生物。同时,使用酰胺底物,通过一锅法也可实现相应手性产物的合成。同时,该反应具有良好的官能团兼容性,且通过后期衍生化实验可获得一系列具有价值的手性化合物(对映选择性不受影响)。机理研究表明,反应涉及烷基镍(II)静止状态关键中间体的形成。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn