

由于其独特的物理化学和生物性质,含氟分子在制药、农业和材料化学中得到了广泛的应用。例如,含三氟甲基取代基手性碳中心的有机化合物广泛存在于各种生物分子中,因此,发展有效的手段来获取含有氟烷基取代基的手性分子是一个饱受关注的研究领域。
对映体富集的有机硼酸酯是不对称合成的通用试剂,因为它们可以进行各种立体定向转化,而不损失或最小损失其对映体纯度。在手性氟烷基化合物中引入C-B键将大大丰富其合成用途。氟烷基取代烯烃的催化硼氢化或直接硼化是制备氟烷基有机硼酸盐的一种直接方法。Hoveyda课题组发现可以用不对称铜催化的α-三氟甲基苯乙烯与B2pin2的硼化反应制备手性β-三氟甲基烷基硼酸酯,但其中β-氟消除反应生成的偕二氟烯基硼酸酯为主要产物。因此,有效抑制β-氟消除是发展Cu-Bpin与三氟甲基取代的碳碳双键对映选择性加成的关键。天津大学张淳课题组利用带有β-氟原子的烯丙基铜中间体(I)与另一个不含β-氟原子的烯丙基铜物种(II)的快速σ - π - σ异构化,开发了含CF3的1,3-二烯的Cu-催化不对称硼化反应。此外,还有课题组利用手性铱催化剂尝试了α-三氟甲基苯乙烯与HBpin的硼氢化反应,但其化学选择性较低、对映选择性差。因此,开发原子经济和对映选择性高的方法从氟烷基取代的烯烃中获得手性氟烷基有机硼酸酯仍然是一个挑战。
近年来,化学家们发展了一系列利用手性钴、铁、铜配合物等金属催化剂催化1,1-二取代烯烃与HBpin的不对称硼氢化反应制备手性烷基硼酸酯的方法。氟烷基取代的烯烃向金属氢化物或金属硼基中间体的迁移插入是金属催化硼氢化反应的关键步骤,图1D描述了CF3取代的烯烃向Co-H和Co-Bpin键迁移插入的可能途径。CF3取代的烯烃发生1,2-插入到(L)Co-H或(L)Co-Bpin后将生成氟原子位于其γ-碳原子上的烷基钴中间体III或IV,这有助于抑制氟的消除。而当该烯烃2,1-插入到(L)Co-H或(L)Co-Bpin物种后则会形成氟原子位于β-碳原子上的中间体V和VI,这有助于发生β-氟消除的去氟转化。因此,确定能够促进烷基钴中间体III或IV形成的合适配体对开展钴催化氟烷基取代烯烃的硼氢化反应至关重要。在此,作者报道了一种钴催化的氟烷基取代烯烃的不对称硼氢化反应以获得具有氟烷基化手性碳中心的烷基硼酸酯。此外,作者还表明,手性β- CF3取代的烷基硼酸酯可以很容易地以立体定向的方式转化为各种含有CF3取代的手性碳中心的化合物。
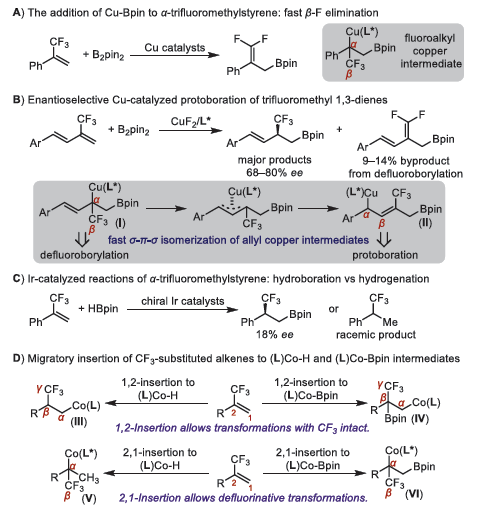
图1. 研究背景(图片来源:J. Am. Chem. Soc.)
据报道,含有亚氨基吡啶噁唑啉配体的钴和铁配合物催化1,1-二取代乙烯芳烃的不对称硼氢化反应具有很高的对映选择性。因此,作者首先评估了这些钴和铁催化剂在报道的条件下用于α-三氟甲基苯乙烯1a的硼氢化反应,以确定其是否同样适用于氟烷基取代烯烃的类似反应。结果表明1a在(L1)CoCl2或(L2)FeCl2催化下与HBpin反应,得到的主要是偕二氟烯烃2a。可以看出,在相同条件下,CF3基团取代α-甲基苯乙烯上的甲基完全改变了其与HBpin反应的选择性。此外,作者尝试了以Co(acac)2和其他配体L3、L4为催化剂的硼氢化反应,但这两个反应主要产物也是2a。在这些反应的粗混合物中,GC-MS没有检测到氟烷基硼酸4a。因此,亟需寻找新的手性催化剂以用于氟烷基取代烯烃的不对称硼氢化反应。
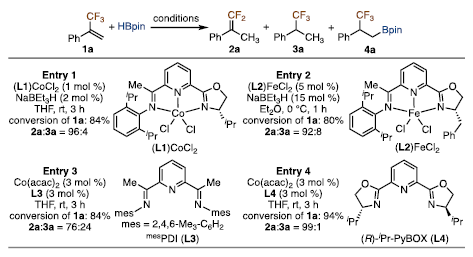
图2. 配体筛选1(图片来源:J. Am. Chem. Soc.)
烯烃和金属配合物的性质都影响烯烃插入活性有机金属中间体的区域选择性。结合最近的工作,作者发现,Co(acac)2在xantphos存在下与HBpin反应形成钴氢物种,随后可在氢受体(如降冰片烯)存在下转化为钴硼基中间体。经过尝试作者发现,Co(acac)2和xantphos催化1a与HBpin的反应选择性地生成β-三氟甲基烷基硼酸酯4a,产率为72%。与之前的N3-钳形配体相比,xantphos配体由于每个磷原子上都有两个苯基而对空间要求更高,并且xantphos与1a的苯基/CF3基团之间的空间斥力使1a更有利于发生1,2-插入。
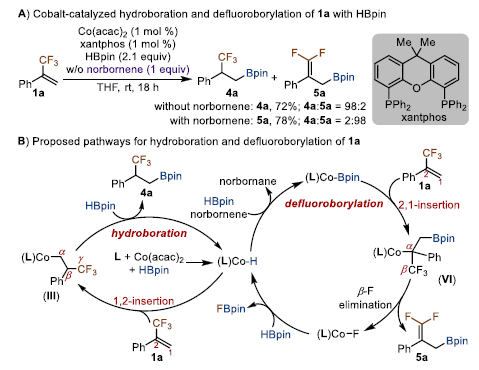
图3. 配体筛选2及反应机理(图片来源:J. Am. Chem. Soc.)
在建立了α-三氟甲基苯乙烯1a选择性硼氢化条件后,作者在筛选了各种手性膦配体后确定了不对称硼氢化反应的条件,即烯烃1a在3 mol% Co(acac)2,4 mol% (R)-BTFM-Garphos (L5)和30 mol % Li(acac)条件下,2-Me-THF为溶剂,在室温下与1.2当量HBpin反应,能以82%产率和92% ee得到目标产物。
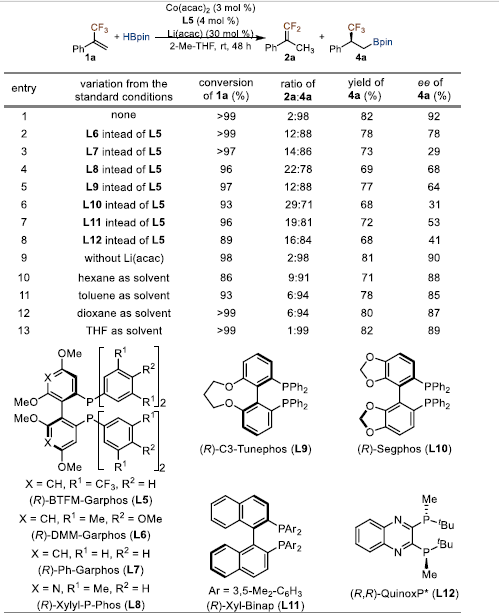
图4. 条件筛选(图片来源:J. Am. Chem. Soc.)
有了最佳反应条件,作者探索了含氟烷基化烯烃用于钴催化不对称硼氢化反应的底物范围。在上述条件下,α-CF3-取代乙烯基芳烃(1b ~ 1ac)与HBpin反应顺利,生成相应的手性β-三氟甲基化烷基硼酸酯(4b ~ 4ac),产率54 ~ 86%,84 ~ 98% ee。含其他氟烷基基团的氟烷基化烯烃同样反应结果良好,反应官能团兼容性高,普适性好。
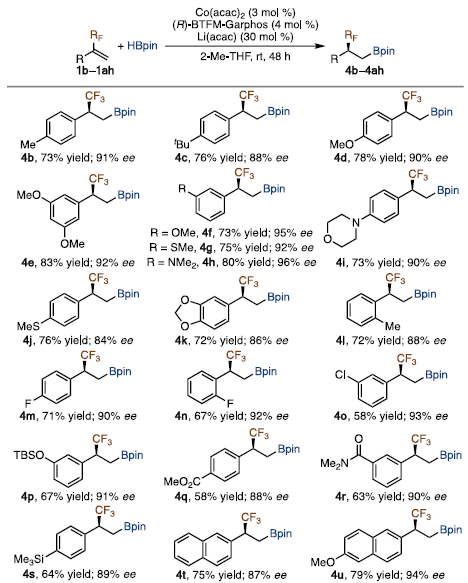
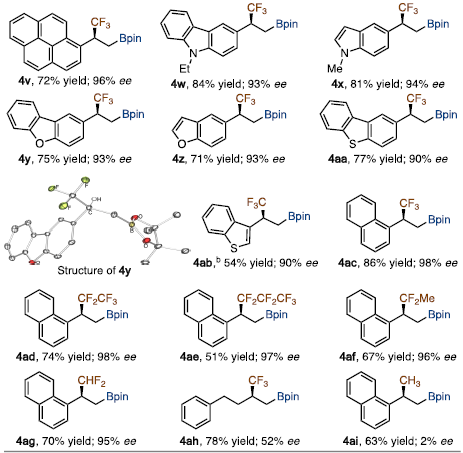
图5. 底物拓展(图片来源:J. Am. Chem. Soc.)
为了展示该方法的应用前景,作者在催化剂负载量为2 mol%的情况下,对三氟甲基化烯烃1ac进行了克级规模不对称硼氢化反应,并得到手性烷基硼酸4ac,收率为78%,ee为96%。此外,作者用一系列后续实验证明4ac可以在不损失对映体纯度的情况下进行各种立体转化,从而得到各种对映体富集的三氟甲基化合物,而这些化合物很难从现成的原料中获得。
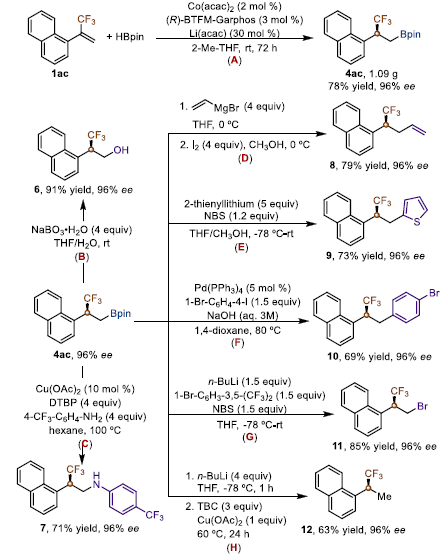
图6. 反应应用(图片来源:J. Am. Chem. Soc.)
总结:
葛少中课题组开发了钴催化氟烷基末端烯烃与HBpin的选择性去氟硼化和硼氢化反应,并且实现了钴催化的氟烷基末端烯烃不对称硼氢化反应。多种含氟烷基化烯烃在Co(acac)2和(R)-BTFM-Garphos存在下与HBpin反应,高产率、高对映选择性地生成了相应的含氟烷基的手性硼酸酯。反应生成的手性烷基硼酸酯可以很容易地通过对其C-B键的官能团转化,以立体定向的方式得到各种手性分子。因此,该不对称硼氢化反应为制备各种手性有机氟化合物提供了一条重要途径。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn