

图片来源:Nat. Commun.
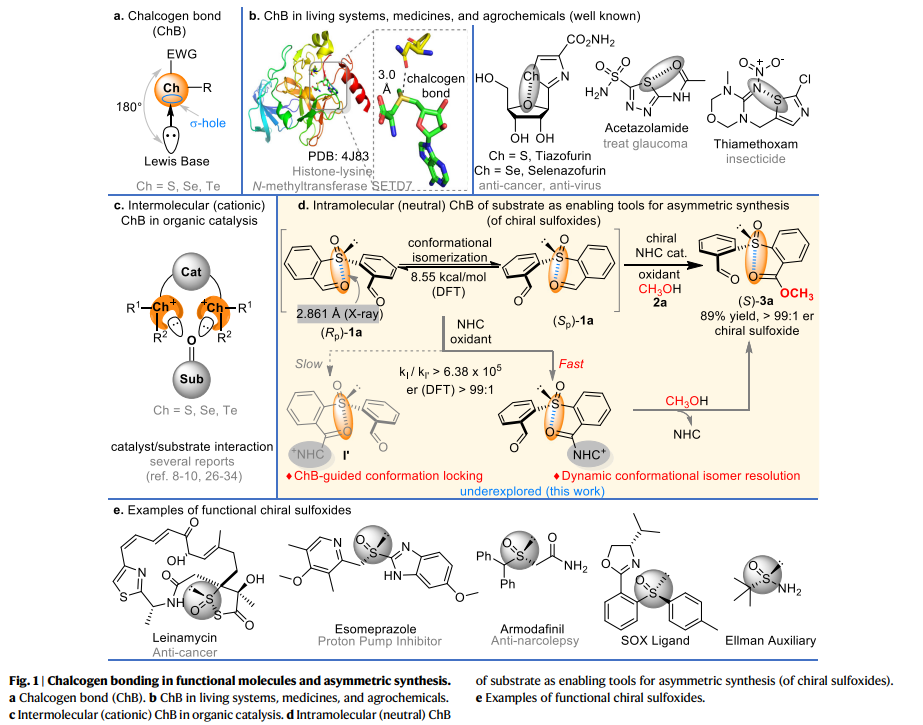
硫族元素键(ChB)是硫族元素(S、Se、Te)与路易斯碱之间的一类新型弱非共价相互作用(fig. 1a)。近年来,由于其在生命系统、药物化学、农药等领域的特殊作用(fig. 1b),引起人们的广泛关注。与多种功能分子设计相比,ChB在有机合成中的探索却十分少见(fig. 1c),可能的原因是,在合成反应中形成催化剂和底物之间的ChB络合物较为困难。近日,贵州大学的池永贵、郑鹏程团队将分子内ChB相互作用用于底物的构象调节和选择性化学转化之中。在这项工作中,作者研究了ChB在亚磺酰基二苯甲醛化合物的反应性中的作用,主要是通过分子ChB引导的底物构象异构化来实现NHC催化氧化亚砜的动态动力学拆分(fig. 1d),从而合成了一系列的手性亚砜化合物。作者通过1a的固态X-射线结构分析揭示了底物中硫和氧原子之间存在ChB,而ChB破坏了1a的对称性,因此使1a这种对称的亚砜以两种对映异构体的外消旋混合物形式存在。同时,作者通过DFT计算,两种异构体互相转化的活化能为8.55 kcal/mol。值得注意的是,手性亚砜化合物已经广泛用于药物、农用化学品以及不对称催化的配体(fig. 1e),这使该反应合成的产物具有后续应用的可能性。
图片来源:Nat. Commun.
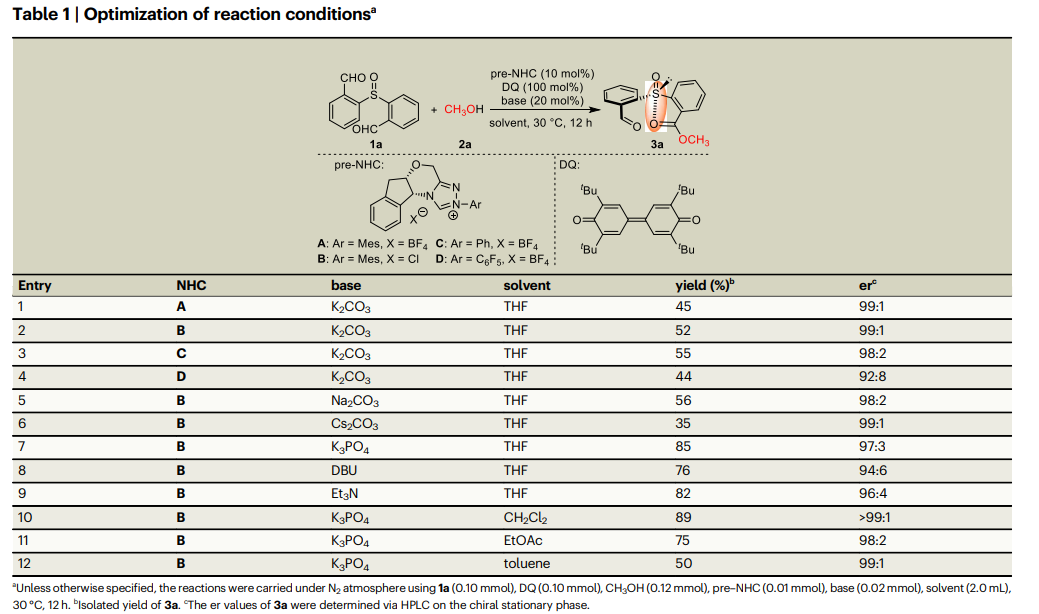
首先,作者选择1a作为模型亚砜底物,甲醇2a作为亲核试剂来寻找最优反应条件,探索了NHC预催化剂与联苯醌(DQ)作为氧化剂将1a的一个醛基转化为酯单元。通过一系列的筛选得到最优条件:使用NHC预催化剂B,以K3PO4为碱,溶剂为CH2Cl2的条件下,产物3a可以达到89%的收率和超过99:1的er值(table 1)。
图片来源:Nat. Commun.
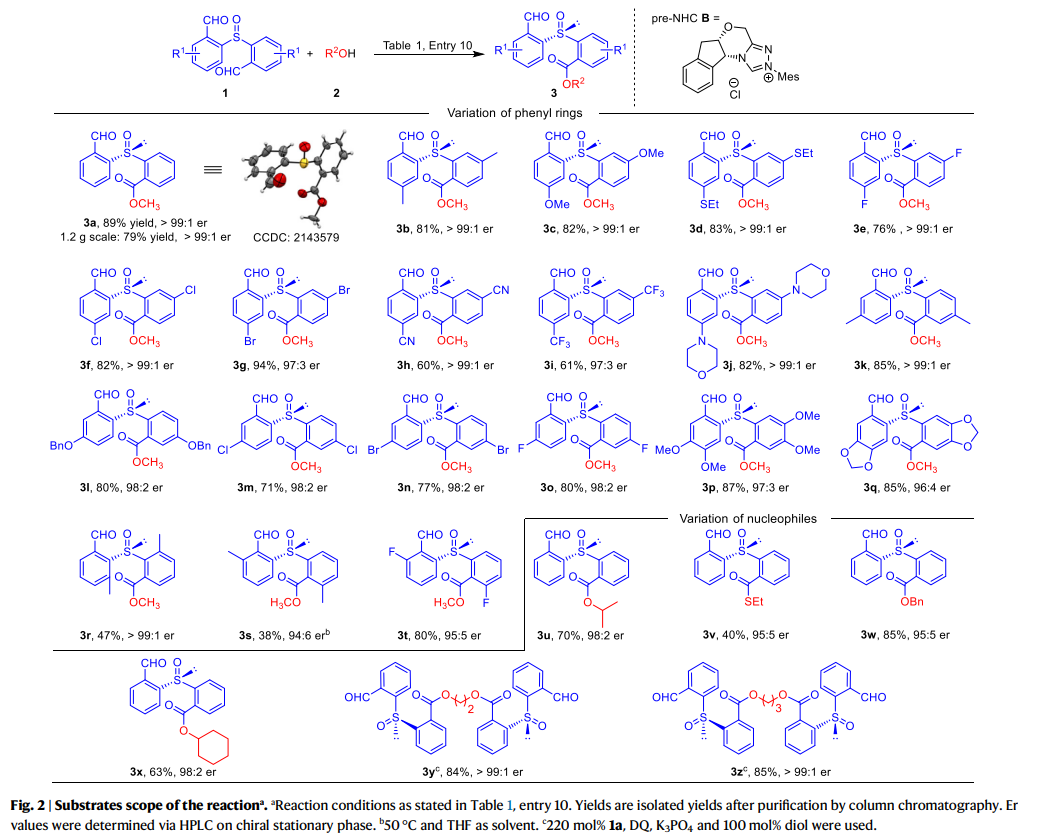
作者接下来对研究反应的普适性进行了考察(fig. 2)。在1a的苯环对位(相对于醛基)更换不同取代基,单酯产物都获得了优异的er值(3b-3j)。当取代基为甲基(3b)、甲氧基(3c)、乙硫基(3d)或卤素(3e-3g)时,反应产率良好,相应的产物产率为60-94%。当使用吸电子取代基(例如CN、CF3)时,产物(3h, 3i)的产率略低 (60%和61%),同时保持了优异的er值。其反应主要副产物来自3h和3i的进一步酯化,得到相应的二酯化合物。各种取代基(如Me、OBn和卤素)也可以在1a苯环上的间位碳上,并不会影响反应产率和er值(3k-3o)。值得注意的是,在1a的对位和间位碳上具有双取代基的底物同样具有良好的兼容性(3p, 3q)。当甲基在1a的邻位时,反应产率和er值却均有下降(3s)。3s的低产率主要是由于形成二酯,er值下降的原因可能是空间位阻。邻位的氟取代产物3t,产率为80%,er为95:5。在1a的邻位碳(相对于亚砜)上甲基取代时会使3r的er值超过99:1,但产率降低到47%。此外,各种醇、硫醇和仲醇也可作为有效的亲核试剂(3u-3x)。有趣的是,当二醇用作亲核试剂时,两个羟基都可以被酰化,得到相应的手性二亚砜,具有优异的产率和er值(3y, 3z)。这些结果表明,这种策略可以进一步发展,将手性亚砜连接到含有多个羟基单元的功能分子(如天然产物和聚合物)上。
图片来源:Nat. Commun.
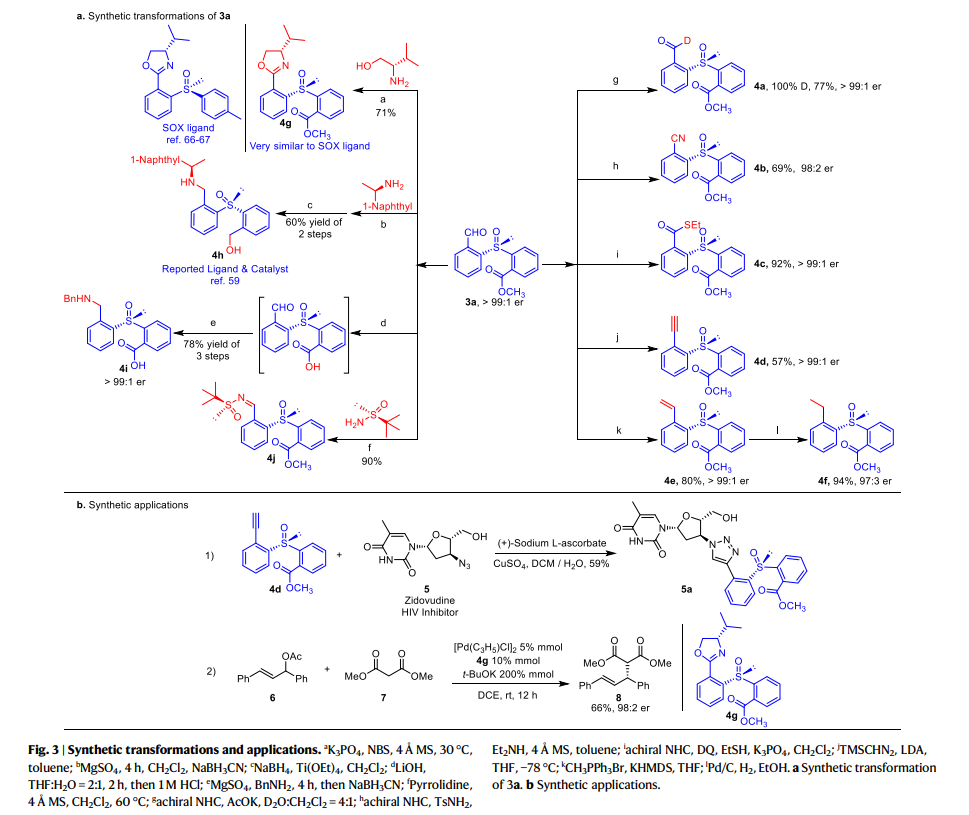
同时,作者还对该反应产物的衍生化应用进行了研究(fig. 3)。首先对3a中的醛基进行进一步的转化。例如,醛氢在D2O存在下催化氘化得到4a,甲酰基催化的氰化得到4b,硫酯化得到4c,其er值均得到了保持。不仅如此,作者还通过Seyferth-Gilbert反应和Wittig 反应合成了4d和4e,通过对4e还原合成了4f。同时,3a与L-缬氨醇反应生成的噁唑啉4g与SOX配体十分相似。值得注意的是,衍生合成的手性亚砜4h及其类似物是已知不对称合成中的手性配体和催化剂,其可以很容易地通过还原胺化反应从3a及其类似物合成。此外,3a经历酯基的水解和与BnNH2的还原胺化可以得到的非天然氨基酸4i,与Ellman助剂缩合可以有效地获得手性二亚砜产物4j。除产物衍生之外,4d可以与具有叠氮基的抗 HIV 药物(齐多夫定)缀合,生成 5a。4g则可以作为手性配体,在Pd-催化的烯烃6和丙二酸酯7的取代反应中得到手性控制出色的产物8 (98:2 er)。
图片来源:Nat. Commun.
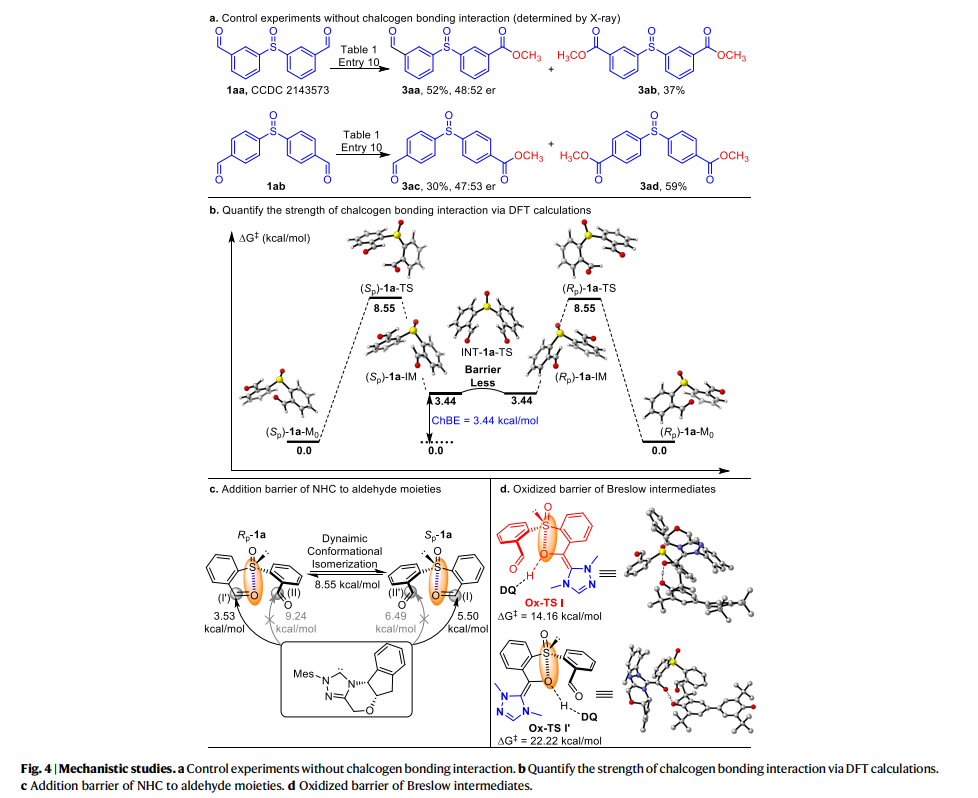
作者还对机理进行了进一步的研究(fig. 4)。作者通过(1aa, 1ab) 的控制实验表明远程醛基没有显示出ChB相互作用(fig. 4a),使用DFT计算研究了亚砜和甲酰基之间的硫族元素键合强度(fig. 4b),发现参与硫属元素键合相互作用的醛基部分是构象锁定和弱激活的。这些构象锁定的醛基与NHC催化剂的反应速度(ΔG‡ = 5.50, 3.53 kcal/mol)比没有硫属元素键合的醛基(ΔG‡ = 6.49, 9.24 kcal/mol)更快。同时,低旋转势垒表明1a的构象可以在室温下经历快速的相互转化,这使实现NHC催化的动态动力学拆分成为可能。进一步的DFT研究表明,Breslow中间体的氧化步骤(fig. 4d)是手性确定步骤。
总结 池永贵、郑鹏程团队报道了一种用于合成手性亚砜的NHC催化的动态动力学拆分反应。该方法利用底物分子中的硫族元素键来引导底物的构象异构化,借NHC催化氧化来实现手性亚砜化合物的合成。该反应生成的手性亚砜产物可以作为平台分子,直接转化为功能化合物,应用于催化和生物学研究。该反应为反应控制和不对称合成开辟了一条新途径。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn