

在过去的几十年里,利用氟独特性质的合成方法得到了广泛发展。通常含氟底物显示出与非氟化对应物不同的反应模式。在这方面,C-F键的选择性转化为难以合成的具有结构多样性的脱氟化合物提供了一个新的策略。同时包含烯基单元和氟取代烷基的烯丙基氟化物代表了一类重要的有机氟化物。与其它有机卤化物相比,它们表现出独特的反应性和选择性。首先,与氟烷基相连的 π 侧链体系会显著降低相关的脂肪族 C-F 键解离能,因此在温和条件下易于其裂解。其次,氟烷基取代基的固有电子特性和空间效应使 C-C 双键容易受到亲核进攻或自由基加成,随后发生 β-氟消除,从而在烯丙基上引入具有多种功能性的基团。此外,当引入具有两个亲核中心的功能性试剂时,可以通过一锅法或两步法进行连续的C-F键取代反应完成环化。
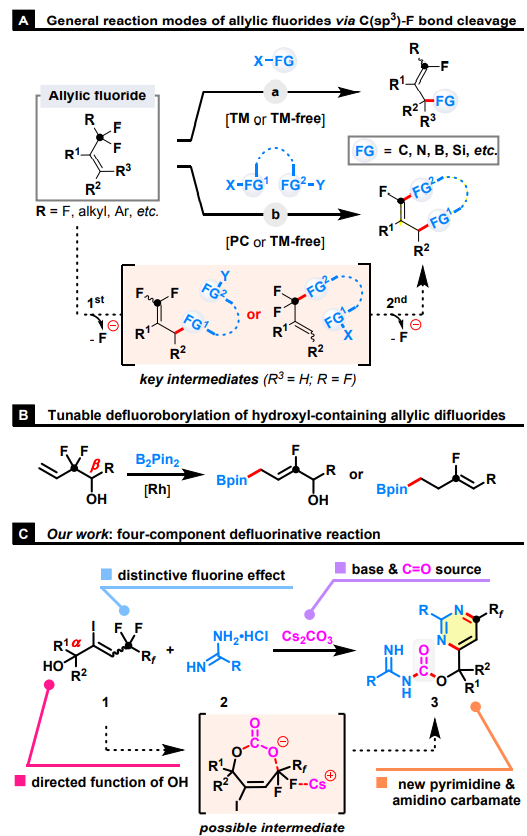
图1. 研究背景及本文的工作(图片来源:Green Chem.)
受上述反应的启发,作者利用两个惰性烯丙基C(sp3)-F键断裂来组装复杂的脒基甲酸酯(图1)。这种多键形成串联策略是通过在温和的反应条件下使用含羟基的烯丙基氟化物、脒和Cs2CO3巧妙实现的。合成的关键可归因于原位生成的碳酸根阴离子对C-F键活化的引导功能。此外,全氟烷基还发挥活化作用以调节 C-C 双键和烯丙基 C-F 键的反应性。这项工作具有几个明显的优势:(1)能够以高效的四组分反应从“易于制备”的起始原料中区域选择性地提供“难以制造”的氟化产物;(2)利用惰性C-F键的转化,构建具有四个新的C-N/C-O键和一个六元杂环结构;(3)使用Cs2CO3作为廉价、绿色和易得的CO等价物,避免了极其危险、易燃、易爆和有毒的一氧化碳气体或其它敏感试剂的参与;(4)一种无催化剂和无添加剂的反应,底物范围广,操作简单,步骤经济,满足绿色化学的要求。
作者以5,5,6,6,7,7,8,8,8-九氟-3-碘-2-甲基-3-辛烯-2-醇(1a)和苯甲脒盐酸盐(2a)作为模板底物,通过对温度、碱、溶剂和时间的筛选,最终发现以Cs2CO3作为羰基源和碱,DMA作溶剂,室温下反应24小时可以89%的分离收率得到目标嘧啶杂环脒基甲酸酯化合物(图2)。
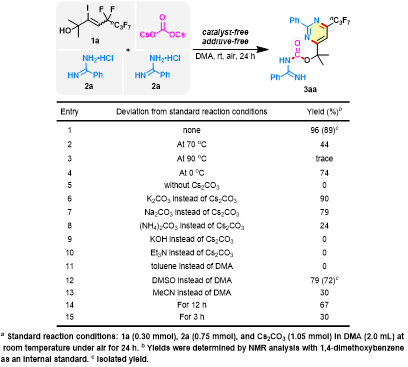
图2. 条件优化(图片来源:Green Chem.)
在最优反应条件下,作者系统研究了底物适用范围(图3)。首先,研究了脒类盐酸盐上取代基的影响,以5,5,6,6,7,7,8,8,8-九氟-3-碘-2-甲基-3-辛烯-2-醇(1a)作为反应底物,带有不同基团的苯基甲脒盐酸盐,包括甲氧基、乙氧基、甲基、卤素、硝基和氰基等,都能以中等至良好的收率获得相应的嘧啶杂环脒基甲酸酯化合物(3aa-3ak),说明苯甲脒芳环上具有不同电性(给电子或吸电子)或空间位阻要求(对位、间位和邻位)的取代基不影响反应性能。噻吩基、环丙基取代的脒类盐酸盐也能顺利完成该转化,得到相应产物(3al-3am)。同时分离出无环状结构的脒基甲酸酯3al',猜测是脱氟过程中形成的可能中间体。
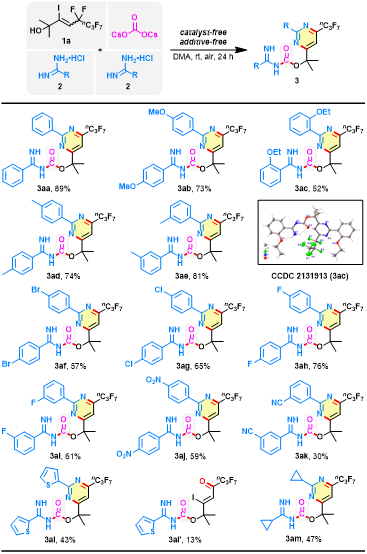
图3. 底物扩展一(图片来源:Green Chem.)
作者进一步探索了α-位羟基烯丙基氟化物的底物适用范围(图4)。4~10个碳的全氟烷基链长度对反应结果的影响较小,均能得到嘧啶杂环脒基甲酸酯化合物(3ba-3da)。但是具有三氟甲基的烯烃(1e)未能产生任何单氟化产物(3ea),这可能是由于三个氟原子的屏蔽特性所致。其它具有与羟基相邻的全取代碳手性中心的烯丙基氟化物(1f-h)已成功应用于当前的脱氟转化。虽然1i 和1j 反应收率较低,但相应的产物3ia和3ja很难通过常规方法合成得到。此外,1k、1l和1m也是合适的反应底物,均能顺利反应。
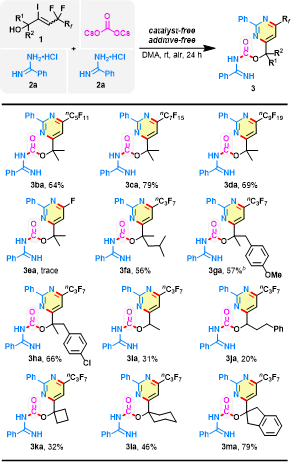
图4. 底物扩展二(图片来源:Green Chem.)
随后,作者尝试将模板反应放大至克级规模(图5),在克级规模下没有出现明显产率下降。作者还对3aa进行了部分衍生化,在PhINTs 或 TfOH 存在的情况下,氧化胺化和水解顺利进行,提供潜在的药物分子4和5。
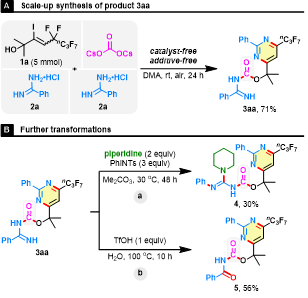
图5. 规模化合成及合成应用(图片来源:Green Chem.)
为了揭示反应机理,作者进行了一系列控制实验(图6)。首先,增加羟基和C-C双键之间的束缚烷基链的长度(1n),反应结束后没有检测到预期的产物3na。其次,将简单的叔醇1o或预合成的杂环醇1p作为反应底物,反应结果被证明是无效的。这些结果表明:(1)全氟烷基对CO捕获很重要;(2)杂环醇1p不是真正的中间体,即脒2与含羟基的烯丙基氟化物1的竞争缩合可能不参与反应过程;(3) 排除了自由基中间体的存在,因为在模板反应中加入自由基捕获剂TEMPO并没有抑制脱氟官能化。
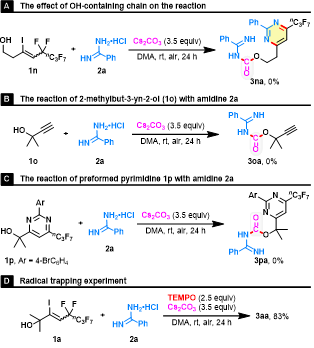
图6. 机理研究(图片来源:Green Chem.)
在这些控制实验和先前报道的 C-F 键活化的基础上,作者提出了一种合理的机制(图7)。首先,含羟基的烯丙基氟化物1与Cs2CO3 反应生成活性的非环碳酸酯 A,该碳酸酯在亲氟 Cs+ 的帮助下通过亲核脱氟取代进行分子内环化,生成不稳定的B。物种B可以通过HRMS分析检测得到。另外,靠近羟基部分的空间拥挤的季碳中心有利于转化也说明反应可能经历环状中间体。此外,多氟烷基独特的氟效应对烯丙基 C-F 键的活化起着至关重要的作用。生成的B在碱性条件下被脒2亲核进攻,随后消除氟原子以形成开环的脒基甲酸C。接下来,中间体C与另一分子脒2通过中间体 D-E完成缩合、脱碘和芳构化形成相应的氟化产物3。
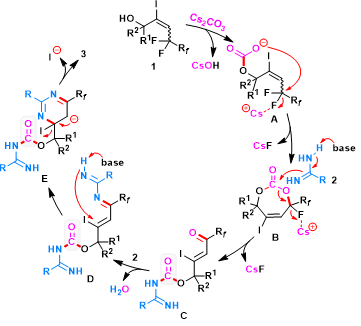
图7. 可能的反应机理(图片来源:Green Chem.)
总结 褚雪强、沈志良团队开发了一种在无过渡金属条件下的烯丙基氟化物、脒和Cs2CO3的四组分脱氟反应。以中等至良好的收率合成了多种有用且具有潜在生物活性的含嘧啶环的脒基甲酸酯化合物,反应具有良好的官能团耐受性。该串联方法涉及两个烯丙基C(sp3)-F键官能团化、Cs2CO3作为绿色羰基源提供CO单元、形成四个新的C-N/C-O键和一个六元嘧啶环结构,提供了一种新的合成高度官能团化的脒基甲酸酯衍生物方法。此外,所得产物可以转化为多种含氟化合物。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn