


(图片来源:J. Am. Chem. Soc.)
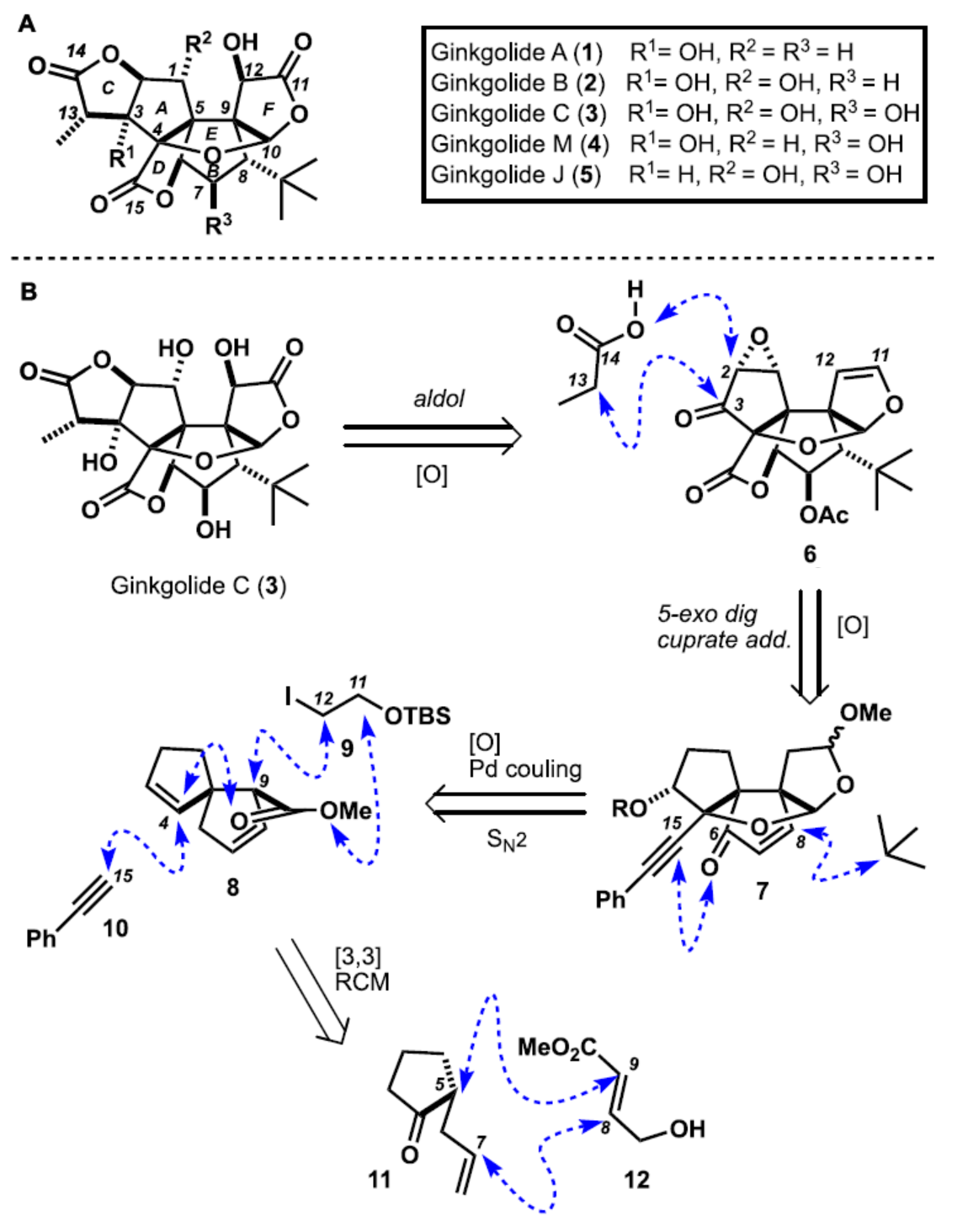
Ginkgolides是从银杏树的叶子和根皮中分离出来的复杂多氧二萜类化合物(Figure 1A)。1932年,Furukawa课题组首次分离出Ginkgolides A(1)、B(2)、C(3)和M(4)。直至1967年,Nakanishi课题组才阐明了它们的结构。1987年,Weinges课题组发现、分离和表征了Ginkgolide J(5)。最近,王莹和彭国平课题组分别分离了Ginkgolides K、L、P和Q。Ginkgolides,尤其是Ginkgolide B(2),是血小板聚集受体(PAFR)的强拮抗剂,而PAFR是一种在急性和慢性炎症中起作用的强效炎症因子。据报道,Ginkgolides可作为中枢神经系统疾病的有效疗法,如阿尔茨海默病和帕金森病以及多发性硬化症,它也可用于预防偏头痛。
Ginkgolides具有紧凑且高度氧化的多环分子骨架,包括六个五元环、两个相邻的季碳中心和一个不寻常的叔丁基。尽管它们的治疗效果显著,但它们令人生畏的结构对化学合成提出了重大挑战,仅有少数的合成研究,如Corey与Crimmins课题组报道Ginkgolides B(2)与A(1)的全合成。据文献查阅,目前尚未有Ginkgolide C(3)的全合成报道,这是该家族中最复杂的二萜,它具有12个连续的立体中心和11个含氧碳(oxygenated carbons)。近日,加拿大渥太华大学Louis Barriault课题组报道了一种Ginkgolide C的首次全合成以及Ginkgolides A和B的形式全合成。
通过逆合成分析发现(Figure 1B),Ginkgolide C(3)可由中间体6通过羟醛反应在C3-和C13-位之间形成C-C键并在C1-、C3-、C11-和C12-位发生氧化反应获得。中间体6将可通过烯酮7中C15-位炔烃的5-exo-dig环化以及C8-位立体选择性铜酸盐加成获得。烯酮7是合成Ginkgolides A(1)、B(2)和C(3)的关键中间体。使用苯乙炔10(C14-C15)进行Sonogoshira偶联反应,然后在螺烷8(C9-C12)上用9进行烷基化,从而实现连续季碳中心的构建。钯催化的偶联反应不仅可用于构建D-环内酯,还可用于创建有利于在螺烷8的C9-位进行非对映选择性亲核加成的空间环境。螺烷8很容易从市售的酮11和烯丙醇12制备,通过Claisen重排确保C5-位的第一个季碳中心以及C7-和C8-位之间的闭环复分解(RCM)形成B-环。
(图片来源:J. Am. Chem. Soc.)
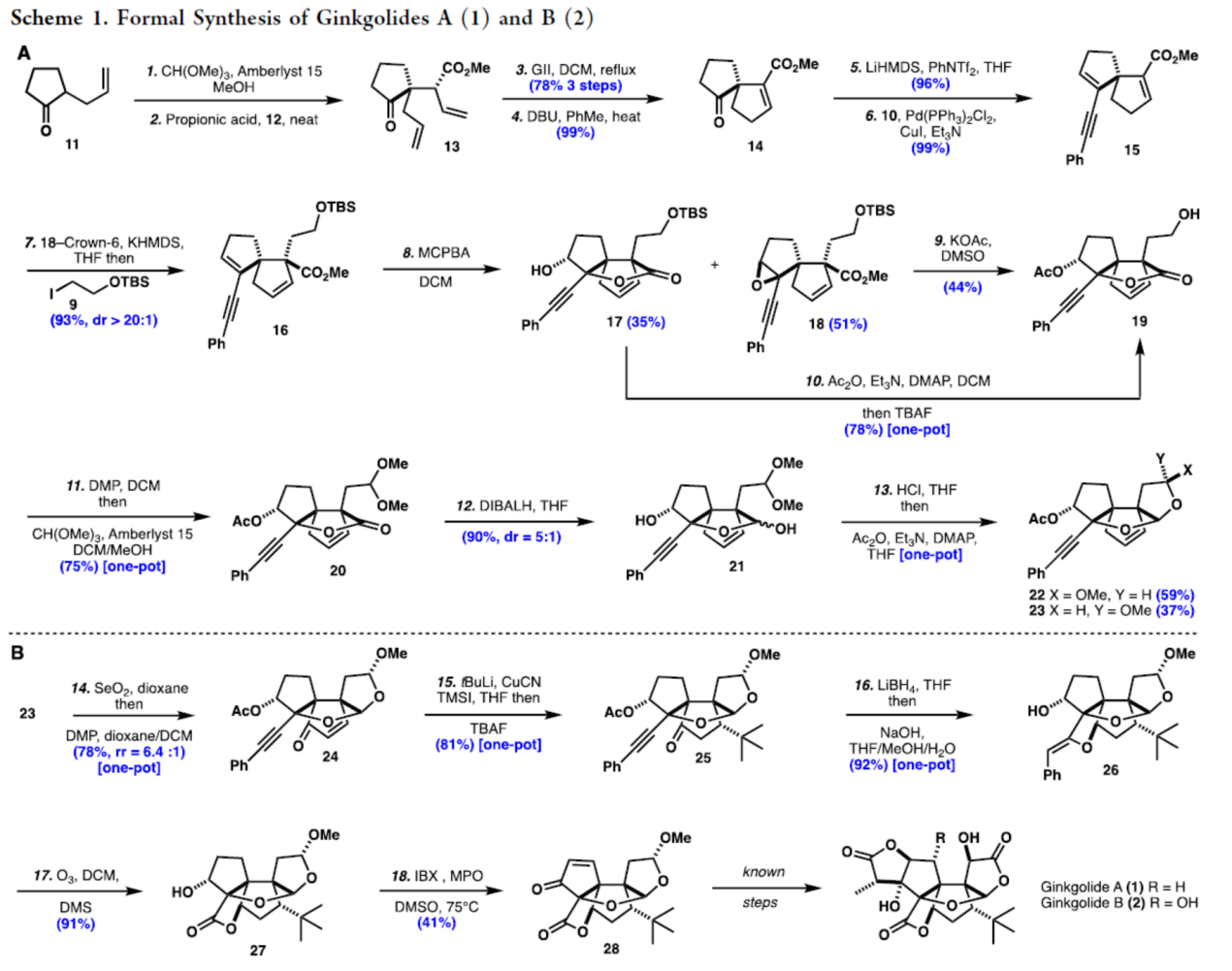
Ginkgolides A(1)和B(2)的形式合成(Scheme 1)。以烯酮11为初始底物,先转化为二甲基缩酮,再与烯丙醇12进行Claisen重排生成双烯酮中间体13。13通过Grubbs II催化RCM形成B-环,以三步78%的总收率生成闭环加合物,之后,烯烃在DBU条件下移位,可以99%的收率得到α,β-不饱和酯14。14在LiHMDS/PhNTf2条件下生成相应的三氟甲磺酸乙烯酯(收率为96%),可进一步与苯乙炔10进行钯催化的Sonogashira偶联反应,可以99%的收率得到烯炔中间体15。15在KHMDS/18-crown-6条件下进行插烯去质子化(vinylogous deprotonation)后,再与碘代烷烃9反应,从而实现了第二个季碳中心立体选择性的构建,可以93%的收率得到α-烷基化酯16(dr > 20:1)。
16通过使用MCPBA进行化学选择性环氧化反应,可以35%的收率得到内酯17和51%的收率得到β-环氧化物18。17在Ac2O/TBAF条件下,可以一锅法78%的收率合成醇19。同时,18在KOAc/DMSO条件下,也可以44%的收率得到醇19。19使用DMP进行一锅法氧化,然后加入原甲酸三甲酯和Amberlyst 15,可以75%的收率得到二甲基缩醛20。20使用DIBALH进行还原,可以90%的收率得到内半缩醛21,dr为5:1。21使用无水HCl以及Ac2O处理,可以96%的总收率生成异头异构体22和23,dr为1.6:1。此时通过硅胶色谱法分离端基异构体22和23,以促进进一步的功能化、纯化和表征。
紧接着,23使用SeO2和DMP进行一锅法双氧化,可以78%的收率得到烯酮中间体24,rr为6.4:1。24在t-BuLi、CuCN、TMSI/TBAF条件进行立体选择性共轭加成,可以81%的收率得到酮中间体25,为单一非对映异构体。25使用LiBH2进行立体选择性还原,再在碱性条件下进行5-exo-dig环化,可以92%的收率构建26中的D-环。26通过臭氧分解,可以91%的收率得到羟基内酯27。27使用IBX和MPO进行氧化,可以41%的收率得到烯酮28。28通过已知的合成路线(J. Am. Chem. Soc. 1988, 110, 649.和Tetrahedron Lett. 1988, 29, 3205.),可分别经10步和6步反应,从而获得最终的Ginkgolides A(1)和B(2)。
(图片来源:J. Am. Chem. Soc.)
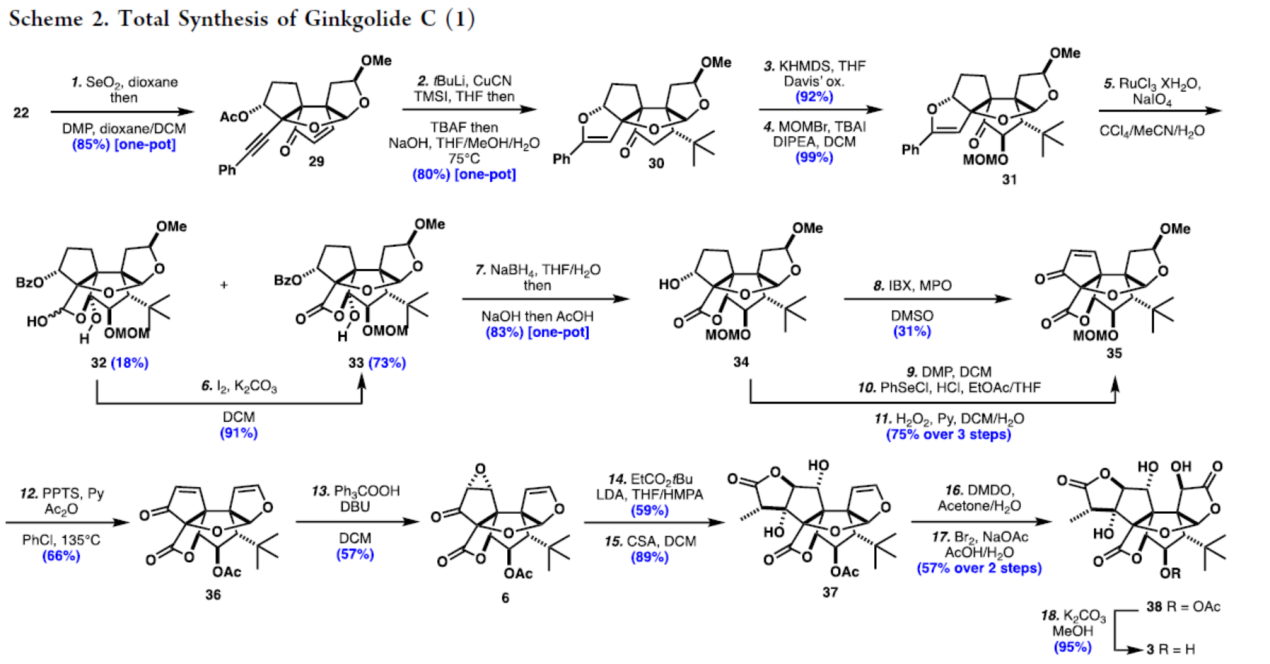
Ginkgolide C(3)的全合成(Scheme 2)。以22为初始底物,使用SeO2和DMP进行一锅法双氧化,可以85%的收率得到烯酮中间体29。通过进一步的研究后发现,29在t-BuLi、CuCN、TMSI/TBAF/NaOH条件进行立体选择性共轭加成,可以一锅法80%的收率得到中间体30。30在KHMDS/Davis氧化条件下反应,可以92%的收率得到α-羟基酮,为唯一的非对映异构体。随后,将其保护为MOM缩醛,可以几乎定量的收率得到中间体31。31使用RuO4/NaIO4进行氧化裂解,可以18%的收率得到32和73%的收率得到33。32很容易在I2/K2CO3条件下转化为33,收率为91%。33使用NaBH4 进行一锅法立体选择性还原,再使用NaOH(1 M)裂解苯甲酰基,然后加入稀AcOH可促进内酯化,可以83%的收率得到34。34在IBX和MPO条件下进行氧化,可以31%的收率得到35。同时,作者发现,使用DMP进行氧化,然后使用无水HCl和PhSeCl处理,可生成相应的α-苯基硒化物,再暴露于H2O2后,可以三步75%的收率得到35。35在PPTS、Py、AC2O条件下反应,可以66%的收率得到36。36在Ph3COOH/DBU条件下进行环氧化反应,可以57%的收率得到环氧化物中间体6。6的THF/HMPA(4:1)溶液中加入EtCO2tBu/LDA后(59%的收率),再使用CSA进行催化开环内酯化,可以89%的收率得到内酯37。37在DMDO、Acetone/H2O条件下进行立体选择性环氧化,随后Br2/NaOAc条件下进行氧化,可以两步57%的总收率得到中间体38。38在MeOH/K2CO3条件下进行脱保护,可以95%的收率得到(±)-Ginkgolide C(3)。
(图片来源:J. Am. Chem. Soc.)
总结 加拿大渥太华大学Louis Barriault课题组报道了Ginkgolide C(3)的首次全合成,共涉及26步反应。同时,通过对中间体28的不同衍生化,分别实现了Ginkgolides A(1)和(2)的形式合成,这也是迄今为止完成Ginkgolides的最短合成路线。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn