


(图片来源:Angew. Chem. Int. Ed.)
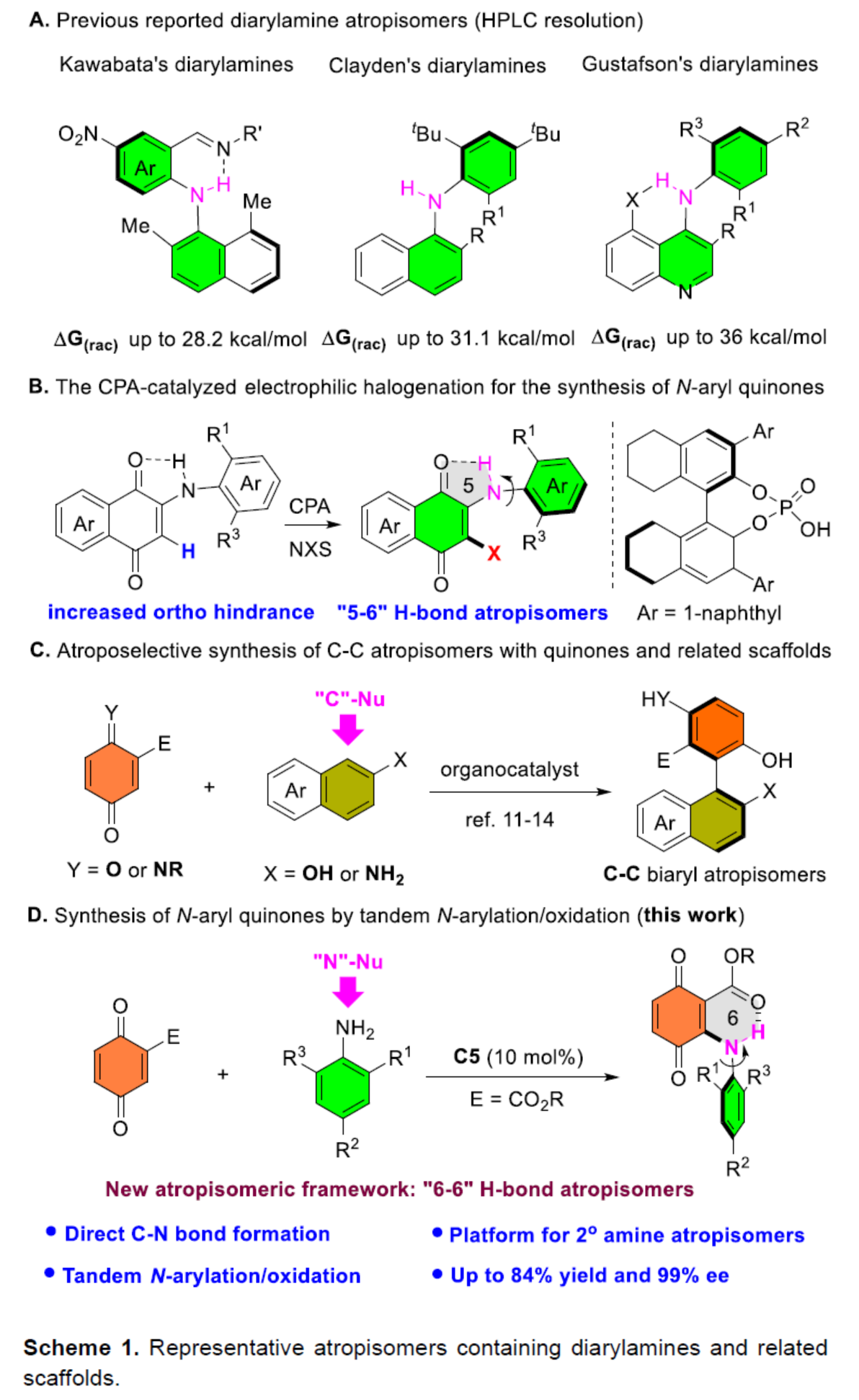
在过去的几十年里,化学家们一直致力于轴手性分子的构建研究。其中,具有轴手性的结构独特的阻旋异构体,如(杂)二芳基、苯胺和芳基烯烃,引起了有机化学家的极大关注。二芳胺及其相关的骨架是许多生物活性天然产物和药物中最常见的结构单元之一,如FDA批准的药物博舒替尼(bosutinib)和比美替尼(binimetinib),以及其它非核苷逆转录酶(NNRT)和血管内皮生长因子受体(VEGFR)抑制剂。由于二芳胺阻旋异构体的旋转能垒较低,导致其构型不稳定,易于互换。与其它稳定的阻旋异构体的合成方法相比,在二芳胺以及相关骨架中引入轴手性仍然具有挑战性。
2009年,Kawabata课题组首次通过手性HPLC拆分合成了一系列含有N-H-N氢键的二芳胺阻旋异构体。其中,分子内氢键的形成对于稳定轴手性是必要的(Scheme 1A)。基于手性HPLC拆分策略,Clayden课题组还实现了无分子内氢键的无环二芳胺阻旋异构对映体的合成。Gustafson课题组进一步通过引入吡啶等缺电子杂环骨架,并引入分子内的氢键,实现了高度稳定的二芳胺阻旋异构体的拆分。然而,上述三种光学活性二芳胺阻旋异构体的合成均依赖于手性拆分策略。最近,Gustafson课题组报道了一种手性磷酸催化对映选择性亲电卤化反应,从而以良好的收率和对映选择性获得了一系列立体化学稳定的N-芳基醌(Scheme 1 B),这是文献中首次通过不对称催化合成二芳胺阻旋异构体的方法。醌类化合物及其相关骨架长期以来一直是手性化合物的合成前体。最近,化学家们通过使用2-萘酚或2-萘胺作为碳亲核试剂,合成了一系列非-C2对称轴手性联芳基化合物(Scheme 1C)。然而,迄今为止,氮亲核试剂尚未应用于这些不对称催化反应。近日,青岛大学刘人荣课题组报道了一种手性磷酸催化醌与苯胺的阻转选择性偶联反应,合成了一系列具有六元分子内N-H-O氢键的N-芳基醌阻旋异构体(Scheme 1D)。
(图片来源:Angew. Chem. Int. Ed.)
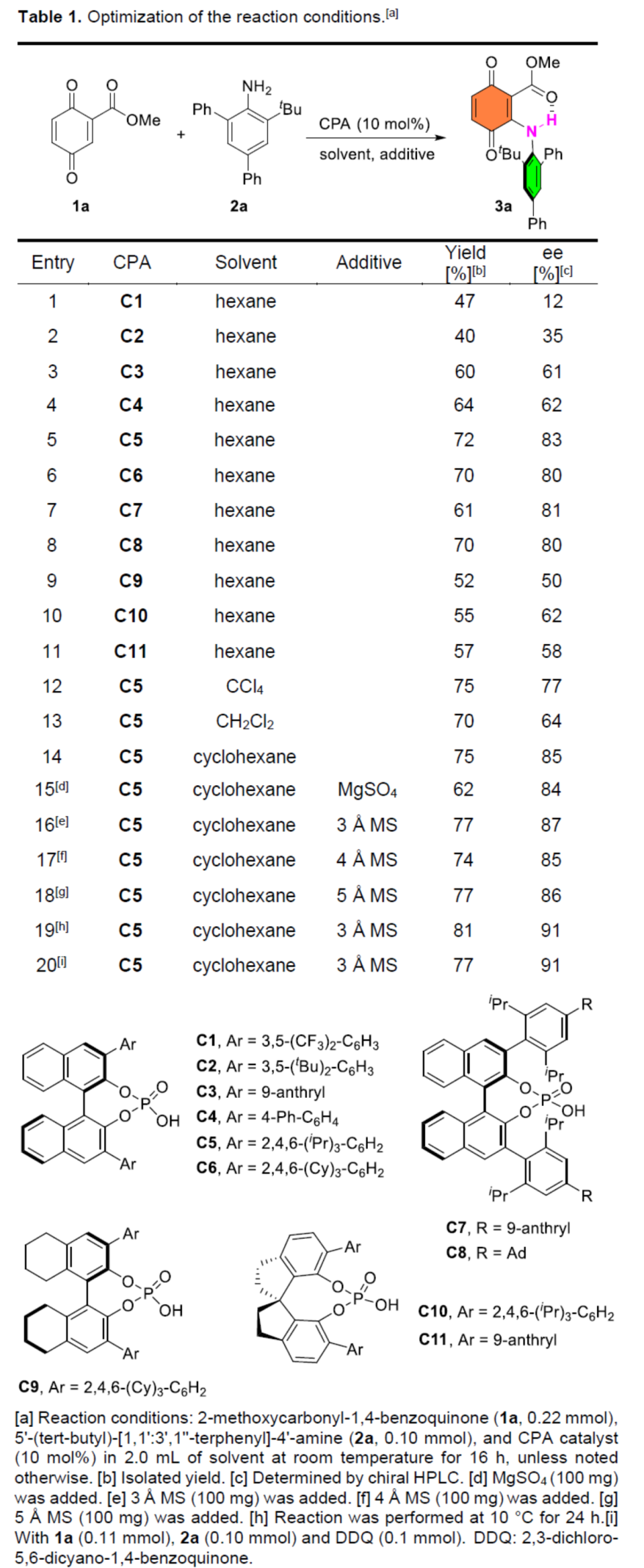
首先,作者以醌酯1a与苯胺衍生物2a作为模型底物,进行了相关偶联反应条件的筛选(Table 1)。当以C5作为催化剂,3Å MS作为添加剂,在环己烷溶剂中10 oC反应24 h,可以81%收率和91%ee得到产物3a。
(图片来源:Angew. Chem. Int. Ed.)
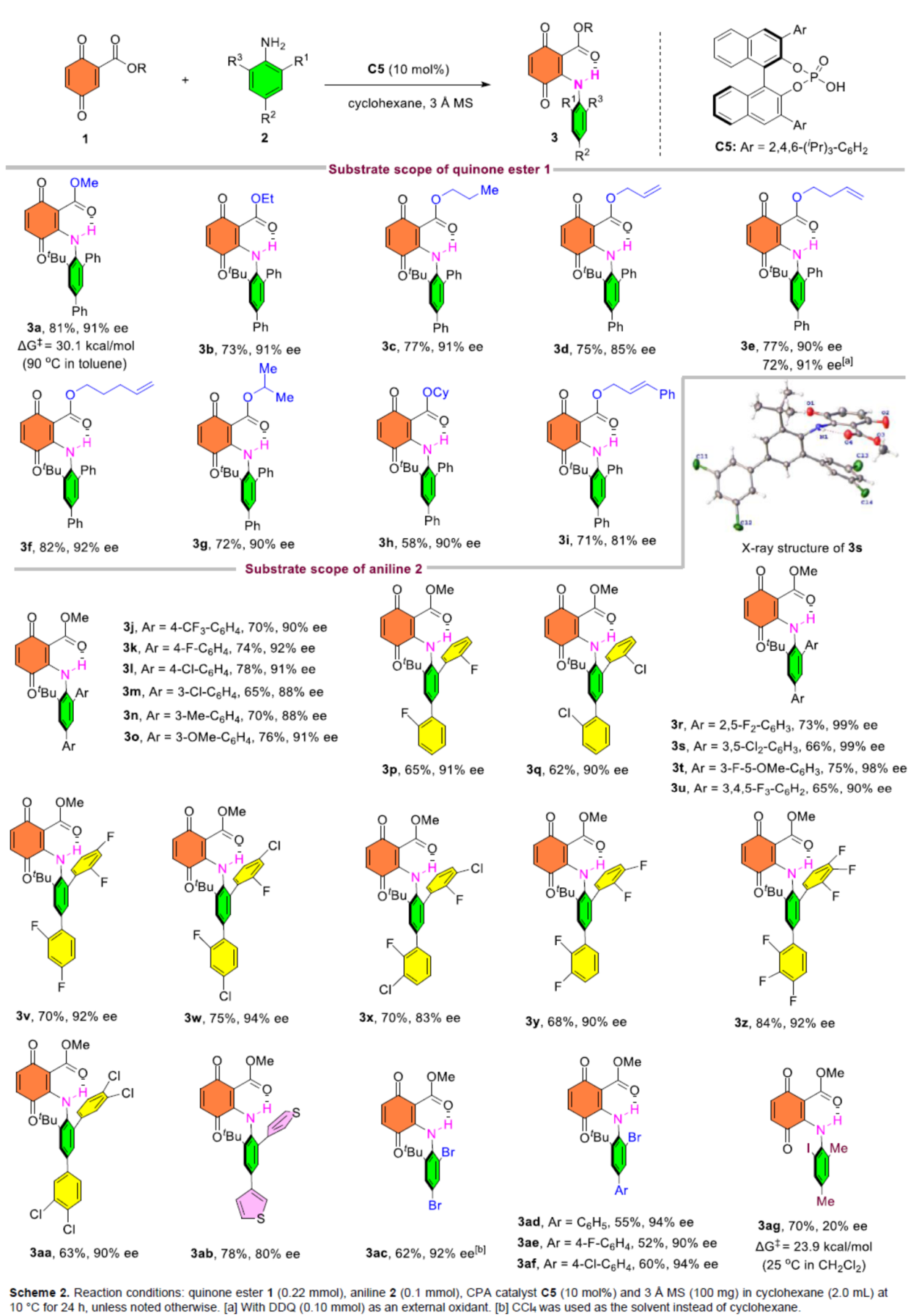
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 2)。首先,当醌酯底物1中的R为一系列烷基取代时,均可顺利进行反应,获得相应的产物3a-3i,收率为58-82%,ee为81-92%。其次,当苯胺底物2中的R1、R2或R3为具有不同电性取代的芳基、噻吩基时,均与体系兼容,获得相应的产物3j-3af,收率为52-84%,ee为80-99%。然而,当苯胺底物2中含有邻位碘取代的芳基时,产物3ag的对映选择性大幅降低。
(图片来源:Angew. Chem. Int. Ed.)
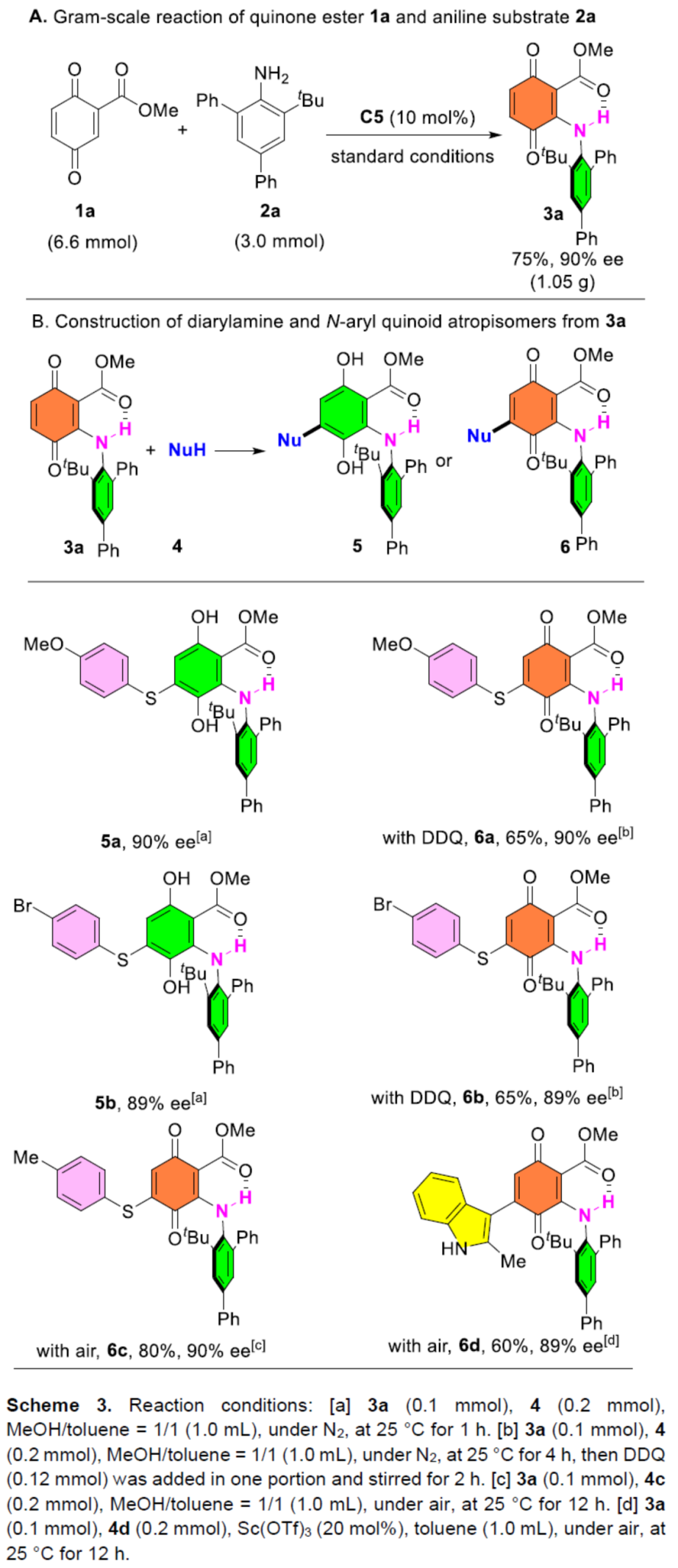
紧接着,作者对反应的实用性进行了研究(Scheme 3)。首先,克级规模实验,同样能够以75%收率和90%ee得到产物3a。其次,3a可与不同的亲核试剂进行加成反应。例如,当使用亲核试剂4-甲氧基苯硫醇4a时,通过Michael加成可快速生成二芳胺阻旋异构体5a,且对映选择性没有降低。然而,由于高富电子的5a在柱层析过程发生快速氧化,从而阻碍了其分离。因此,作者选用了DDQ重新氧化5a,从而以65%的收率和90%的ee获得高度功能化的N-芳基醌阻旋异构体6a。同时,对溴苯基苯酚4b和对甲基苯基苯酚4c在该条件下也能顺利进行反应。值得注意的是,即使在空气中,也可以80%的收率和90%的ee获得N-芳基醌阻旋异构体6c。在Sc(OTf)3催化下,具有代表性的C-亲核吲哚也可与3a顺利反应,从而以60%的收率获得相应的N-芳基醌阻旋异构体6d,且对映选择性没有降低。
(图片来源:Angew. Chem. Int. Ed.)
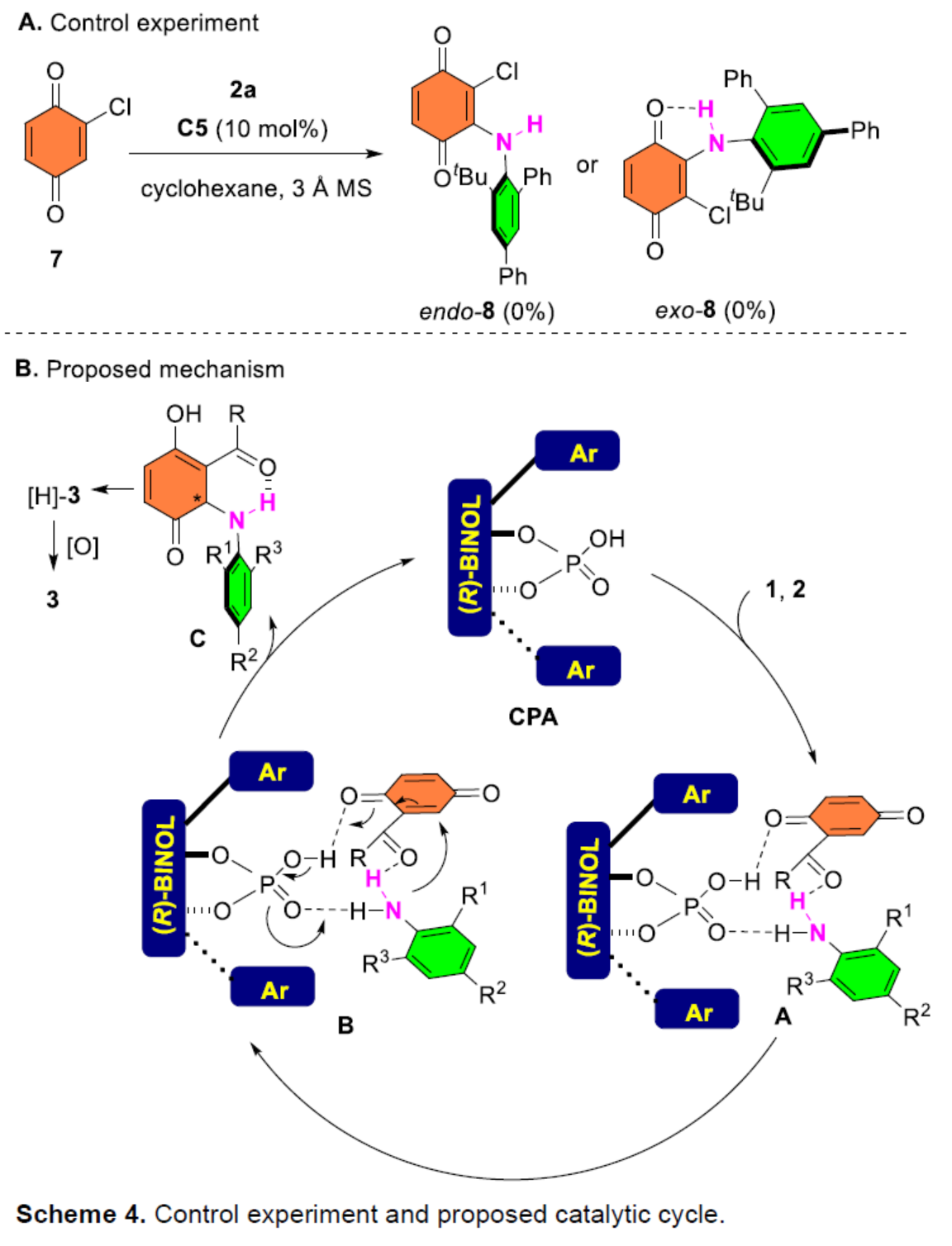
此外,作者还对反应机理进行了进一步的研究(Scheme 4)。首先,控制实验表明,羰基在反应过程中对六元氢键环的构建起着重要作用,但也不能排除氯化物底物的亲电性低于酯的可能性(Scheme 4A)。因此,作者提出了一种合理的催化循环过程(Scheme 4B)。首先,CPA通过多个氢键同时活化醌酯1和苯胺2,生成中间体A。该过程促进了随后的不对称共轭加成,通过中间体B生成具有六元分子内N-H-O氢键的中心手性中间体C。紧接着,中间体C异构化,实现中心手性向轴手性的转移,生成对苯二酚中间体[H]-3。最后,中间体[H]-3经氧化后,从而获得目标的产物3。
(图片来源:Angew. Chem. Int. Ed.)
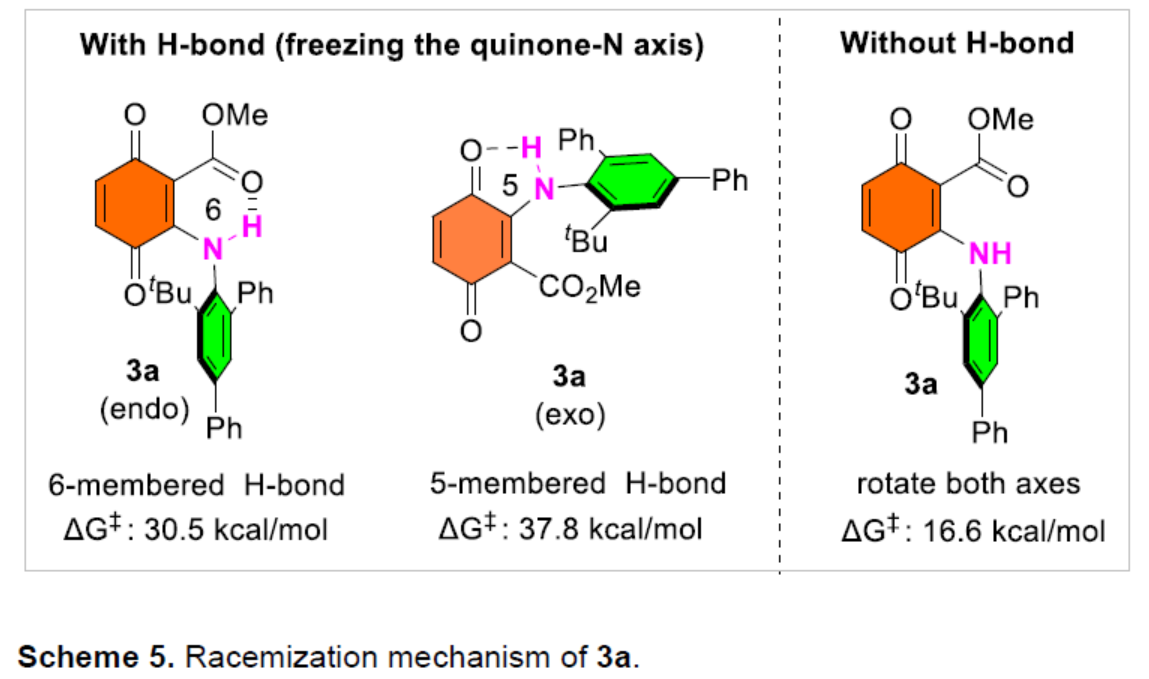
此外,作者还对3a的外消旋化机理进行了研究(Scheme 5)。研究表明,外消旋化可能是通过二级胺与酯羰基形成六元环氢键的过程。在该种情况下计算所得旋转能垒与实验较吻合,通过与酮羰基形成五元环氢键的能垒大幅高于实验值,而没有氢键的旋转能垒则大幅低于实验值。
(图片来源:Angew. Chem. Int. Ed.)
总结 青岛大学刘人荣课题组报道了一种通过手性磷酸催化串联N-芳基化/氧化反应,合成了一系列N-芳基醌阻旋异构体。同时,该反应具有反应条件温和、底物范围广泛、官能团兼容性高、对映选择性高等特点。此外,通过克级规模以及与不同亲核试剂的反应,从而进一步证明了反应的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn