


图1. 镍催化非活化烯烃三组分1, 2-不对称双碳官能团化(图片来源:J. Am. Chem. Soc.)
近年来,过渡金属催化的烯烃1, 2-双碳官能团化反应得到了广泛研究。镍作为廉价金属,具有独特的抑制β-H消除能力和多种灵活的价态,因此在此类反应中具有一定优势。1, 2-双碳官能团化反应由烯烃出发同时形成两个相邻的C(sp3)-C键,可作为发展相关立体选择性合成反应的潜在有力工具。然而,镍催化烯烃的分子间三组分不对称双碳官能团化反应研究较为罕见,现有的报道主要局限于活性烯烃的自由基官能团化。基于此,作者发展了在分子间迁移插入过程中利用非手性导向基团和手性半活性N, N-双齿配体之间的空间相互作用,实现了基于非自由基历程,Ni(0)/Ni(II)催化循环体系的非活化烯烃三组分、对映选择性1, 2-二芳基化和1, 2-芳基烯基化反应。
此前在镍催化对映选择性1, 2-双碳官能团化方面的工作主要集中于分子内双组分偶联,在迁移插入或还原消除过程中控制其立体选择性 (图2A和2B)。Morken等课题组在2019-2020年相继报道了一些分子间镍催化烯烃不对称1, 2-双碳官能团化的反应实例,这些例子都是通过立体选择性自由基捕获机制进行 (图2C)。然而这些基于自由基的三组分偶联反应通常只能构建一个立体中心,且底物适用范围仅限于活性烯烃以及一些活性自由基受体。考虑到其局限性,作者期望开发一种由不对称迁移插入步骤控制的对映选择性镍催化1, 2-二芳基化反应,一步构建两个手性中心 (图2D)。根据此前作者报道的使用导向基团通过非自由基途径用于非活化烯烃的1, 2-双碳官能团化研究基础,作者认为含受保护氨基的烯烃底物是实现非活化烯烃分子间不对称1, 2-二芳基化的最佳选择。
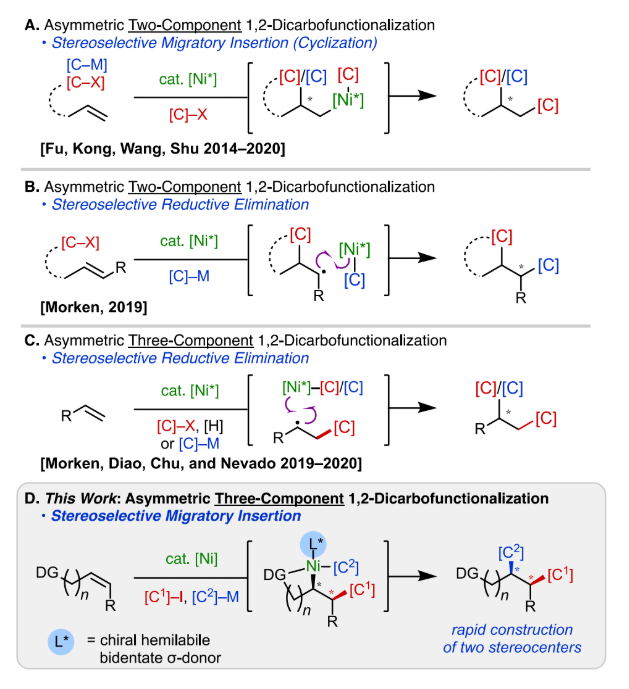
图2. 研究背景与反应体系设计(图片来源:J. Am. Chem. Soc.)
首先,作者以1-碘-4-异丙氧基苯和苯硼酸新戊二醇酯 (PhB(nep)) 作为模板偶联底物,使用(S)-苄基联噁唑啉 (Bn-biOx,L9) 为配体,在低温条件下系统考察了含不同磺酰基烯丁基胺底物的反应性 (图3)。对位含不同电性取代基的苯磺酰基会显著影响反应的收率和对映选择性,其中2, 4, 6-三异丙基苯磺酰基 (Trisyl) DG8表现出最佳的反应性和对映选择性,能以良好的收率生成烯烃1, 2-二芳基化产物2a,产物的绝对构型经X-射线单晶衍射得到确认。此外,作者还筛选了一系列噁唑啉配体,常见的苄基噁唑啉配体L1-L4,丁基联噁唑啉配体L5, L6均不能以较好的收率和选择性得到产物,只有使用苄基联噁唑啉骨架配体时(L7-L11)反应才能顺利完成。在条件优化过程中,作者还发现较短的反应时间有利于获得更高的对映选择性但会损失一定产率。不添加Bn-biOx配体时也能以13%的收率获得外消旋产物,表明在该催化过程中具有一定强度的背景反应。值得注意的是,作者使用他们开发的一种空气稳定的Ni(0)前体--Ni(cod)TOA作为催化剂,反应无需惰性气氛也能成功进行。
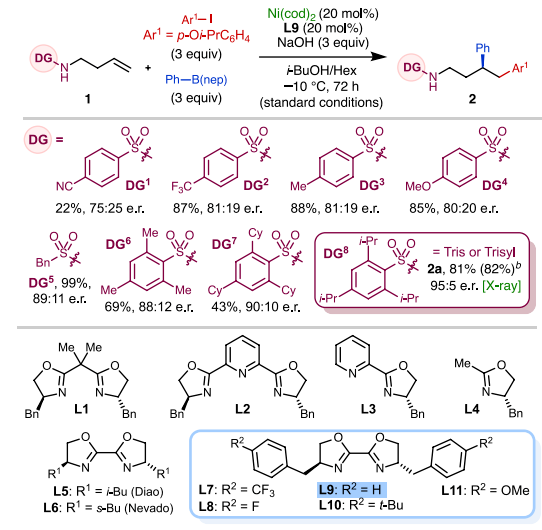
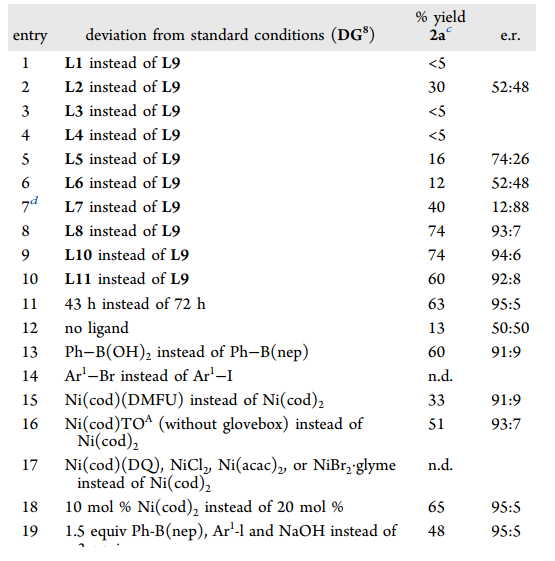
图3. 反应条件优化(图片来源:J. Am. Chem. Soc.)
随后,作者分别考察了芳基碘化物和芳基硼酸酯作为偶联底物的适用范围 (图4)。对于取代基电性,芳基碘化物对位含给电子基团时能以良好的收率得到更高对映选择性的产物 (2b-e,2h-j,2p,2q),含电中性或吸电子基团时则观察到较低的对映选择性和中等至优异的产率 (2k-o)。间位和邻位上含给电子基团的芳基碘化物能以优异的收率得到1, 2-二芳基化产物,但对映选择性降低。对于芳基硼酸酯,苯环上取代基的电性对反应影响较小,对位上的给电子基团、电中性基团以及弱吸电子基团相比于强吸电子基能得到更高的产率 (2r-v,2x-z)。杂芳基硼酸酯,如3-噻吩基和3-呋喃基硼酸酯 (2aa, 2ab) 也适用于此转化。此外,作者还研究了烯基硼酸酯作为亲核试剂在该转化过程中的反应性。使用(E)-(4-甲基)苯乙烯基硼酸新戊二醇酯参与反应,能以中等的收率得到1, 2-二烯基化产物2ae,但对映选择性相对较低,而1, 2-芳基烯基化产物2af可以兼得良好的产率和对映选择性。其它(E)-烯基硼酸酯,如(E)-(3-苯基丙-1-烯-1-基)硼酸酯和(E)-(3, 3-二甲基丁-1-烯-2-基)硼酸酯,也能顺利完成该转化。此外,1,1-二取代硼酸酯(1-苯基乙烯基硼酸酯,2ai)和环己烯基硼酸酯 (2aj) 均能以良好的的对映选择性和较低的产率得到偶联产物。
作者还研究了该双芳基化过程中烯烃母核的底物适用范围。作者发现,在标准反应条件下,2, 4, 6-三异丙基苯磺酰基 (Trisyl) 作为导向的(Z)-和(E)-内烯烃只能以较低产率获得双官能团化产物。而将Trisyl切换为位阻较小的DG2时,反应则顺利进行,生成单一非对映二芳基化产物 (2ak-2an),且具有良好的产率和ee值。作者使用制备级手性超临界流体色谱法成功分离出产物2ak的主要对映体,其绝对立体构型由单晶X-射线衍射证实。

图4. 底物普适性研究(图片来源:J. Am. Chem. Soc.)
为了证明Trisyl导向基团中的N-H键的重要性,作者使用Trisyl磺酸酯1r和N-甲基化的Trisyl磺酰胺1s进行了对照实验,在这两种底物条件下,均未发生反应 (图5A)。对于烯烃的双键与导向基之间的距离是否会影响反应对映选择性,作者使用将烷基链延长的底物进行反应,结果表明只有烯丁基胺能顺利完成转化 (图5B)。作者认为这可能是由于只有烯丁基胺底物能形成空间构型稳定的含镍五元环状中间体所致。此外,自由基钟实验表明该反应并非经历自由基历程 (图5C)。基于上述实验作者提出了可能的反应机理,首先Ni(0)-(Bn-biOx)络合物与芳基碘化物发生氧化加成得到Ni(II)物种,随后Trisyl保护的烯基胺上的双键和氮原子与Ni(II)物种进行配位,经立体选择性迁移插入形成相应的Ni(II)-(Bn-biOx)-烷基-磺胺基五元金属环状中间体,最后与芳基硼酸酯进行转金属化得到Ni(II)-(Bn-biOx)-烷基-芳基物种再还原消除生成1, 2-二芳基化产物 (图5D)。随后,作者发展了一种使用Mg(0)、Ti(Oi-Pr)4和TMSCl对产物2a进行脱保护的方法,用于得到对映体富集的1, 2-二芳基胺。在该条件下能以79%的产率高效实现对Trisyl基团的脱除,同时保持对映体比例 (图5E)。此外,作者还将简单的羧基作为导向基,也成功实现了相应底物的对映选择性二芳基化 (图5F, 2au)。
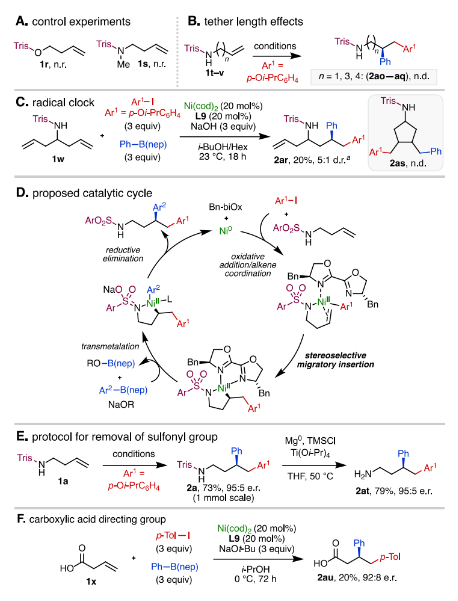
图5. 机理实验、可能的催化循环以及衍生化研究(图片来源:J. Am. Chem. Soc.)
最后,作者使用DFT计算对反应历程进行了理论研究 (图6)。首先,反应经由TS1得到氧化加成Ni(II)中间体4,再进行配体交换得到更稳定的Ni(II)络合物5。随后烯烃与Ni(II)配位,形成π-烯烃络合物6,再经历TS2a迁移插入形成五元镍环7。最后经历与芳基硼酸酯形成的TS3和还原消除过渡态TS4得到产物2n′。在该历程中,烯烃的迁移插入步骤具有较低的能垒(5.6 kcal/mol),且放热不可逆的,因此该步骤决定了反应的对映选择性。计算结果表明,在这些金属络合物中,噁唑啉配体相对于磺酰胺基更容易解离发生配体交换。在过渡态TS3中,Bn-biOx配体完全解离,并在最后还原消除后重新配位到Ni(0)金属中心上。Bn-biOx配体易解离的特性在动力学上显著促进了中间体5和7的转化。
由于Bn-biOx配体在决定对映选择性的迁移插入步骤过渡态中为单齿配位模式,因此其诱导模式不同于涉及C2对称手性配体常见的对映选择性迁移插入过程。计算结果表明该过程经历的两种最稳定过渡态TS2a和TS2b (分别通向S对映体和R对映体)的活化自由能分别为5.6和6.9 kcal/mol,根据迁移插入TS构象的Boltzmann平均值计算出的e.r.为87:13,有利于生成S对映体的生成,这与实验值 (88:12) 一致。在优化过渡态TS2a中,大位阻的Trisyl基团位于(S)-Bn-biOx配体占据较少的区域,而在较不稳定的过渡状态TS2b中观察到Trisyl基团和Bn-biOx配体上的苄基之间存在较大的空间排斥。
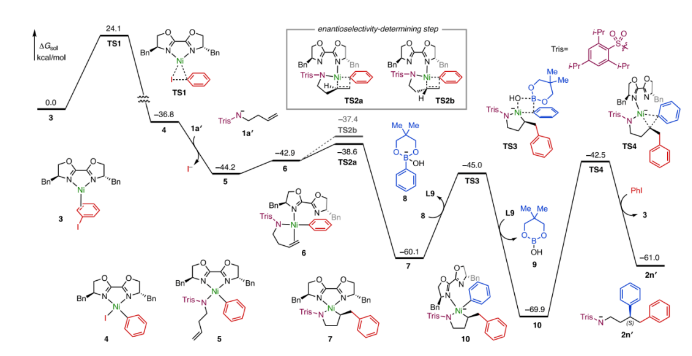
图6. DFT理论计算(图片来源:J. Am. Chem. Soc.)
总结
Keary M. Engle教授和刘鹏教授课题组发展了一种镍催化非活化烯烃三组分1, 2-不对称双碳官能团化反应。该反应可兼容众多偶联底物以及1, 2-二取代(E)-和(Z)-烯烃,能以良好的产率和对映选择性得到双官能团化产物。作者还开发了后续的脱保护反应,用于合成对映体富集的1, 2-二芳基胺。DFT计算研究揭示了立体诱导的机制以及导向基和配体的作用。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn