

(图片来源:Nat. Catal.)
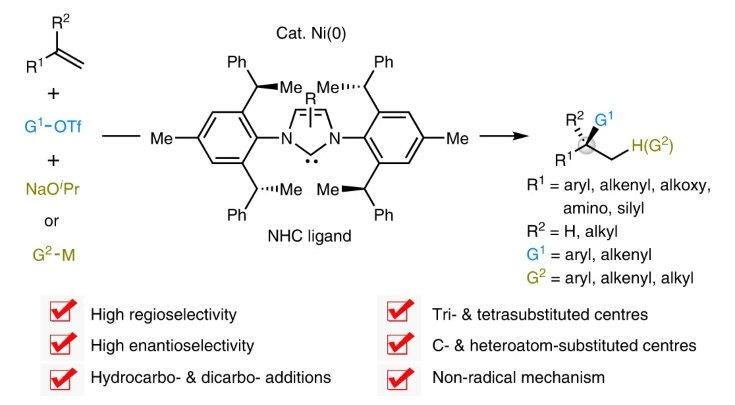
对映体富集的三取代和四取代立体中心,特别是那些与芳烃或烯烃直接相连的立体中心,广泛存在于天然产物和药物中(Fig. 1a)。而此类立体中心所连接原子的空间排列往往决定了分子的整体形状,并影响其生物功能或毒性。由于不同的对映异构体可能会具有截然不同的活性,因此利用不对称催化实现其单一异构体的高效合成在制药和农业化学研究中是极其重要的。
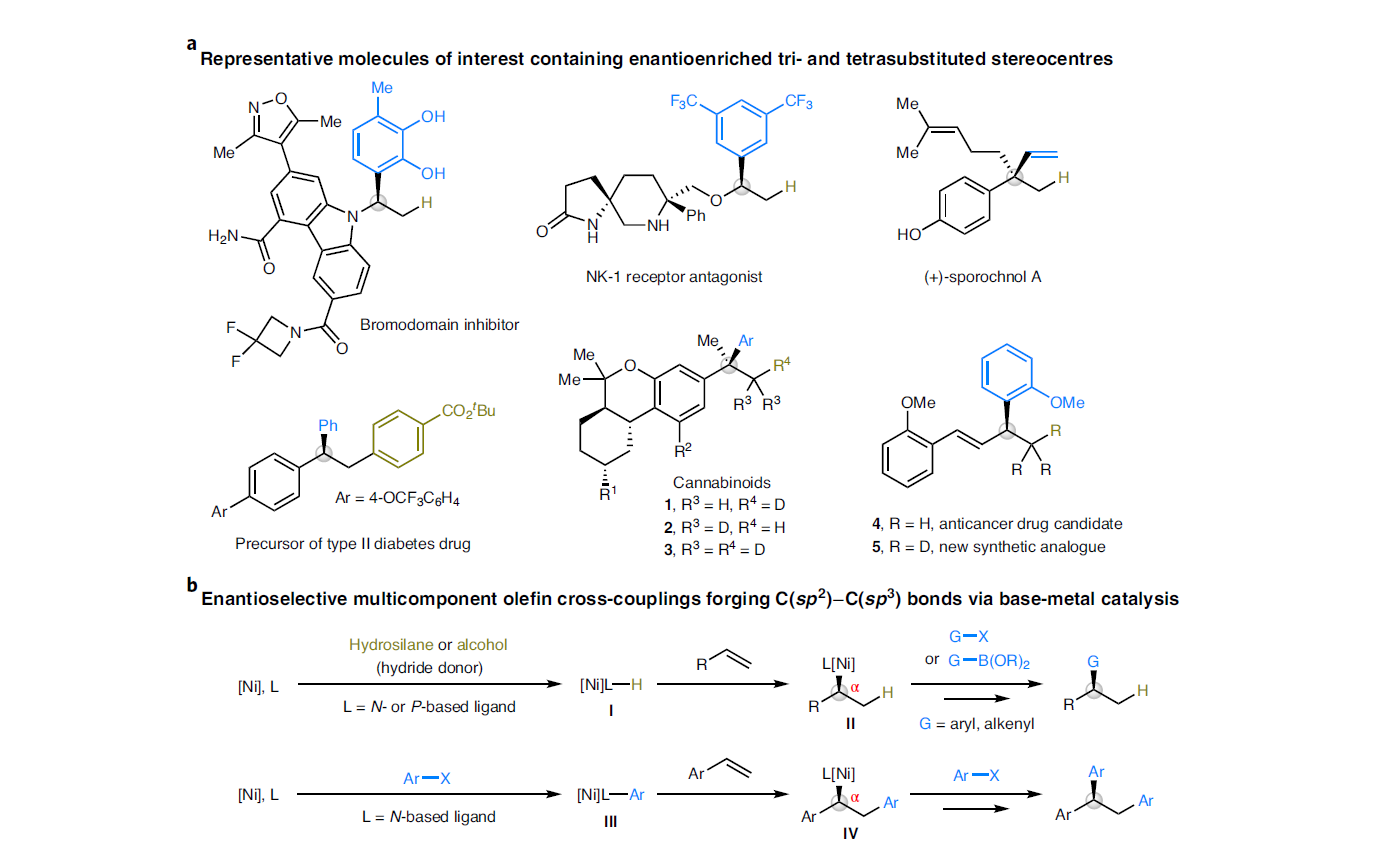
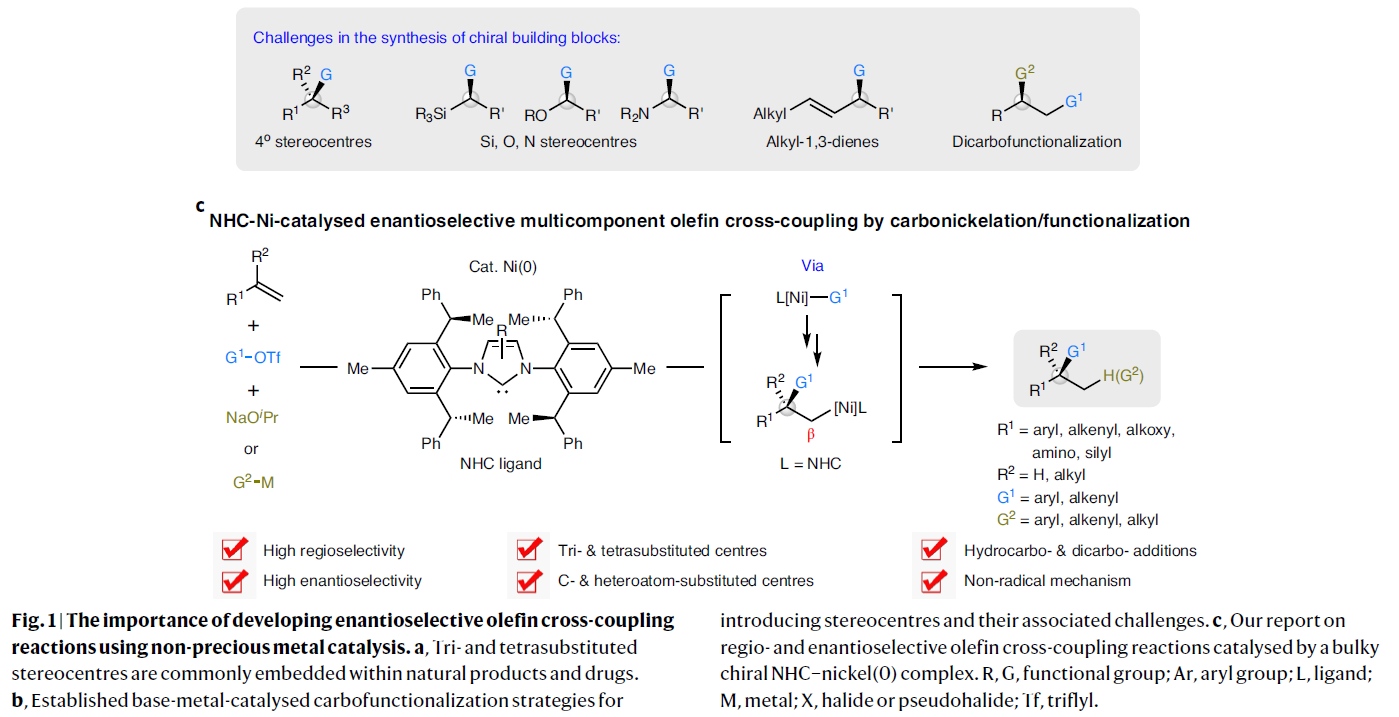
过渡金属催化含碳官能团与前手性碳-碳π体系的对映选择性多组分偶联是提升分子复杂性和构建立体中心的有效手段。特别是遵循马氏规则的1,2-氢碳官能团化过程,其可以精准的在烯烃的两个碳原子上实现C-C键和C-H键的构建。而当使用手性金属催化剂参与反应时则可以有效控制手性中心的立体化学。基于此,有机化学们发展了钯催化的还原Heck类型反应,从而实现C(sp2)-C(sp3)的构建。近些年,廉价金属催化烯烃的对映选择性官能团化过程受到了广泛关注并得到了一定的发展(Fig. 1b)。其中包括烯烃的氢-官能团化和双官能团化过程。尽管此领域已经取得了一定的进展,但仍具有一定的局限性。若想实现两个不同碳单元对烯烃的选择性加成则需要避免两种偶联试剂之间的竞争偶联以及烷基金属中间体的β-H消除过程。因此利用简单易得的烯烃作为起始原料,在不需要导向基团的协助下,利用廉价金属催化直接实现其对映选择性碳-官能团化过程具有重要意义。最近,中科院上海有机所施世良课题组与新加坡国立大学许民瑜(Ming Joo Koh)课题组发展了NHC-Ni(0)催化体系,利用三氟甲磺酸酯作为碳源和烷氧基碱金属作为氢源,实现了多样烯烃和1,3-二烯烃的1,2-氢芳基化和1,2-氢烯基化反应。此外,当使用有机金属试剂替代烷氧基碱金属试剂后还可以高效实现烯烃的双碳官能团化反应。此转化可以以良好的区域选择性和高对映选择性实现烯烃的碳-镍化过程,随后实现C-Ni键的转化,为对映体富集的的三取代或四取代立体中心的构建提供了有效的方法(Fig. 1c)。
(图片来源:Nat. Catal.)
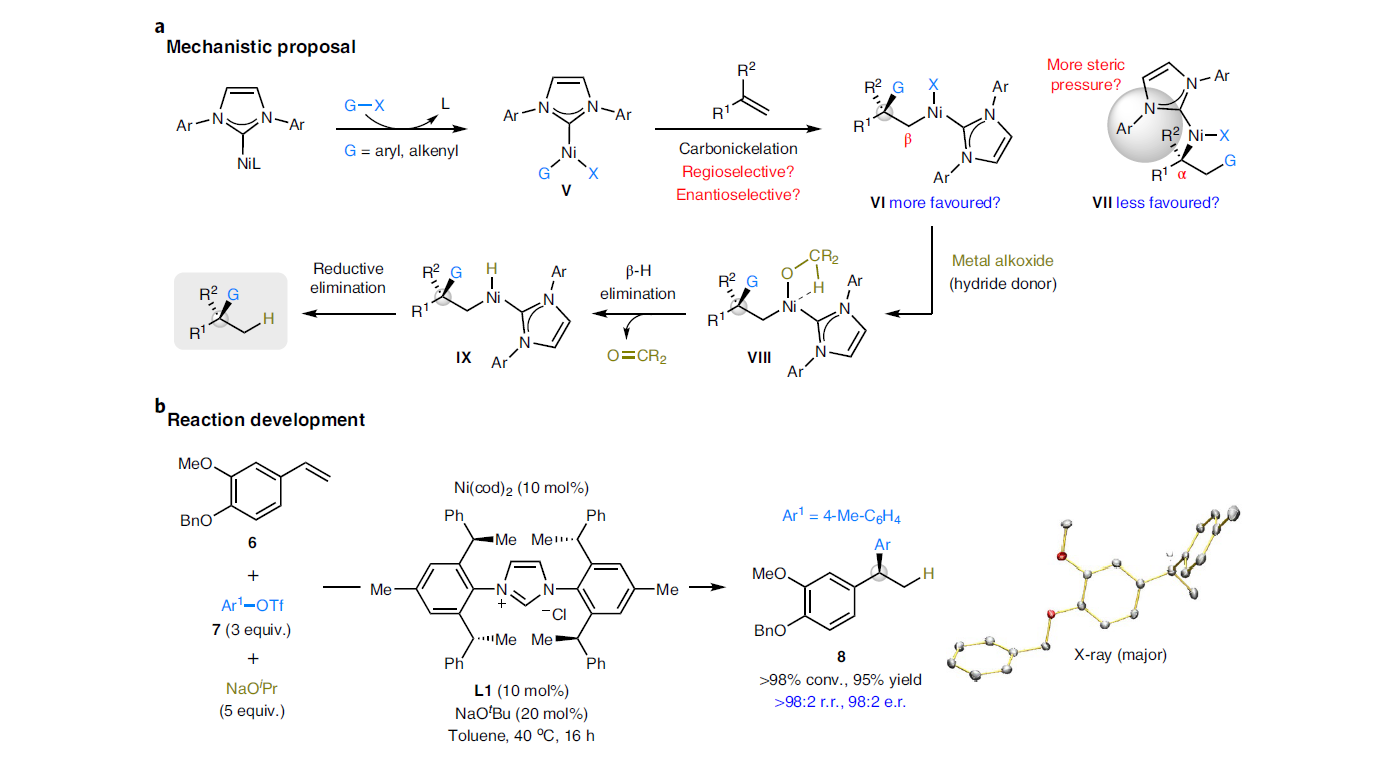
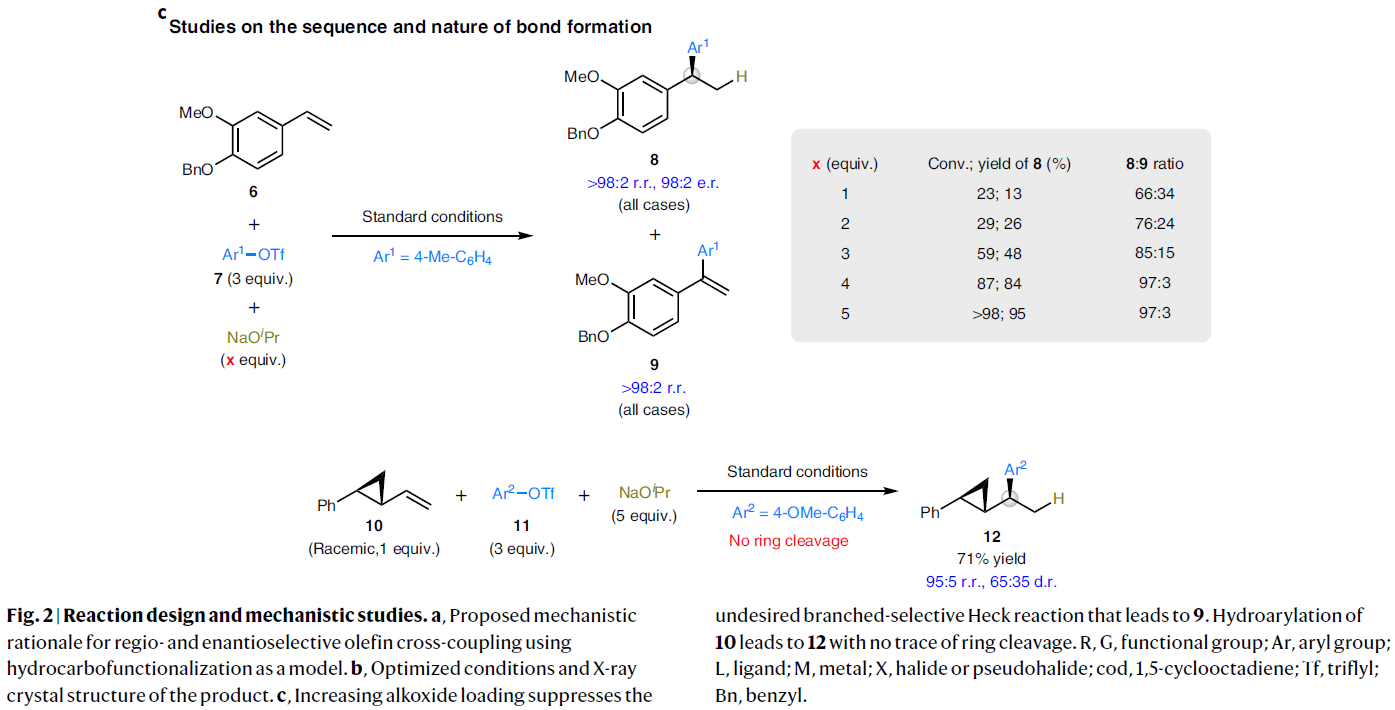
由于之前发展的催化体系过度依赖手性双齿N、P配体的使用而缺乏一定的通用性。为了规避这一问题,作者选择设计一个新的反应体系,即利用地球上含量丰富的有机镍(0)作为催化剂,大位阻的手性氮杂环卡宾(NHC)作为配体来实现转化(Fig. 2a)。作者认为反应起始于NHC-Ni(0)与C(sp2)亲电试剂反应得到手性芳基(烯基)镍物种V。随后V经历与π键的区域选择性和对映选择性的碳-镍化过程得到中间体VI(而不是VII),从而尽量减少配体和烯烃取代基之间不利的空间相互作用。作者认为NHC较强的给电子性以及较大的立体位阻可以有效稳定中间体V并提供合适的手性环境来诱导不饱和键的高效立体选择性插入过程。接下来VI通过烷氧基配体取代以及氢转移得到中间体IX。最后IX通过还原消除得到目标氢官能团化产物。
从机理上讲,此反应中碳-镍化/氢转移的顺序与文献报道的方法(Fig. 1b)在两个方面有所不同:1)由于C-C键形成在C-H键形成之前,因此中间体V到VI的区域选择性结果很大程度受立体效应调控;2)由于立体化学结果已经在碳-镍化过程中建立,因此通过对中间体VI中的C-Ni键官能团化(并非氢化)可以实现烯烃的双官能团化反应,这在金属氢物种启动的催化体系中是不能实现的。
为了验证Fig. 2a中作者提出的假设,作者以苯乙烯6作为模板底物对反应进行尝试并进行条件筛选。作者发现当使用芳基三氟甲磺酸酯7(3.0 equiv)作为碳亲电试剂,异丙醇钠(5.0 equiv)作为氢源,Ni(cod)2(10 mol%),L1(10 mol%),NaOtBu(20 mol%)甲苯中40oC反应16小时可以以95%的产率得到目标加合物8(r.r. > 98:2; e.r. = 98:2)。此外,产物8的绝对构型通过单晶衍射得到确认(Fig. 2b)。控制实验表明过量的异丙醇钠是抑制反应中的竞争的Heck反应途径的关键,因此最大限度避免了烯烃副产物9的生成。此外,通过消旋的反式烯基环丙烷10与11在标准条件下反应可以以71%的产率得到目标加合物12(r.r. = 95:5),仅观察到极少的环丙烷开环产物。由此表明此反应是不可能起始于氢镍化过程或自由基物种的(Fig. 2c)。
(图片来源:Nat. Catal.)
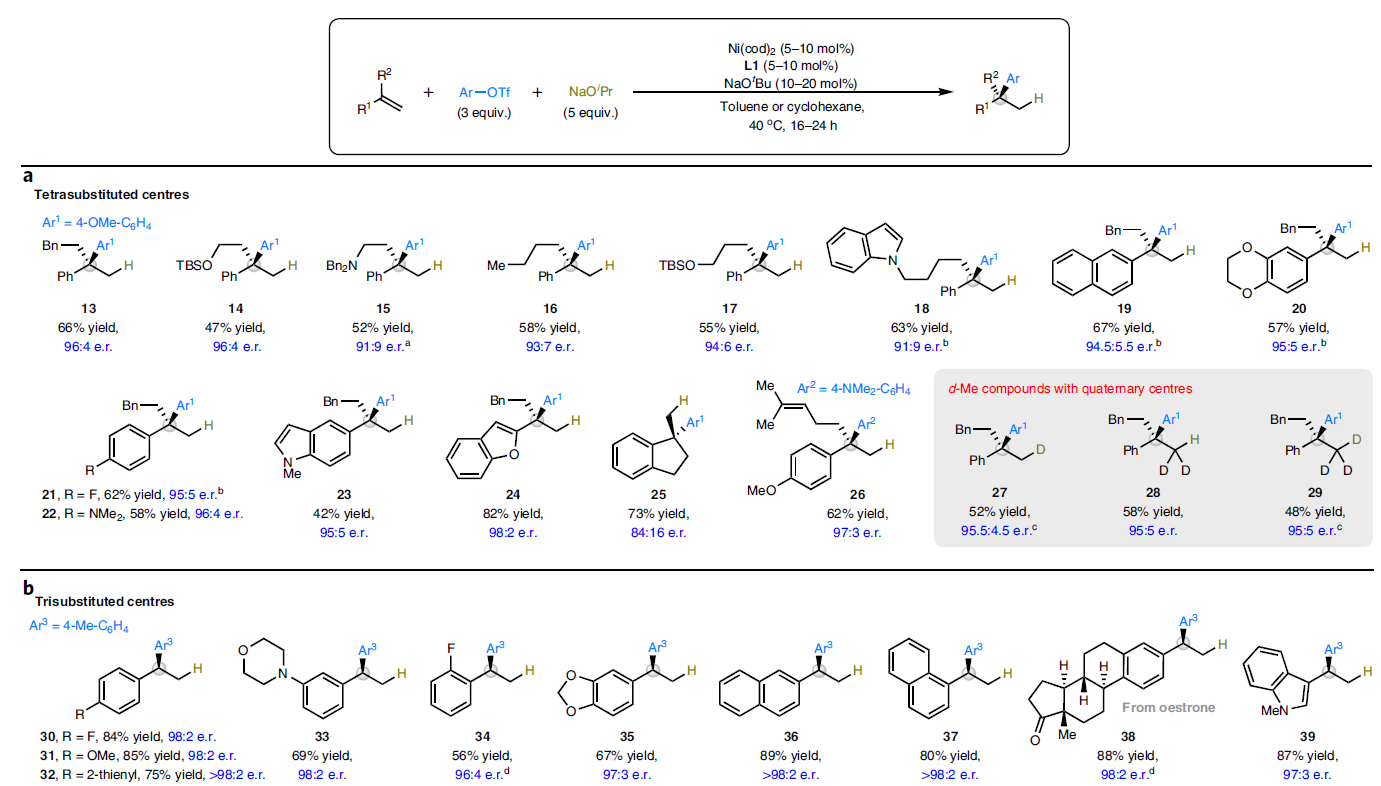
随后,作者对所建立反应体系的通用性进行考察(Fig. 3)。首先,作者对一系列官能团化的烯烃或1,3-二烯的兼容性进行探索。实验结果表明,此反应体系可以兼容一系列具有较大立体位阻的1,1-二取代烯烃,并通过氢-芳基化反应过程实现了具有四取代立体中心的产物13-29的合成,且可以实现良好的区域选择性和非对映选择性控制。这与目前已经发展出的催化体系对大立体位阻的1,1-二取代烯烃不兼容形成鲜明的对比(Fig. 3a)。此转化可以兼容硅醚(14,17)、胺(15)、杂环(18,23,24)、不同电性的苯环(19-22)以及烯烃(26)等多样官能团。此外,环外烯烃也可以顺利实现转化,以73%的产率得到相应的氢-芳基化产物25,但是对映选择性相对较低(e.r. = 84:16)。值得注意的是,利用此方法还可以实现氘代甲基(CH2D, CHD2, CD3)取代的药物类似骨架的合成(27-29)。
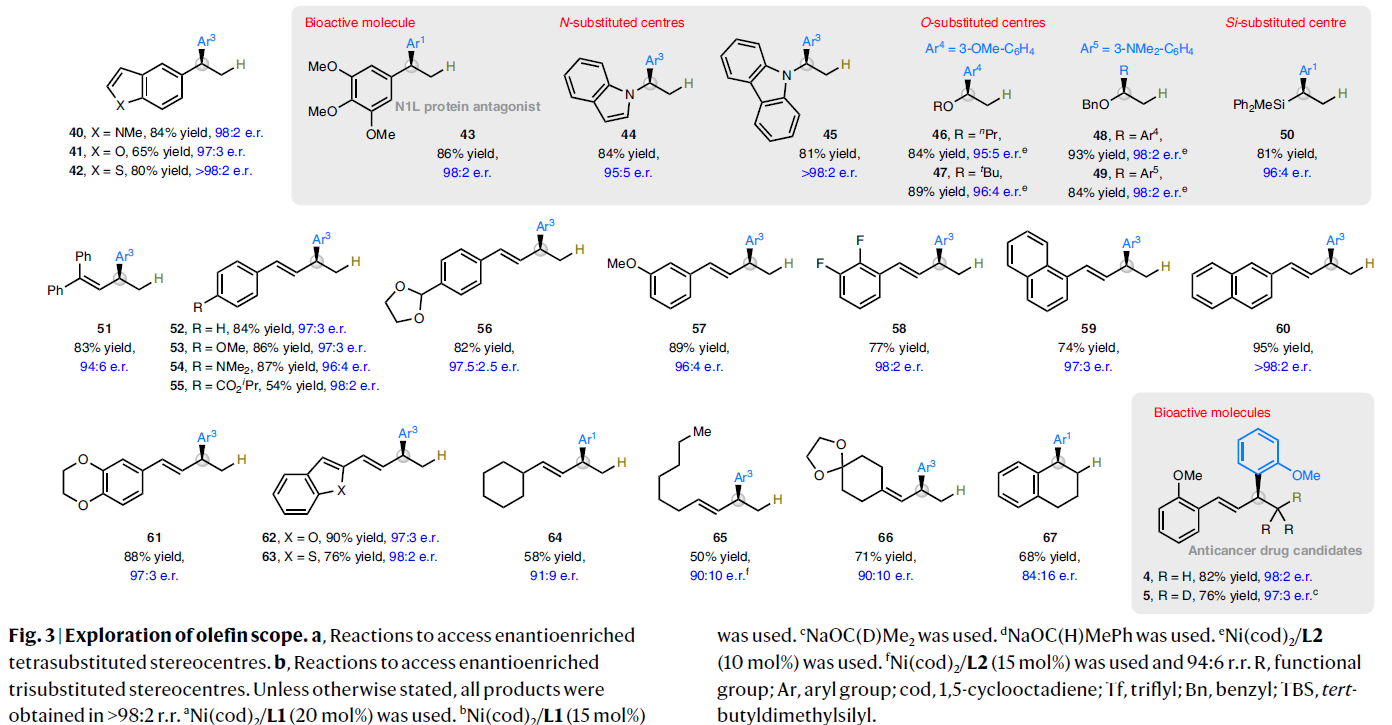
此外,单取代烯烃与1,3-二烯烃也可以兼容此转化,以良好产率和对映选择性实现一系列三取代立体中心的构建(Fig. 3b)。具有不同电性的芳基(30-38)或杂芳基乙烯(39-42)均可顺利实现此氢-芳基化过程。应用此方法还可以实现N1L蛋白质拮抗剂43和雌酮衍生物38的合成。值得注意的是,产物38中的羰基可以很好的兼容,且产物的构型主要受到手性催化剂的立体化学所控制。此外,此转化中的烯烃还可以扩展到杂原子取代的烯烃,从而实现一系列氧、氮、硅官能团化立体中心的构建(44-50)。
与之前报道的催化体系不同的是,利用此方法可以分别实现芳基1,3-二烯(51-63)和烷基1,3-二烯(64-66)的端位C=C键的氢-芳基化过程,且具有良好的区域选择性和对映选择性。因此,利用此方法可以实现抗癌药物4及其氘代类似物5结构中的烯丙基芳烃骨架的构建。环状内烯可以顺利实现转化以68%的产率得到产物67,但是对映选择性相对较低(e.r. = 84:16)。遗憾的是,非环内烯反应较差,仅可以得到<10%的目标产物。
(图片来源:Nat. Catal.)
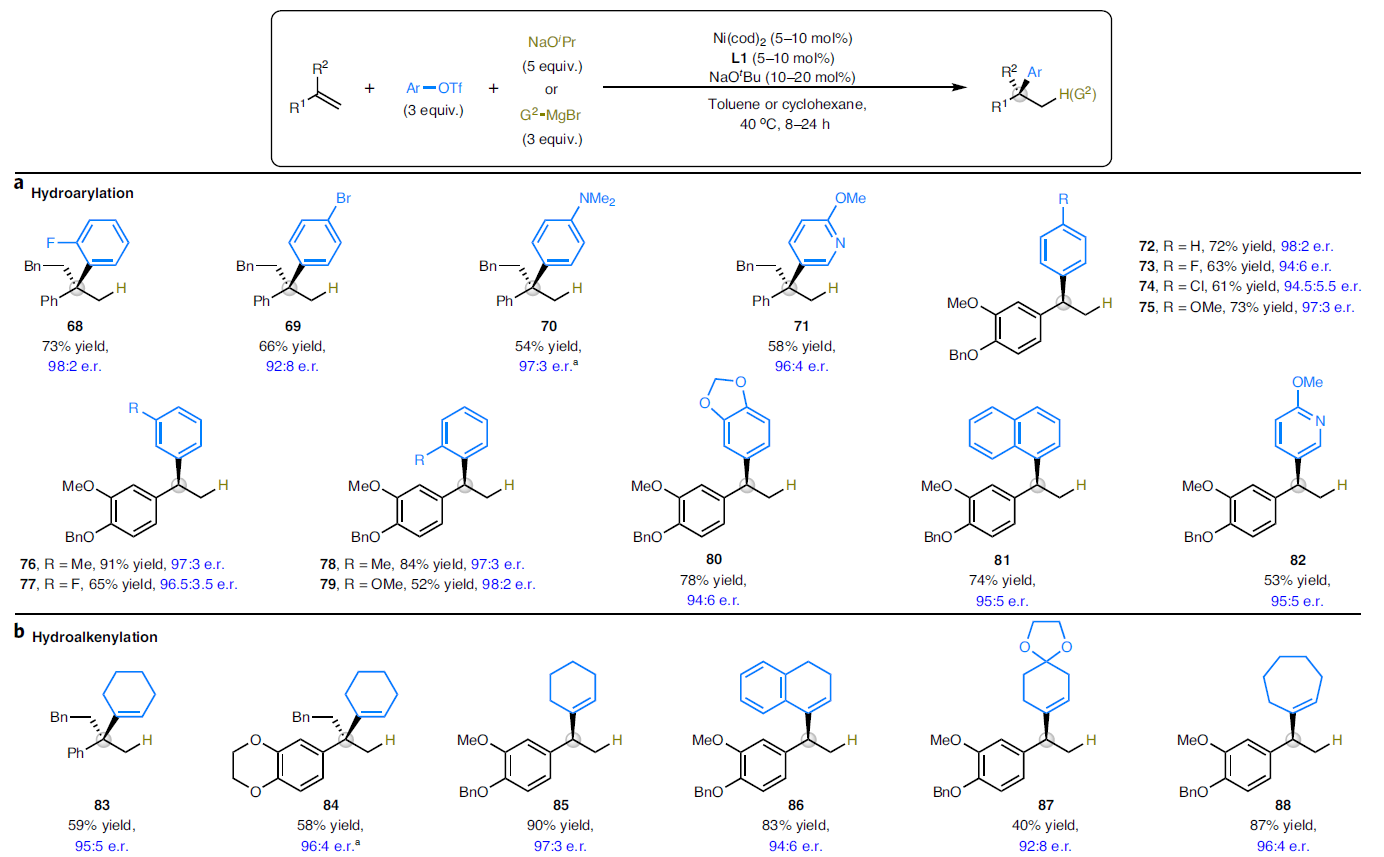
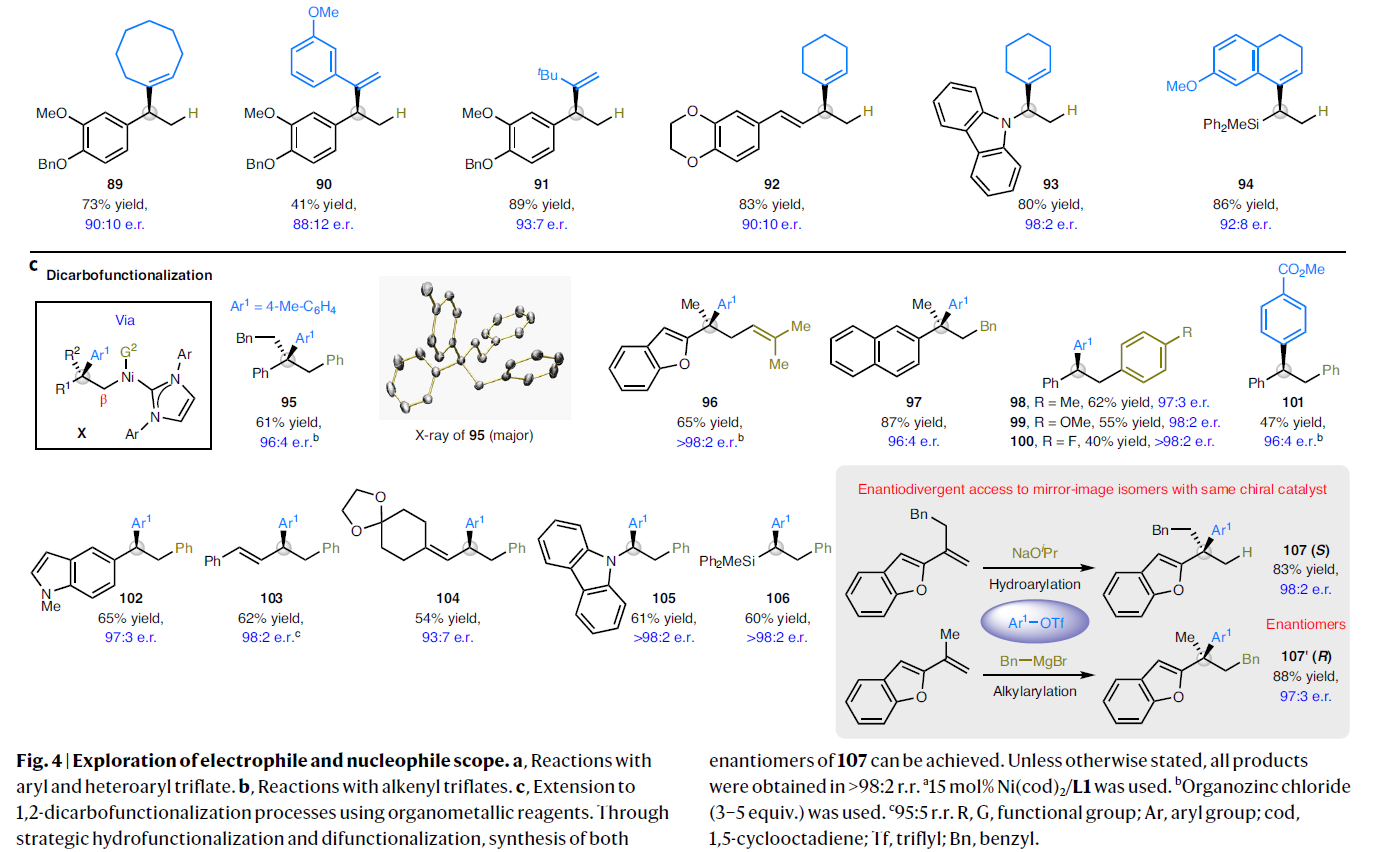
接下来,作者对碳亲电试剂的适用范围进行探索(Fig. 4)。实验结果表明,不同电性取代的芳基三氟甲磺酸酯(68-82)以及烯基三氟甲磺酸酯(83-94)均可以作为碳亲电试剂参与氢-芳基化(烯基化)过程,从而实现三取代或四取代手性中心的构建(Fig. 4a, 4b)。其中包括杂芳基、C(sp2)-Br、C(sp2)-Cl等官能团均可以兼容。最后,作者尝试使用有机金属亲核试剂来替代异丙醇钠来实现烯烃的双碳官能团化(Fig. 4c)。实验结果表明,一系列sp2-或sp3-杂化的有机镁和有机锌化合物可以作为有效的亲核试剂,以良好的区域选择性和对映选择性实现芳基烯烃和芳基(烷基)1,3-二烯的双碳官能团化过程,得到产物95-106。
(图片来源:Nat. Catal.)
总结
中科院上海有机所施世良课题组与新加坡国立大学许民瑜(Ming Joo Koh)课题组发展了镍催化的多组分烯烃交叉偶联反应策略,为不同取代烯烃和1,3-二烯的对映选择性碳官能化反应提供了一种通用的方法。作者通过使用大位阻的手性NHC-Ni(0)催化剂来有效促进选择性碳-镍化/官能团化串联反应过程,为高对映选择性实现含有三取代或四取代立体中心的分子骨架的构建提供了新思路。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn