

硫和氟是药物分子中主要的组成元素之一。含硫药物可用于治疗细菌感染、糖尿病、癌症、艾滋病和许多其它临床疾病。含氟生物活性化合物的有益药代动力学特性包括高代谢稳定性、通常低极性和可能改变药物的酸碱性质。因此,既含硫又含氟的药物将会越来越多。
目前,人们对二氟甲基硫醇和三氟甲基硫醚类药物的应用非常感兴趣。考虑到-CF3在修饰药物的极性、溶解度和代谢稳定性方面具有优异的性能,同时构建-CF3和含硫基团是一种具有复杂生物活性和精细药代动力学特性的现代药物设计方法。C-S键和C-F键的构建一直是合成化学的热点话题,对于它们的手性控制更是重中之重。作者提出了一个含-CF3的手性硫化合物的不对称合成方法。该方法可通过烯丙基α-CF3硼酸的硫代官能团化来实现。
尽管已经有报道说钯可以催化烯丙基硫化并用于合成手性烯丙基硫化物。但当α-CF3存在时,硼酸基团会与Pd在-CF3的α位形成M-L键,进而发生β-F消除。因此,必须避免在碳立体中心上积累负电荷。于是,作者选择了通过Lewis碱稳定的硫氮离子作为硫化试剂。该方法可高效合成各种芳基、烷基和三氟甲基硫醚,具有较高的选择性。
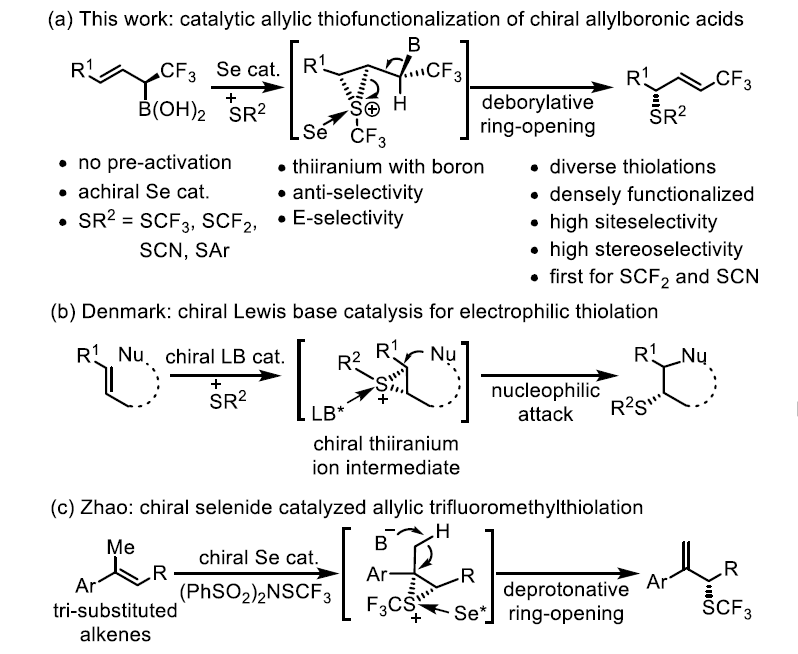
图1. 研究背景(图片来源:Angew. Chem. Int. Ed.)
随后,作者以1a-Bpin和2a为模型底物进行了条件筛选。最终确定最佳条件为在Tf2NH作为酸且Ph2Se作为催化剂时,可以在-20 ℃的条件下以81%的产率与98%/100%的ee/es得到目标产物。

图2. 条件筛选(图片来源:Angew. Chem. Int. Ed.)
作者在上述最佳反应条件下进行了底物拓展,发现反应具有极好的官能团耐受性。用苄基(1b)取代烷基 (1a)并不会改变反应的结果。1c中的-Cl可以保持较高的非对映性和位点选择性,但ee下降到88%。1d的酯基在反应中不受影响,使3d具有很高的选择性,为后续反应提供了两个可能的位点。苯酞酰亚胺衍生物1e可以转化为3e,它包含了药物设计的所有6个主要元素,有很大的机会进行进一步的不对称转化,这个过程还可以检测到α-SCF3产物的生成,X-射线衍射法可以确定晶体3e的绝对构型为(S)。考虑到结构的相似性和反应条件,作者在此基础上,初步确定了其它硫化产物的构型。作者预测在环己基(1f)被苯基(1g)取代的情况下,1f具有很高的非对映和对映选择性。然而,由于烯丙基重排破坏了1g的共轭体系,预计反应性和位点选择性会降低。实际上,在原本条件下虽然可以得到3g但收率很低,如果将催化剂改为(p-OMePh)2Se,用MsOH作为活化剂,可以53%的产率得到3g。作者还试图获得3g的类似物,但得到的是一系列混合物,可能是烯丙基硼酸在该反应条件下不稳定所致。另外,在标准条件下,带有大位阻叔丁基的化合物1h可以64%的产率得到产物3h且反应的对映选择性、非对映选择性和位点选择性均很好,这说明大位阻的烯基取代基并不影响反应的选择性。
二氟甲基硫醇的合成与修饰是现代药物设计中一颗冉冉升起的新星。-SF2H是羟基和硫醇官能团的生物等排体,而基于Lewis碱催化的不对称亲电二氟甲基硫化反应尚未见报道,手性-SCF2R的合成也无先例。上述不对称三氟甲基硫化反应的成功启发作者将同样的概念拓展到极具挑战性的二氟甲基硫化反应。在这类反应中,作者使用了由Billard课题组之前报道的苯胺基二氟甲基化试剂2b-c,并使用了更富电子的(p-OMePh)2Se催化剂以使反应更高效。此外,还需要过量的酸添加剂来抑制苯胺的亲核胺化。脂肪族烯丙基硼酸衍生物1a可以得到完全经过烯丙基重排反应的手性SCF2COOEt产物4a,该反应产率良好(60%),具有显著的立体、非对映和区域选择性。对于苄基和环己基烯丙基硼酸底物1b和1f来说,虽然它们的产率略低,但具有很高的选择性。
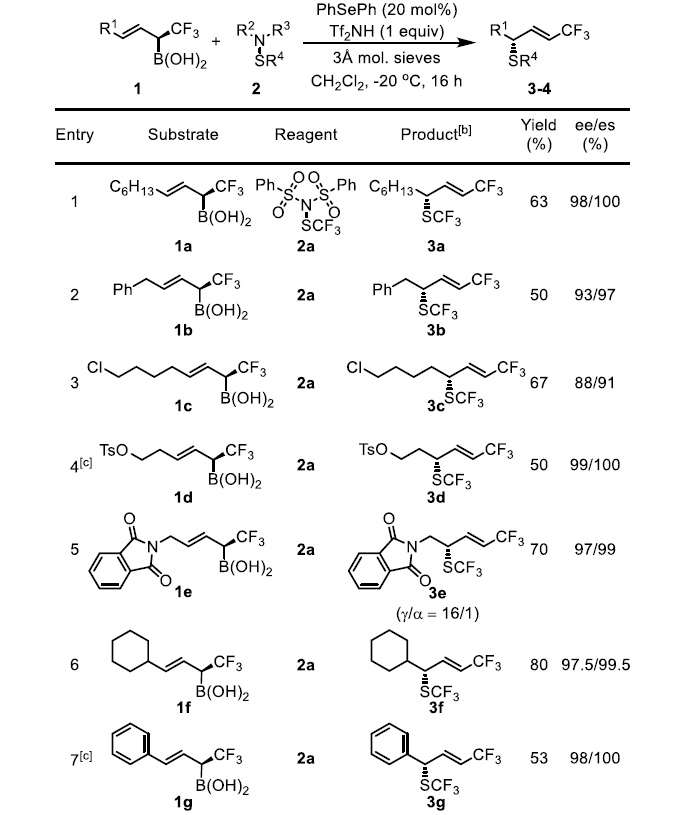
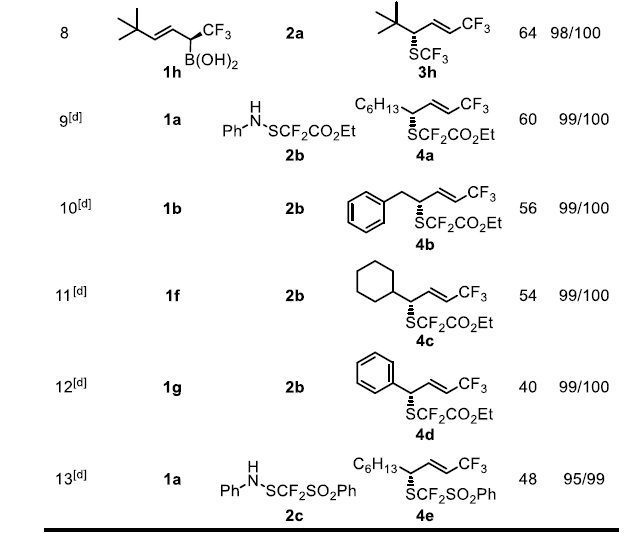
图3. 底物拓展一(图片来源:Angew. Chem. Int. Ed.)
考虑到硒催化烯丙基硼酸的转化通常具有良好的收率和非常高的选择性,作者试图将这一概念扩展到其它硫化反应。有机硫氰酸酯很容易转化为各种含硫药物中间体,但很少有方法可以实现它的不对称合成。作者使用SCN转移试剂2d在(p-OMePh)2Se存在下实现了烯丙基硫氰化反应。作者还研究了芳基硫代反应,但其区域选择性明显低于其它缺电子硫基团(-SCF3、-SCF2R或-SCN)。此外,作者还发现类似的溴化反应和氯化反应同样可以进行,但是氟化反应和碘化反应的结果复杂,无法分离出单一的目标产物。
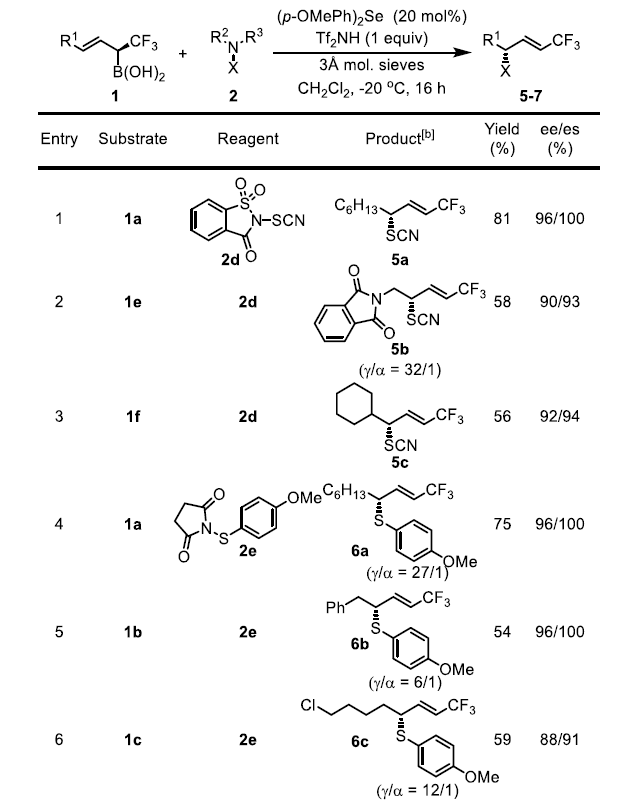
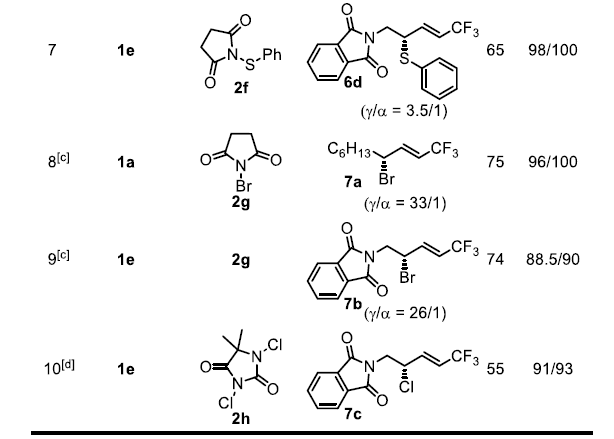
图4. 底物拓展二(图片来源:Angew. Chem. Int. Ed.)
基于上述结果和文献报道,作者提出如下反应机理。首先,Ph2Se和2a反应生成硒氮离子8。随后,8与1反应生成硫氮离子9,其中硫和硼酸酯中氧原子的相互作用基决定了该中间体的稳定性,又决定了反应的立体选择性。由于1e立体中心的绝对构型为(S),说明生成双键前硫鎓离子与-CF3处于反位。随后。亲核试剂(PhSO2)2NH的加入导致了去硼开环反应的发生,并经过反式消除得到目标产物3。
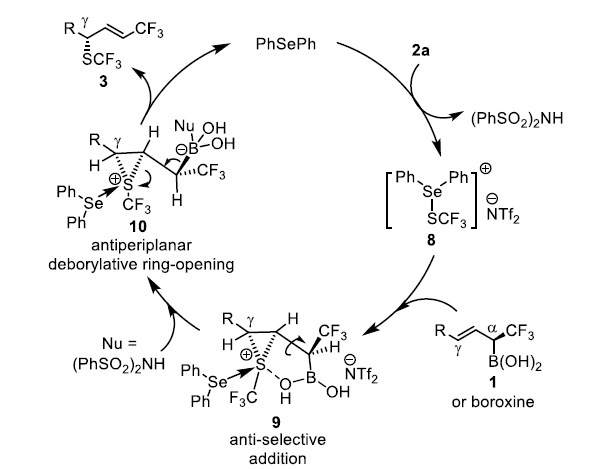
图5. 反应机理(图片来源:Angew. Chem. Int. Ed.)
总结 Kálmán J. Szabó课题组开发了一种高对映选择性、非对映选择性和位点选择性的方法,该方法适用于合成含-CF3基团的一些含硫化合物和含一个或多个用于进一步立体选择性衍生化手柄的密集功能化SCF3、SCF2R、SCN和SAr化合物,补充了手性-SCF2R和-SCN合成的空白。作者希望该反应可以用于设计包含所有6种基本元素(C, H, O, N, S, F)的多功能药物和合成含硫天然产物。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn