

(图片来源:J. Am. Chem. Soc.)
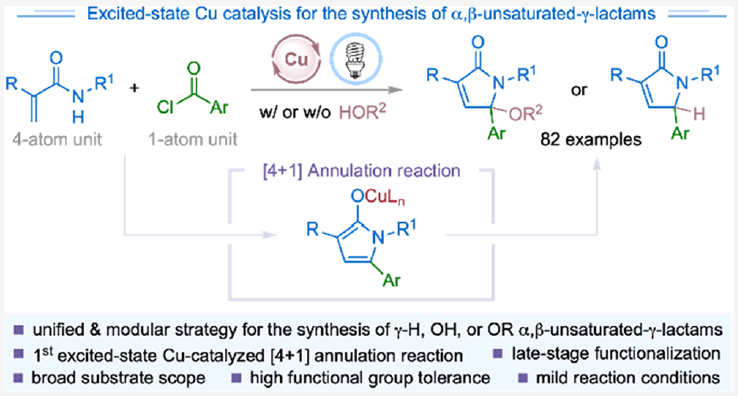
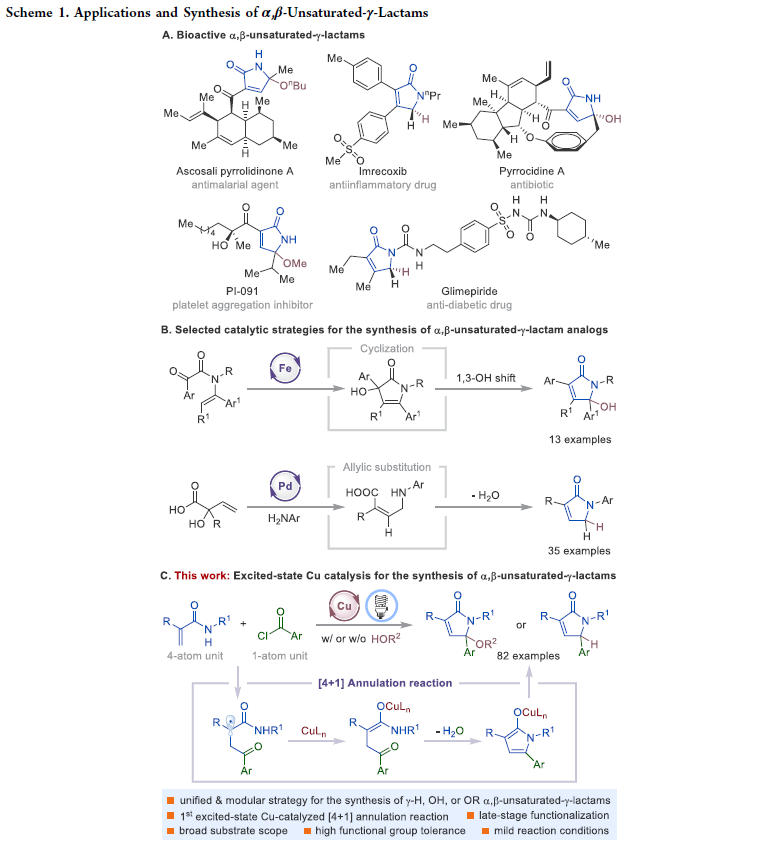
α,β-不饱和-γ-内酰胺是具有重要生物活性的天然产物和合成有机化合物的核心骨架(Scheme 1A)。此外,α,β-不饱和-γ-内酰胺还可以作为重要的合成砌块实现官能团化γ-内酰胺和吡咯的合成。因此,化学家们发展了许多化学计量以及催化的合成策略实现α,β-不饱和-γ-内酰胺的构建。例如,王梅祥院士课题组报道了铁催化三级烯酰胺的分子间环化、1,3-羟基迁移过程实现了γ-羟基化α,β-不饱和-γ-内酰胺衍生物的合成(Scheme 1B)。最近,Kleij课题组发展了钯催化的多米诺反应实现了γ-氢化的α,β-不饱和-γ-内酰胺衍生物的合成。尽管此领域取得了一定的进展,但是利用催化策略实现γ-烷氧基化的α,β-不饱和-γ-内酰胺衍生物的合成却很少见。因此,发展一种操作简单的模块化方法来实现一系列γ-烷氧基化、γ-羟基化以及γ-氢化的α,β-不饱和-γ-内酰胺的合成具有重要意义。
近年来,可见光诱导的激发态催化过程已成为有机合成中的重要工具。最近,使用廉价易得的铜络合物代替RuII和IrIII络合物作为光催化剂实现转化得到了广泛的关注。基于作者对激发态铜催化、自由基化学以及芳酰基自由基极性反转合成应用的兴趣,最近,美国纽约州立大学Christopher J. Johnson和Ming-Yu Ngai课题组发展了首例激发态铜催化的[4+1]环化反应,高效模块化合成了一系列γ-官能团化的α,β-不饱和-γ-内酰胺(Scheme 1c)。
(图片来源:J. Am. Chem. Soc.)
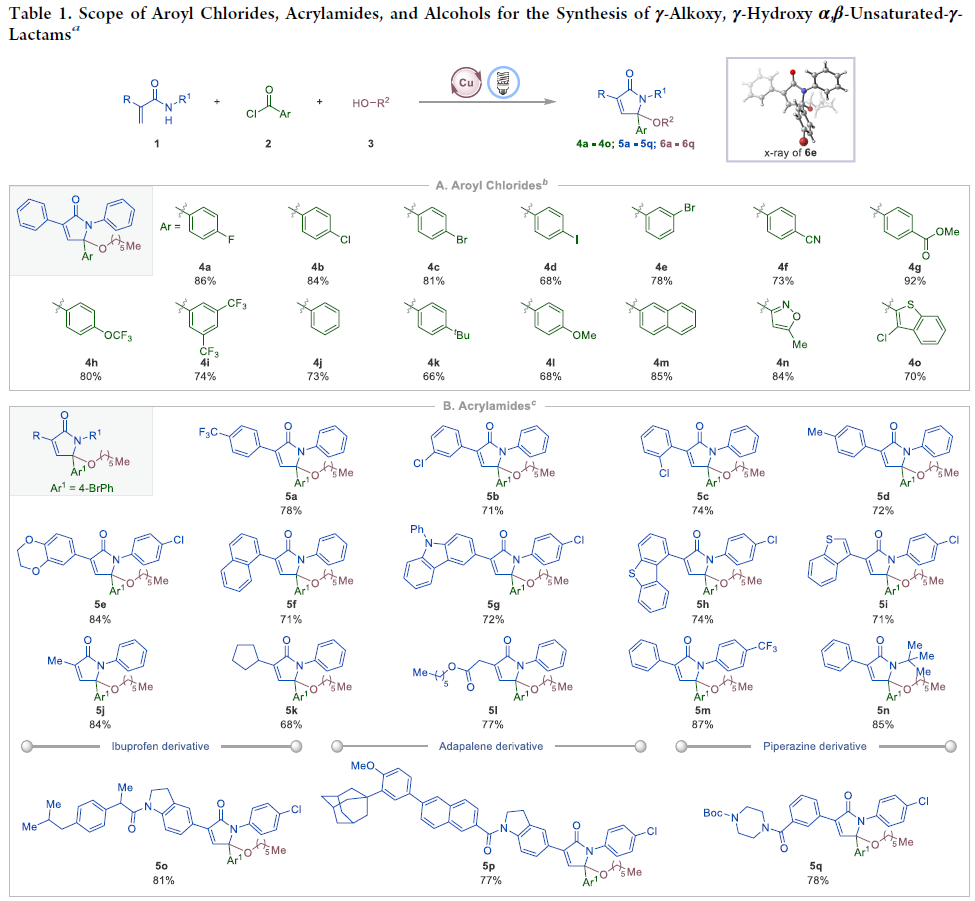
作者首先以N-2-二苯基丙烯酰胺1a、4-氟苯甲酰氯2a以及正己醇3r作为模板底物进行反应探索。通过一系列条件筛选作者发现当使用Cu2O (10.0 mol%), rac-BINAP (20.0 mol%)在对二甲苯/DCE(1:1)(0.1 M)中,100W蓝光LED照射下室温反应22小时可以以98%的核磁产率得到目标γ-己氧基化α,β-不饱和-γ-内酰胺产物4a。控制实验表明铜催化剂、rac-BINAP配体以及光的照射对反应至关重要,且缺一不可。值得注意的是,当使用Ru或Ir类光催化剂时并没有得到目标产物,由此表明铜催化基具有的独特反应活性。
在得到了最优反应条件后,作者分别对(杂)芳酰氯、烯酰胺和醇的底物范围进行探索(Table 1)。此反应可以适用于一系列不同电性取代的(杂)芳酰氯,以中等至良好的产率得到产物4a-4o。一系列官能团,如卤素、氰基、酯基、三氟甲基、三氟甲氧基、叔丁基、甲氧基,杂环等均可兼容。遗憾的是,烷基酰氯不能实现此转化(Table 1A)。此外,此体系还可以兼容不同电性取代的丙烯酰胺衍生物(5a-5n)。值得注意的是,一些具有生物活性的复杂分子(如ibuprofen, adapalene, piperazine等)衍生物也可以实现此转化,证明了此方法的实用性(Table 1B)。最后,作者发现水、一级醇、二级醇均可参与反应实现γ-羟基化(6a)和γ-烷氧基化(6b-6q)产物的合成。并且体系同样可以兼容nerol(6p)和(−)-citronellol(6q)等一系列天然醇类(Table 1C)。
(图片来源:J. Am. Chem. Soc.)
在进行底物拓展时,作者发现当使用2-三氟甲基苯甲酰氯反应时仅以11%的产率得到目标γ-烷氧基化α,β-不饱和-γ-内酰胺产物,且体系中观察到了γ-氢化α,β-不饱和-γ-内酰胺产物7a的生成。随后作者在不添加醇的情况下对反应体系进一步优化,可以以91%的产率得到γ-氢化产物7a。且通过对不同取代的芳基酰氯和丙烯酰胺探索,反应同样展现出良好的底物适应性(7a-7t, 60-91%, 8a-8m, 56-91%)。其中三氟甲基(7a,7j)、三氟甲氧基(7l,7m)、氰基(7h)、卤素(F:7b,7j,7k; Cl:7c,7g,7k,7r,7t; Br:7d-7f,7i)以及药物相关的杂芳环(8m)均可兼容,展现出良好的官能团兼容性。值得注意的是,利用此转化合成出的82种产物中有80种是新化合物,这为新的药物、农药以及功能材料的探索提供了新的化学空间(Table 2)。

(图片来源:J. Am. Chem. Soc.)
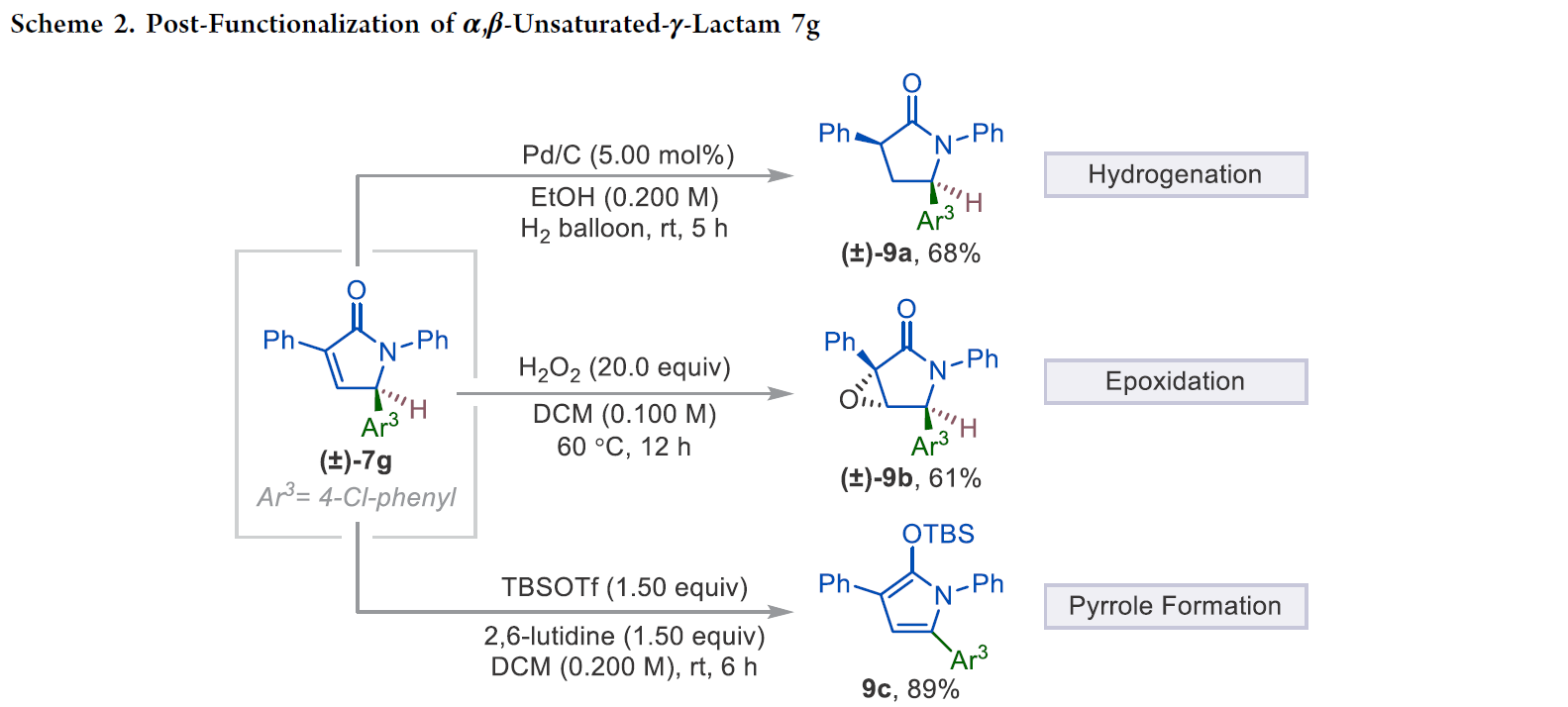
接下来,为了证明α,β-不饱和-γ-内酰胺产物的应用性,作者进行了一系列合成转化(Scheme 2)。首先,作者利用产物7g在Pd/C,H2 (1 atm)存在的条件下以68%的产率,>20:1的非对映选择性得到相应的γ-内酰胺产物9a。此外,产物7g还可以与过氧化氢反应以61%的产率得到环氧产物9b。值得注意的是,7g还可以在室温下与TBSOTf反应,以89%的产率实现TBS保护的吡咯产物9c。
(图片来源:J. Am. Chem. Soc.)
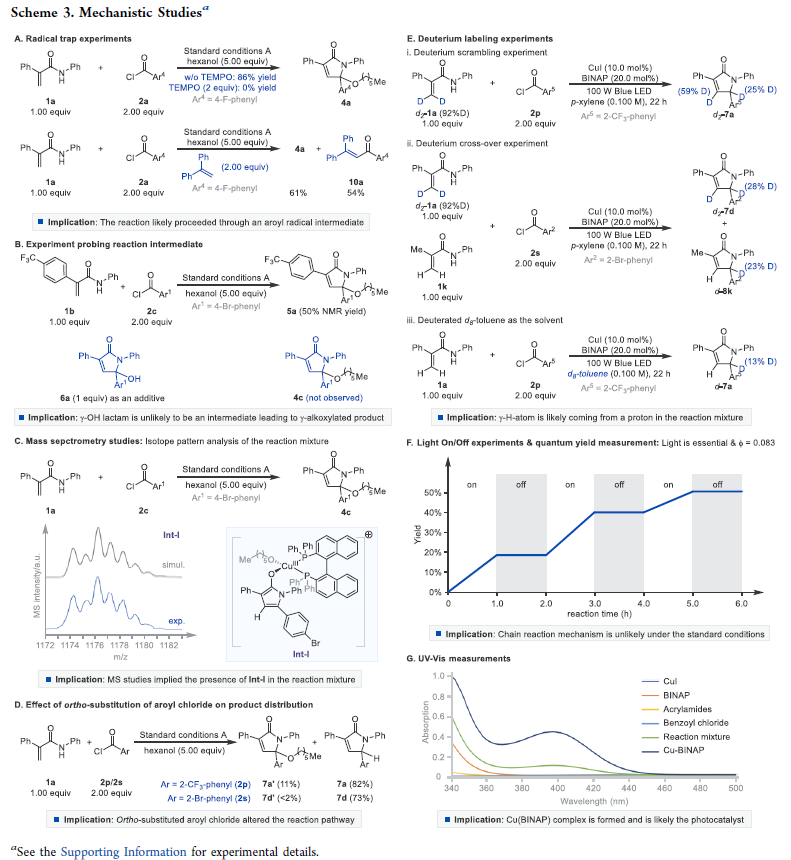
为了深入理解反应机理,作者进行了一系列控制实验(Scheme 3),并得出以下结论:1)自由基捕获实验表明反应中可能涉及芳酰基自由基中间体(Scheme 3A);2)γ-羟基化产物并不是生成γ-烷氧基化产物的中间体(Scheme 3B);3)反应中涉及铜络合物Int-I的形成(Scheme 3C);4)当芳环邻位有取代时,主要生成γ-氢化产物(Scheme 3D);5)氘代实验表明γ-氢化产物中的氢原子即来源于丙烯酰胺又来源于溶剂(Scheme 3E);6)开关灯实验表明反应不在光照下是不发生的。且在标准条件下生成的γ-氢化产物的量子产率为0.083,这意味着自由基链式过程是不可能发生的(Scheme 3F);7)通过CuI−BINAP的UV−Vis吸收波谱可以得出反应中含有CuI−BINAP光活性络合物(Scheme 3G)。
(图片来源:J. Am. Chem. Soc.)
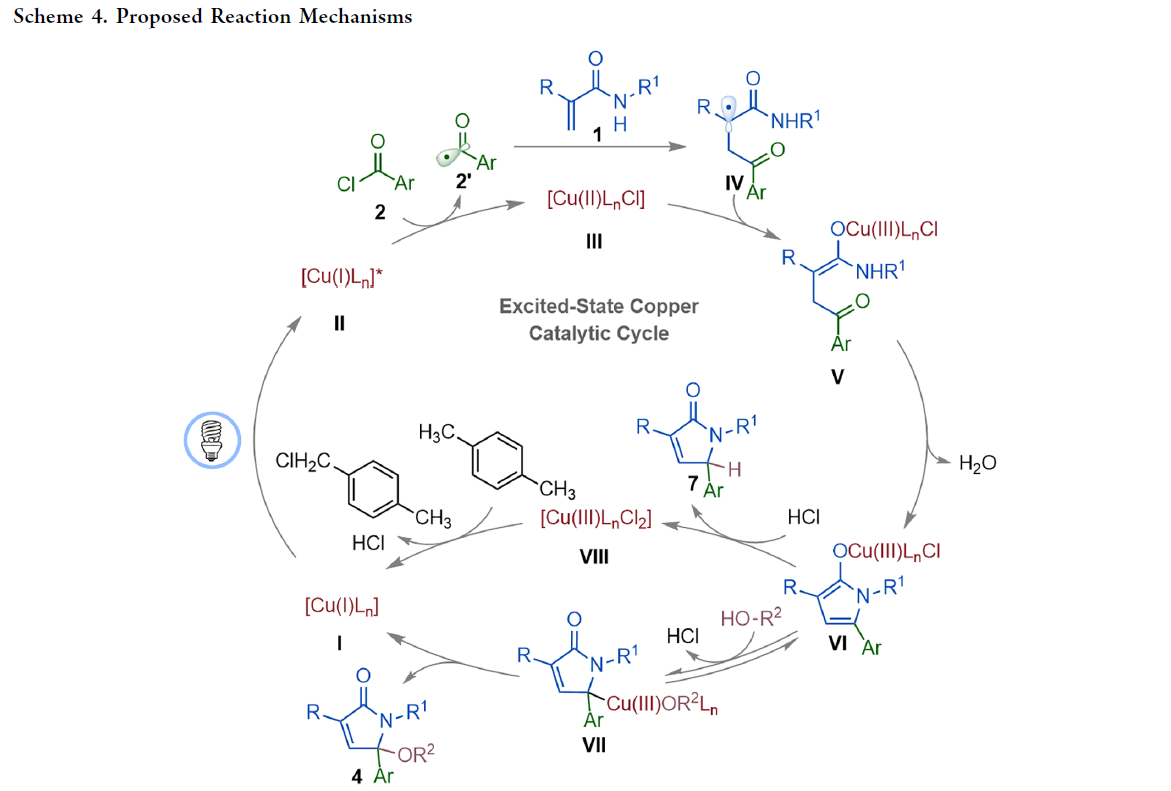
基于上述控制实验,作者提出了此转化可能的反应机理(Scheme 4)。首先,蓝光激发CuI−BINAP络合物I形成激发态*[CuI−BINAP]络合物II。随后络合物II还原芳基酰氯2形成铜络合物III并释放芳酰基自由基2’。接下来,2’与丙烯酰胺1中的烯烃加成得到三级烷基自由基中间体IV,其可以被III捕获形成中间体V。接着,V发生分子内缩合得到中间体VI。当体系中存在醇的时候,VI经历配体交换、铜中心向γ-位迁移和还原消除过程得到γ-烷氧基化产物4并再生铜催化剂I。当体系中不存在醇或者使用邻位取代的芳酰基氯时,络合物VI将经历质子化和互变异构形成γ-氢化产物7和铜物种VIII。最后VIII被对二甲苯还原得到铜催化剂I完成催化循环。
(图片来源:J. Am. Chem. Soc.)
总结
美国纽约州立大学Christopher J. Johnson和Ming-Yu Ngai课题组发展了首例激发态铜催化的[4+1]环化反应,模块化实现了一系列α,β-不饱和-γ-内酰胺的合成。此反应条件温和,底物适用性好,可以兼容一系列复杂天然产物和药物分子骨架。此外,合成出的产物α,β-不饱和-γ-内酰胺可以经多种合成转化实现一系列有用杂环的合成。机理研究表明反应经历了激发态Cu(BINAP)催化,通过单电子转移、铜物种对自由基中间体的捕获以及还原消除或质子化过程得到目标产物。此反应的发展为α,β-不饱和-γ-内酰胺骨架的合成提供了新思路。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn