

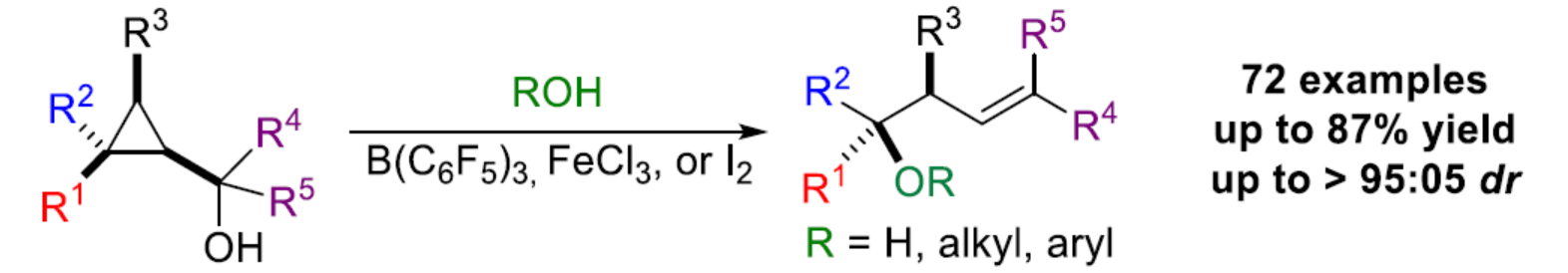
(图片来源:Angew. Chem. Int. Ed.)
在过去的几十年中,化学家们已经投入了大量精力来控制构建具有手性中心序列的开链(open-chain)分子砌块,例如聚酮类天然产物。在广泛研究的几种策略中,烯丙基金属试剂与羰基的加成占据了主导的地位。这一成功的关键特征是可预测性水平、高非对映和对映选择性、潜在试剂的金属基多样性、高烯丙醇产物的潜在功能性。尽管该领域已取得一定的进展,但对于1,3-二取代烯丙基金属的反应性控制仍具有难度(Scheme 1a)。当R3和R4是两个相似的烷基时(R3≠R4= alkyl),如何控制其中一种亲金属(metallotropic)的平衡,则极具挑战性。最近,Ilan Marek课题组(J. Am. Chem. Soc. 2020, 142, 5543; J. Am. Chem. Soc. 2022, 144, 7066; Chem. Sci. 2020, 11, 9378; Angew. Chem. Int. Ed. 2022, 61, e202203673.)报道了在Lewis酸存在下,一系列亲核试剂(TMSX、Cl3CCO2H、TMSN3、HBF4和R3Al)能够促进多取代环丙基甲醇(和环丙基酮)中取代最多的碳中心进行选择性的开环(Scheme 1b)。同时,理论计算研究表明,非经典的环丙基甲基(cyclopropylcarbinyl)阳离子A是一种稳定的中间体,其在最多取代的季碳中心以立体反转的方式进行亲核取代反应。当使用该策略用于高烯丙基醇2的合成时,需在Lewis酸存在下,contra-intuitiv加入水(或醇)。然而,许多反应性中间体和催化剂均被水分解,特别是在水中不稳定且不相容的Lewis酸。
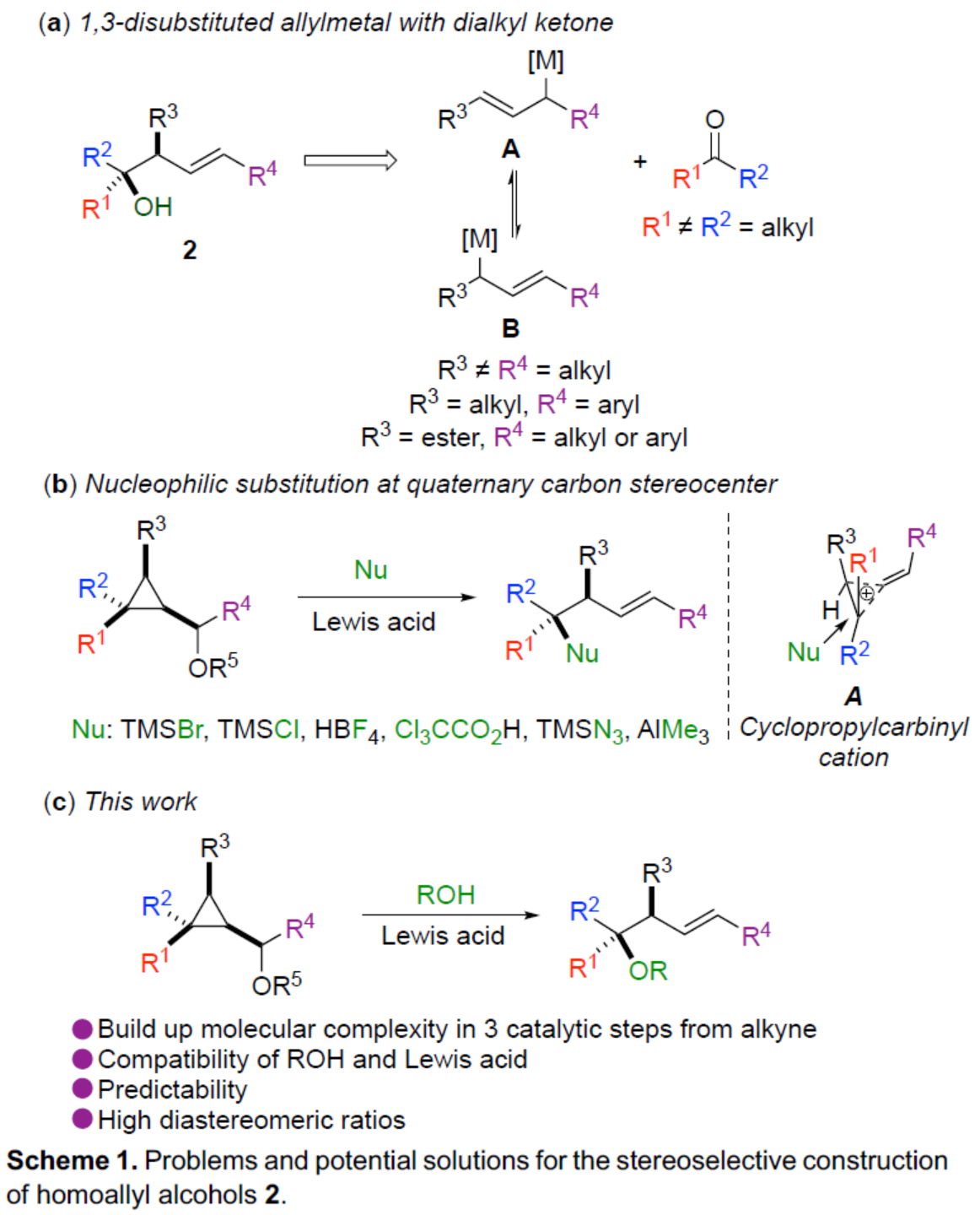
(图片来源:Angew. Chem. Int. Ed.)
近年来,使用水作为氧源用于高度立体选择性构建C-O键的新方法,极具吸引力。尽管现在越来越多的有机转化可在水中顺利进行反应,作者认为,在水存在下,强Lewis酸B(C6F5)3通常用于促进形成高活性阳离子催化剂用于烯烃聚合。在这种情况下,水与B(C6F5)3配位以生成新的配合物,该配合物可成为强Bronsted酸,可促进醇的活化。近日,Ilan Marek课题组报道了一种高效的策略,仅需三个催化步骤,即可从易得的炔烃底物中合成一系列具有价值的手性三级高烯丙基醇和醚衍生物。其中,前两步反应涉及Rh-催化的环化反应以及Cu-催化的加成反应(Scheme 2)。同时,通过上述两步反应,可在环丙基甲醇衍生物1中的C1、C2和C3-位形成为单个非对映体,dr(C1:C2:C3) > 95:05:0:0。值得注意的是,甲醇中心的立体化学对转化的最终立体化学结果没有影响。
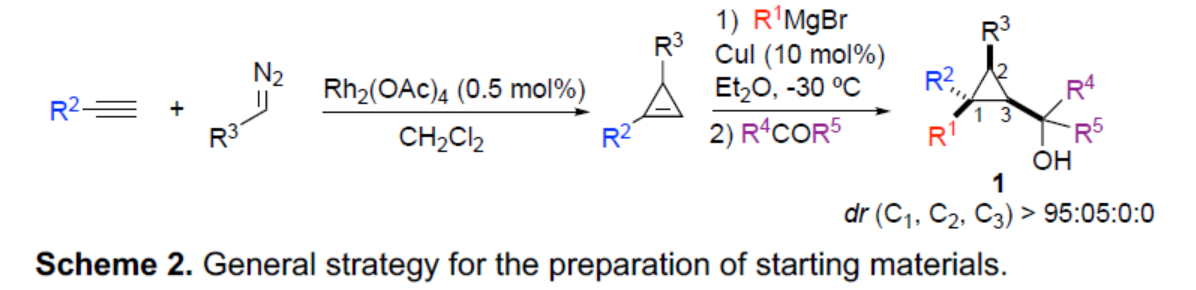
(图片来源:Angew. Chem. Int. Ed.)
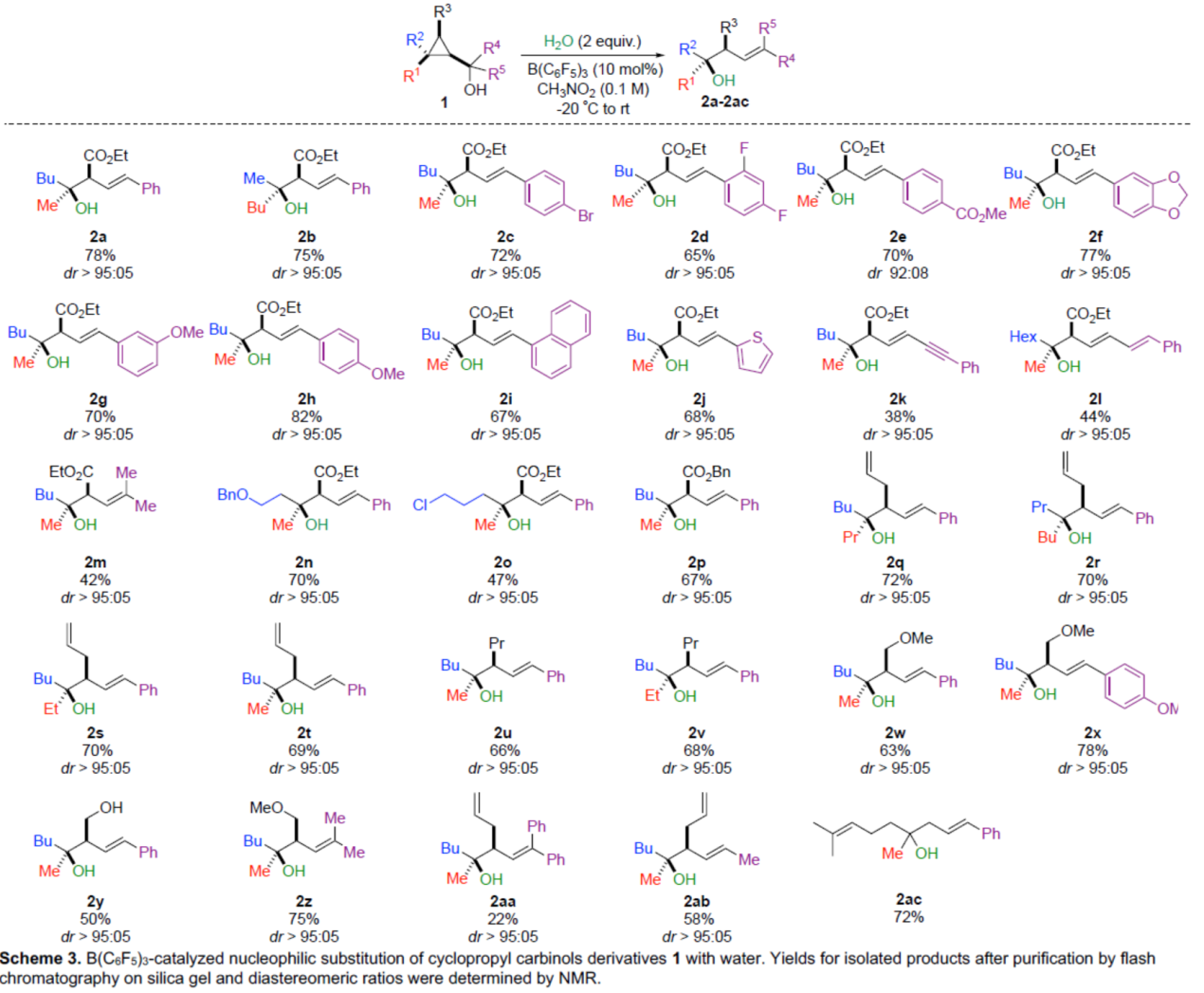
首先,作者以1a作为模型底物,进行了相关反应条件的筛选。当以B(C6F5)3作为催化剂,H2O作为亲核试剂,在CH3NO2溶剂中室温反应12 h,可以78%的收率得到产物2a,dr > 95:05。重要的是,亲核取代仅发生在季碳手性中心上,并且通过形成环丙基甲基(cyclopropyl carbinyl)阳离子A从而使选择性更为合理化。
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 3)。首先,当底物1中的R1或R2为甲基或丁基时,均可顺利反应,获得相应的产物2a-2b,收率为75-78%,dr > 95:05。当底物1中的R4或R5为不同电性取代的芳基、噻吩基、萘基时,也能够顺利反应,获得相应的产物2c-2j,收率为65-82%,dr > 95:05。当底物1中的R4或R5为炔基、烯基、甲基时,可获得相应的产物2k-2m,收率为38-44%,dr > 95:05。其次,当底物1中的R2为烷基时,可获得相应的产物2n-2o,收率为47-70%,dr > 95:05。当底物1中的R3为-CO2Bn、烯基、-Pr、-CH2OMe、-CH2OH时,均可顺利反应,获得相应的产物2p-2ab,收率为22-78%,dr > 95:05。此外,由香叶醇合成的环丙基甲醇1ac,也是合适的底物,可以72%的收率得到产物2ac。值得注意是,一系列活性基团,如烯基、炔基、卤素等,均与体系兼容。
(图片来源:Angew. Chem. Int. Ed.)
紧接着,通过对反应条件的再次优化后发现,当以FeCl3作为催化剂时,一系列醇和酚底物,也可顺利反应,获得相应的三级烷基醚产物(Scheme 3)。首先,当使用甲醇作为亲核试剂时,可获得相应的产物3a-3j,收率为52-87%,dr > 95:05。其次,一系列不同取代的烷基醇底物,也能够顺利进行反应,获得相应的产物3k-3u,收率为34-65%,dr > 95:05。此外,一系列二级醇和三级醇底物,也是合适的底物,获得相应的产物3v-3ac,收率为28-65%,dr > 95:05。同时,该策略还可以扩展到通过分子内亲核取代反应合成环醚产物3ad,收率为80%,dr为90:10。值得注意的是,该反应具有出色的官能团兼容性。
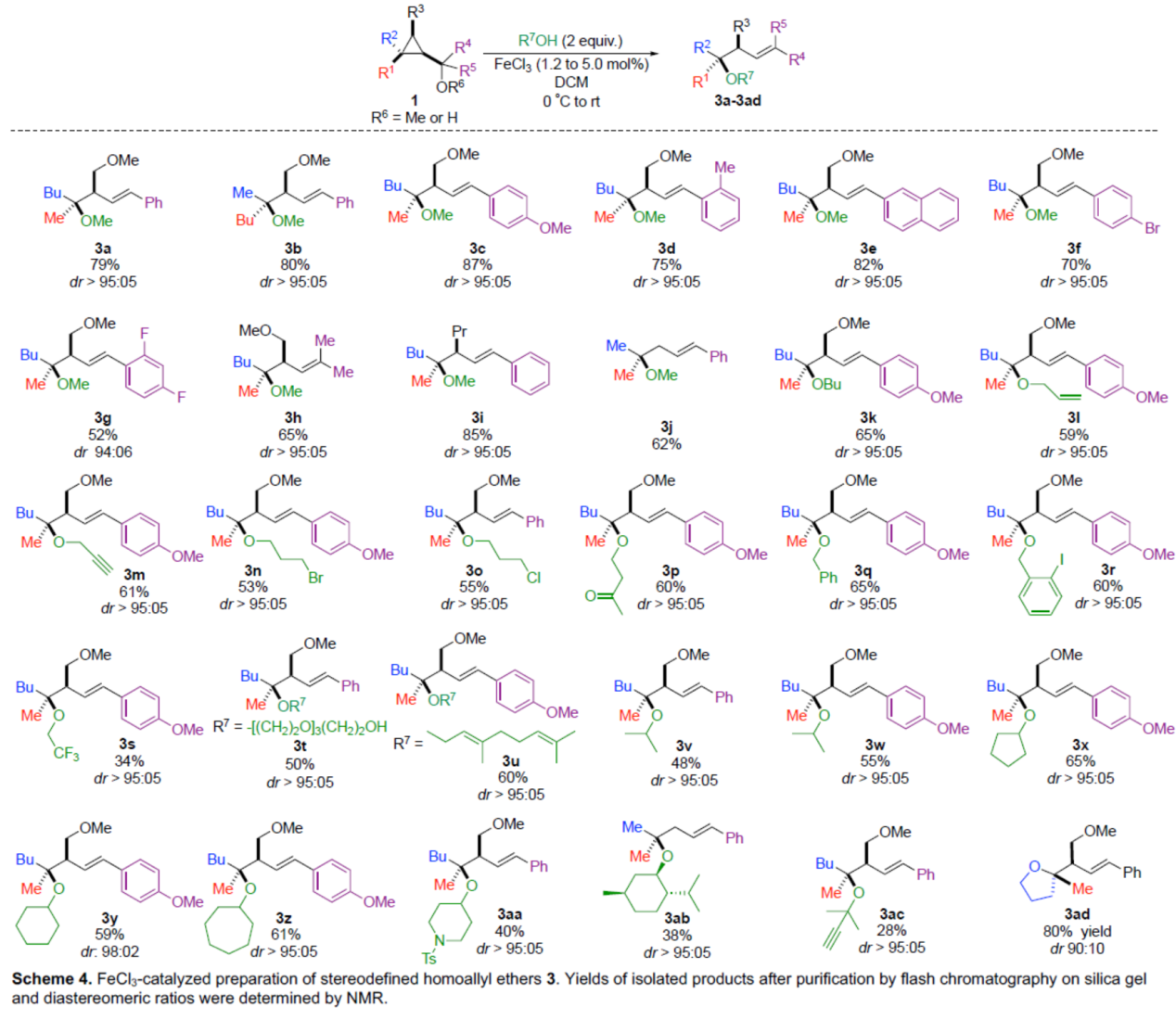
(图片来源:Angew. Chem. Int. Ed.)
此外,当使用I2作为催化剂时,一系列具有不同电性取代的苯酚,均可与1顺利反应,获得相应的产物4a-4m,收率为38-78%,dr > 94:06(Scheme 4)。
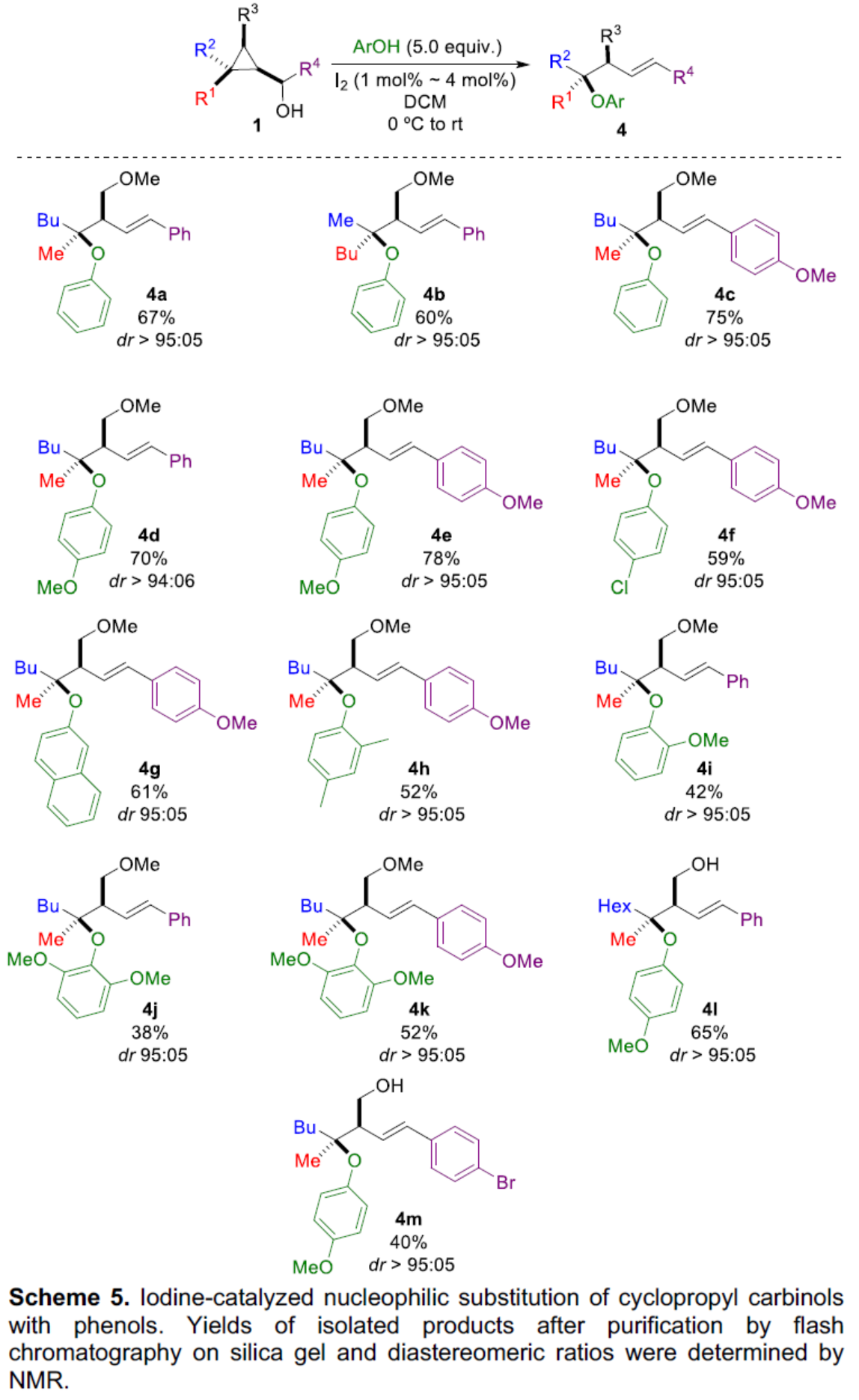
(图片来源:Angew. Chem. Int. Ed.)
总结 以色列理工学院Ilan Marek课题组报道了一种高效的立体选择性构建三级C-O键的方法,其中使用水、醇和酚作为亲核试剂,涉及在环丙基甲醇衍生物的季碳手性中心处进行高度区域和立体选择性亲核取代的过程。同时,该反应具有反应条件温和、底物范围广泛、官能团兼容性良好、化学选择性出色等特点。此外,该策略是立体选择性合成三级高烯丙基醇和醚衍生物的一种新型的途径。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn