

在过去的十年中,自由基反应在合成化学中扮演了重要角色,在化学键的构建和合成路线的简化方面有着重大突破。在考虑自由基中间体反应时,作者认为当自由基寿命足够长时可以作为活化基团,并在远端位点实现非常规极性反应。许多以杂原子为中心的官能团(如醇、胺、硫醇和膦),当其Hammett取代基常数(σ)为负或接近0.3时被认为是富电子的或电中性的;相反,这些自由基则是缺电子的。因此,作者认为这些亲电自由基不仅可以广泛参与加成、碎裂和官能团转移反应,还可以作为强吸电子基团活化底物,实现本不可能的反应。在芳烃官能团化的背景下,作者利用芳基X−H键的可逆均裂实现了瞬时极性反转,利用氧自由基中间体实现了富电子卤酚的芳香亲核取代反应(SNAr)。
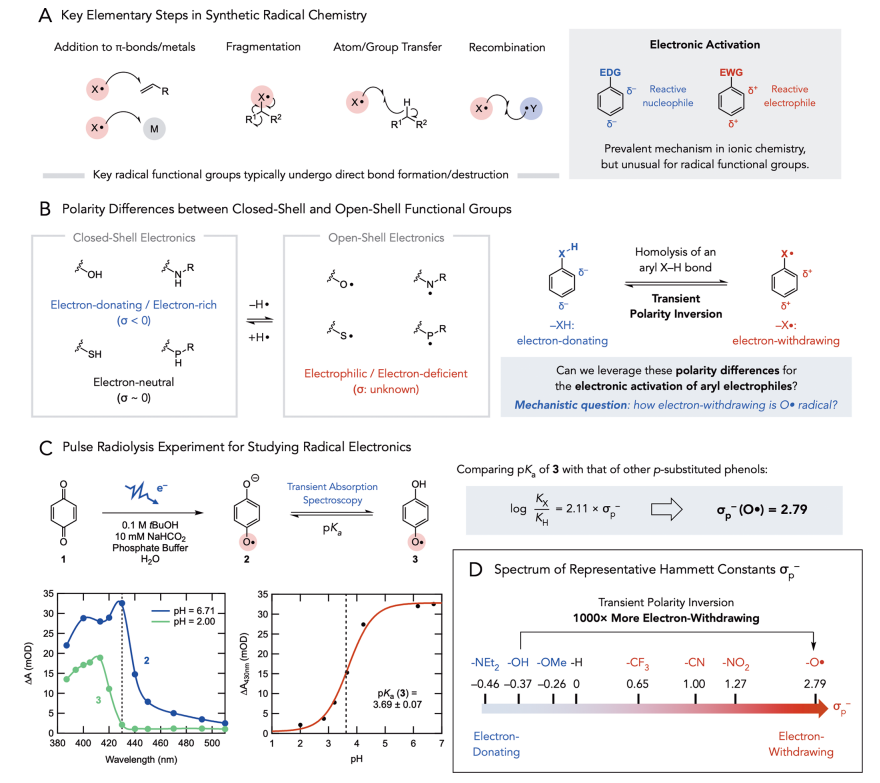
图1. 研究背景(图片来源:J. Am. Chem. Soc.)
为了验证这一假设,作者对自由基的吸电子能力进行量化。Pratt课题组先前的研究提出O•和NH•具有很强的吸电子能力,且分别粗略估计了Hammett常数σp为2和1。为了使数据更精确,作者采用脉冲辐射分解法测量半醌的pKa。半醌自由基相当于一个p-(O•)取代的苯酚,因此它的pKa可以用来计算O•自由基的Hammett常数σp−,先前对半醌自由基的脉冲辐射分解研究表明,其酸性显著增强。在作者的研究中,半醌自由基可以在含有苯醌1和最小浓度的叔丁醇(0.1 M)和甲酸钠(10 mM)的水溶液缓冲溶液中生成,在pH=6.71和2.00时可分别观察到生成的半醌自由基阴离子2和中性半醌自由基3的紫外-可见吸收。通过在不同pH值条件下430 nm处的吸收,作者测定了2和3的相对浓度,随后用Henderson - Hasselbalch方程拟合滴定曲线,得到3的pKa为3.69(±0.07),说明3的酸性明显明显增强,对应于σp−(O•)值为2.79 (vs σp−(NO2) = 1.27),支持了此前的假设。
于是,作者通过上述的假设与验证实现了氟酚的SNAr。SNAr是有机化学中研究得最好和应用最广泛的一类反应,然而,由于与脱芳构化相关的高动力学障碍,SNAr通常需要使用缺电子的芳香亲电试剂与强亲核试剂如醇盐或硫醇盐结合。考虑到这一问题,作者着手设计一种体系,使得酚O−H键均裂后得到强吸电子基团氧自由基,并暂时性地使芳环亲电。芳基氧自由基的相对较长寿命可以适应较慢的亲核取代反应。
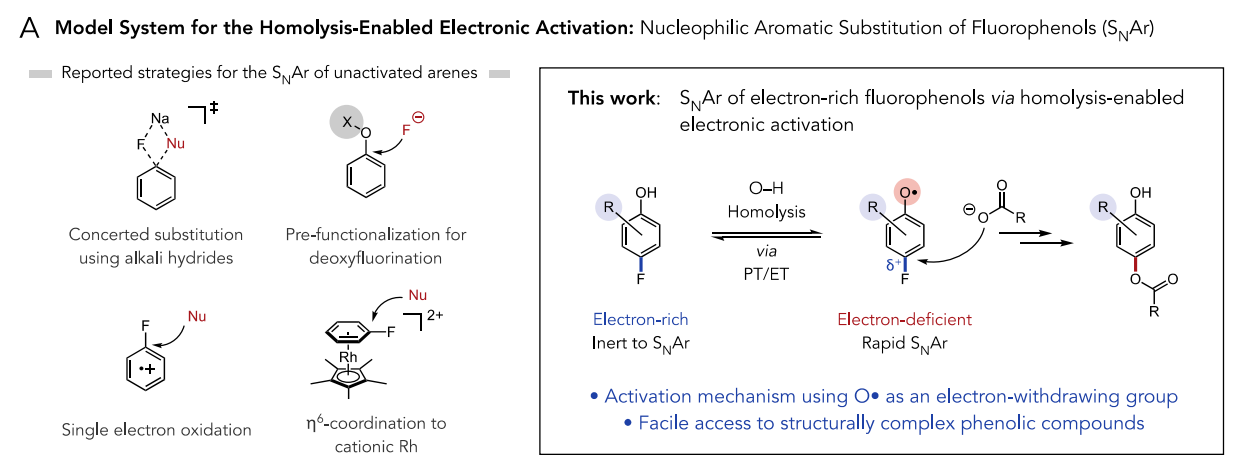
图2. 反应设计(图片来源:J. Am. Chem. Soc.)
随后,作者以2,6-二甲基-4-氟苯酚以模型底物进行条件筛选。在对O−H键均裂的多种方法进行筛选后,作者确定最佳条件是80 °C时,苯甲酸(1.5 eq.)和碳酸氢钠(1.5 eq.)、催化量的氢氧化钠(20 mol%)和氧化剂铁氰化钾(20 mol%)在乙腈水溶液(0.1 M)中反应,可以76%的收率得到目标产物4。
接着,作者在最佳条件下进行了底物拓展。首先是对酚类底物的拓展。不同邻位取代基的酚(烯丙基、苯基、萘基和芘基 5-9)可以以良好的效率得到目标产物(产率46-61%)。值得注意的是,该反应可以兼容给电子取代基(6,产率61%),与传统的SNAr相比这是一巨大进步。具有不同电性的苯基取代基的酚同样可行(10-15, 产率31-90%)。即使有其它氟芳烃和氯芳烃存在,取代也只发生在与O-H的对位。具有缺电子取代基的酚(15和18)反应活性降低,可能是由于这些底物的较高氧化电位和具有吸电子取代基的自由基中间体稳定性有限。为了克服这些限制,三氟化银是一种相对于铁氰化钾更强的氧化剂,可以用来提升反应效率,在硅氧基、酯基和氨基甲酸酯存在时效果极佳(19-21,产率70-95%)。然而,没有邻位取代基的氟酚不能得到目标产物,可能是氧自由基的二聚反应的竞争造成的。
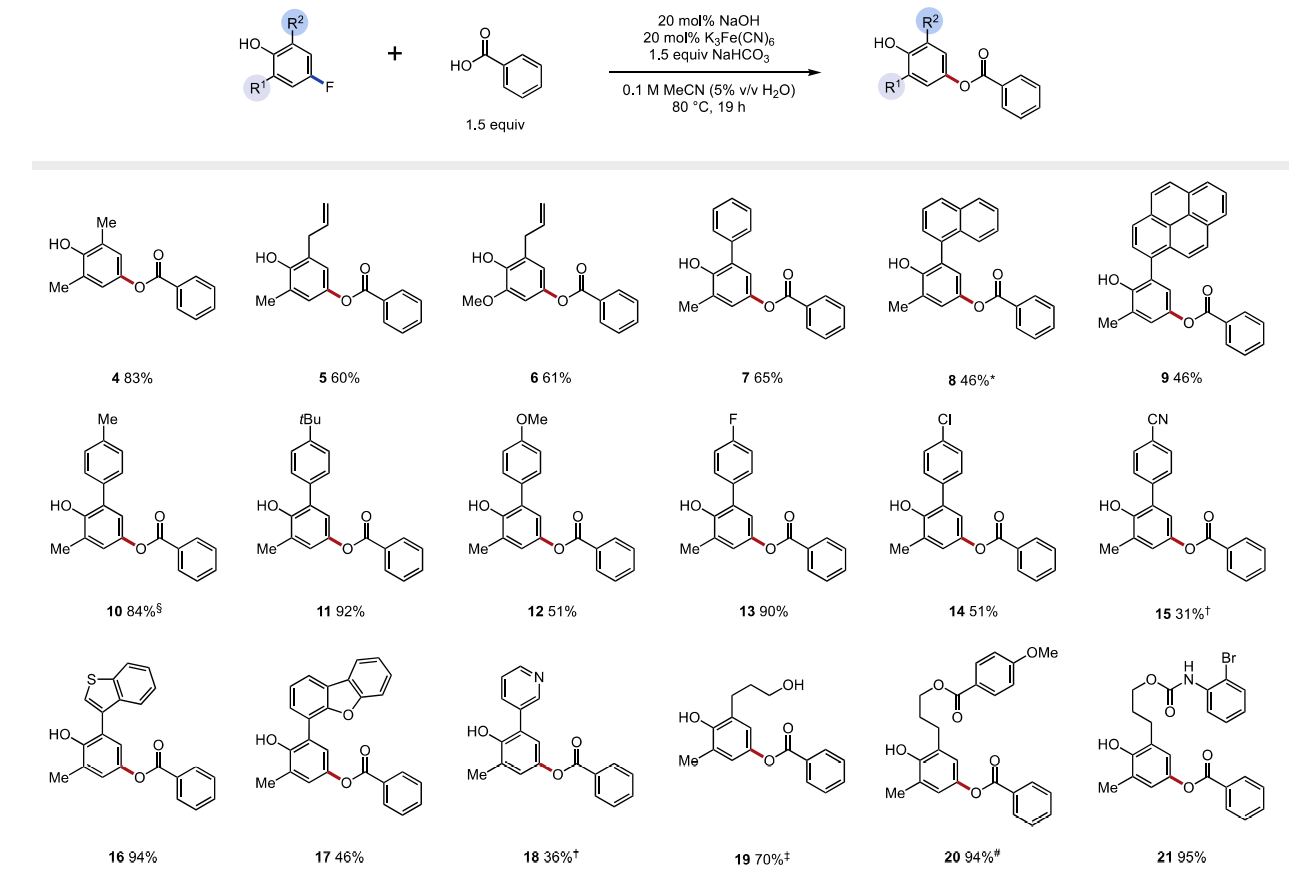
图3. 底物拓展一(图片来源:J. Am. Chem. Soc.)
接下来,作者又考察了亲核试剂的适用范围。作者发现富电子(22-24, 产率62-85%)和缺电子(25-28,75-78%产率)的芳基羧酸均能以良好的收率获得各种苯甲酸衍生物。苯甲酸类亲核试剂邻位、间位和对位的卤化物取代基在温和的反应条件下具有良好的耐受性,允许产物的进一步官能团化。该策略也成功地应用于药物活性化合物贝沙罗素和阿塔卢伦的衍生化(32-33)。除芳基羧酸外,烷基羧酸(34-39)也是反应中适宜的底物。值得注意的是,一系列受保护氨基酸(43-50)在取代反应中兼容,可以在C端选择性地形成C−O键。该方法对游离羧酸基偶联具有高选择性,产物无异丙烯化。最后,4-氯代-2,6-二甲基酚也是一种有效的亲电试剂,可以与许多芳基和烷基羧酸酯(4,25,32,36和47)发生有效反应,由于氯酚是很容易获得的底物,这一发现使该方法更具价值。
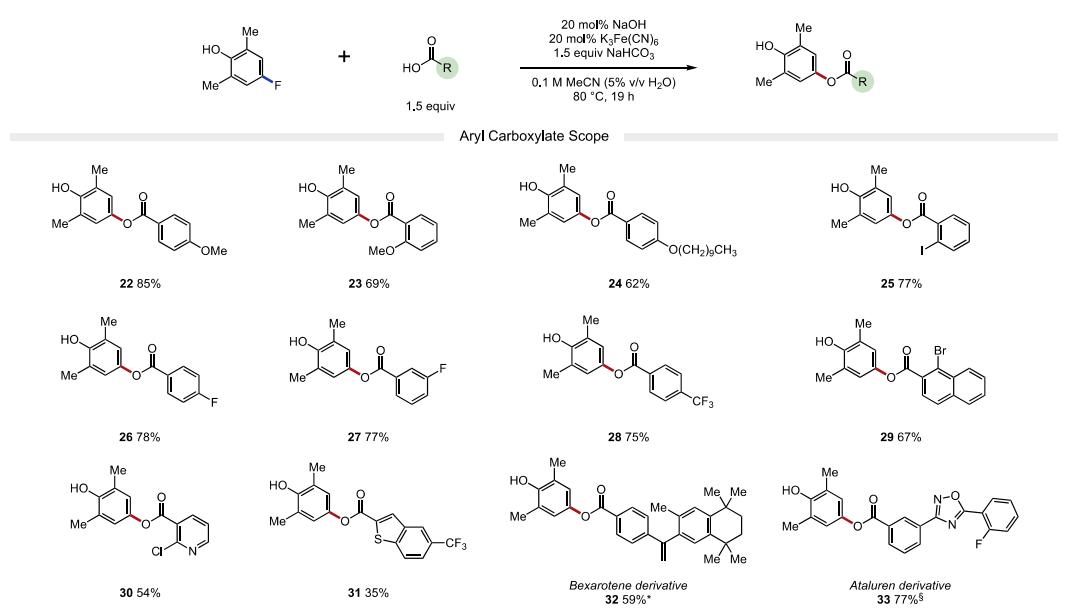
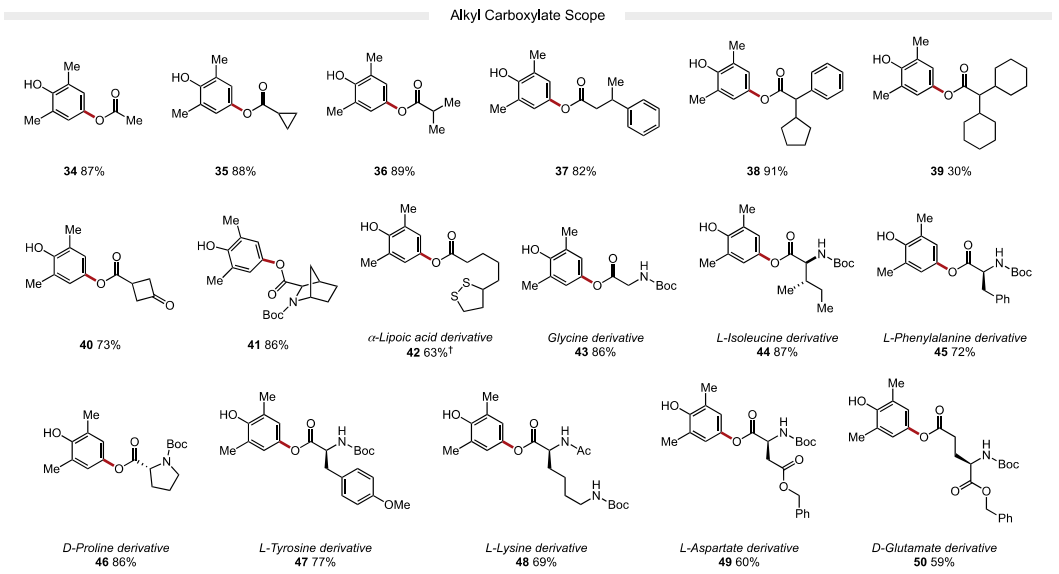
图4. 底物拓展二(图片来源:J. Am. Chem. Soc.)
最后,作者对这一反应的机理进行阐述。作者认为该反应通过自由基机理进行,该反应经过碱和铁(III)氧化剂与底物a的逐步质子转移/电子转移(PT/ET)过程后生成关键的氧自由基中间体b。瞬态吸收光谱数据显示,在激光光解实验中生成的氧自由基确实寿命足够长,可以进行后续反应(t1/2 = 690 μs)。缺电子的氧自由基中心可以有效激活芳环,与相应酸的原位脱质子形成的亲核试剂进行SNAr。生成的中间体c与另一个分子a进行快速的氢原子交换得到目标产物和b,后者继续参与自由基反应。作者采用多种自由基引发剂进行反应,发现该反应的链传递并不依赖于链引发过程。此外,作者利用低温(10 K)电子顺磁共振(EPR)实验对关键自由基中间体b进行了检测,反应体系中生成的自由基g-factor为2.0049,与此前报道数值一致,证明反应确实经历了b这一关键中间体。
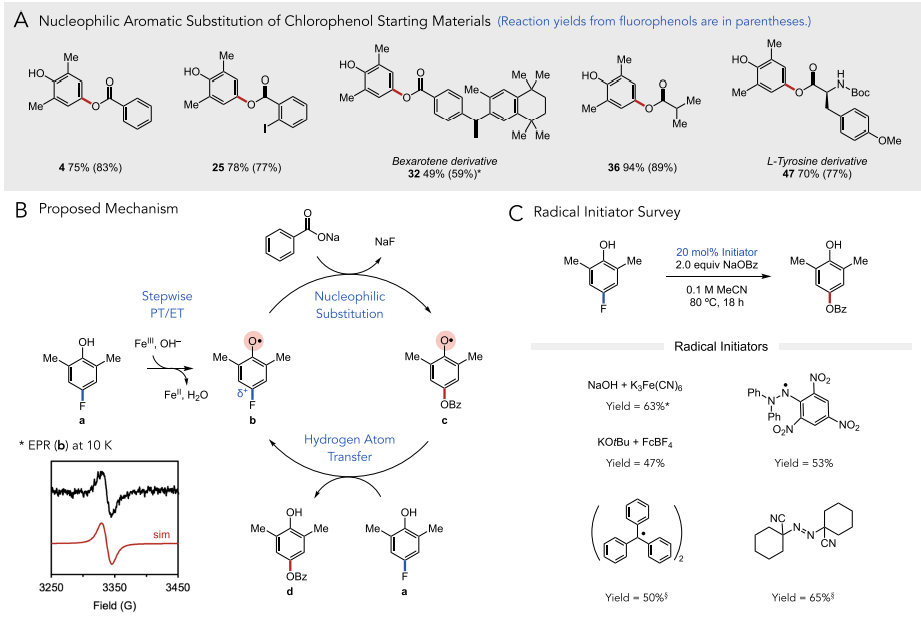
图5. 反应机理(图片来源:J. Am. Chem. Soc.)
总结 Robert R. Knowles课题组描述了一种新的自由基反应模式,它利用中性氧自由基作为强吸电子基团,对惰性芳基亲电试剂进行活化。通过脉冲辐射分解研究证实了该策略的可行性,并通过开发富电子卤酚SNAr合成方案验证了该策略的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn