

(图片来源:J. Am. Chem. Soc.)
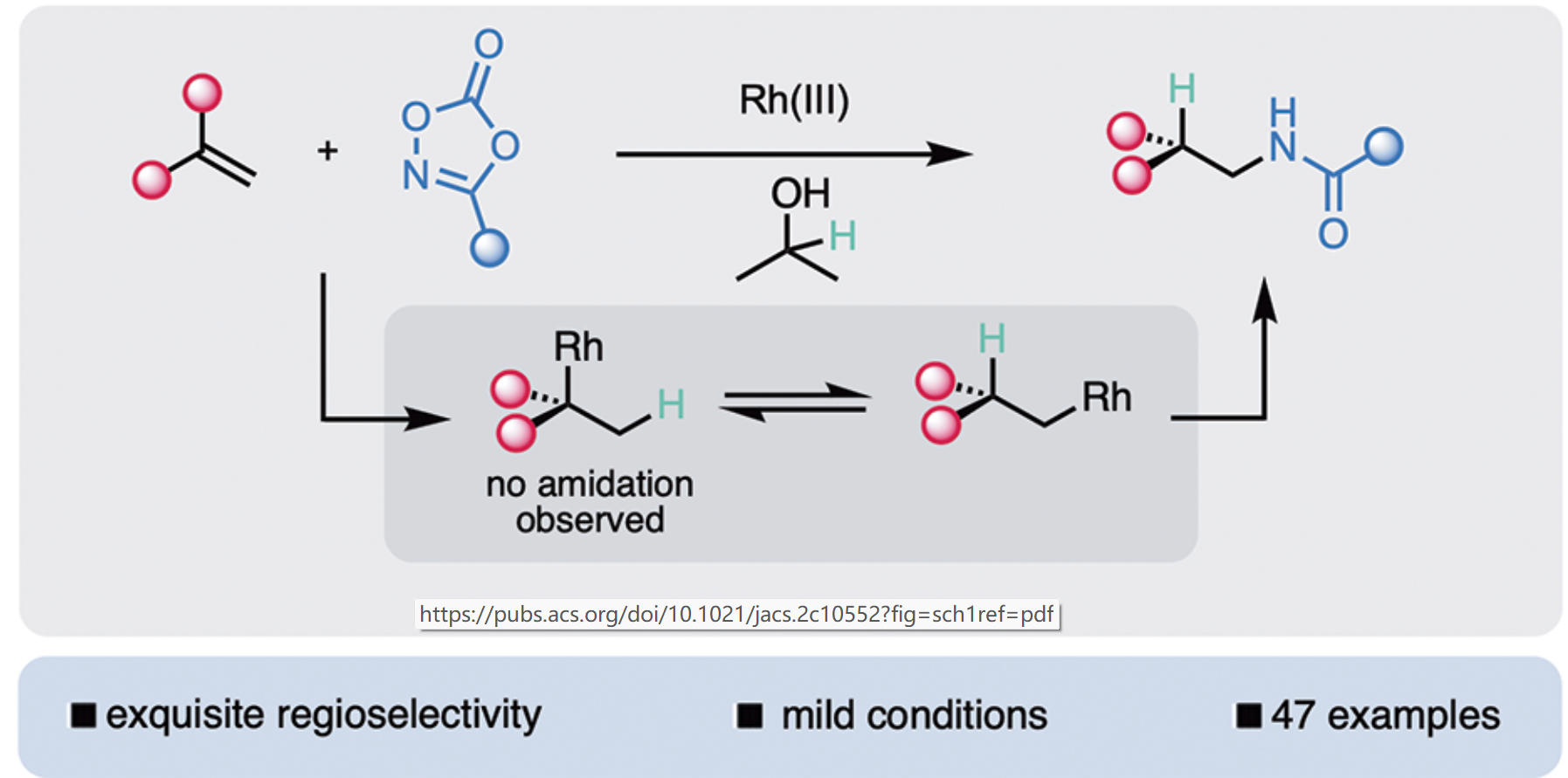
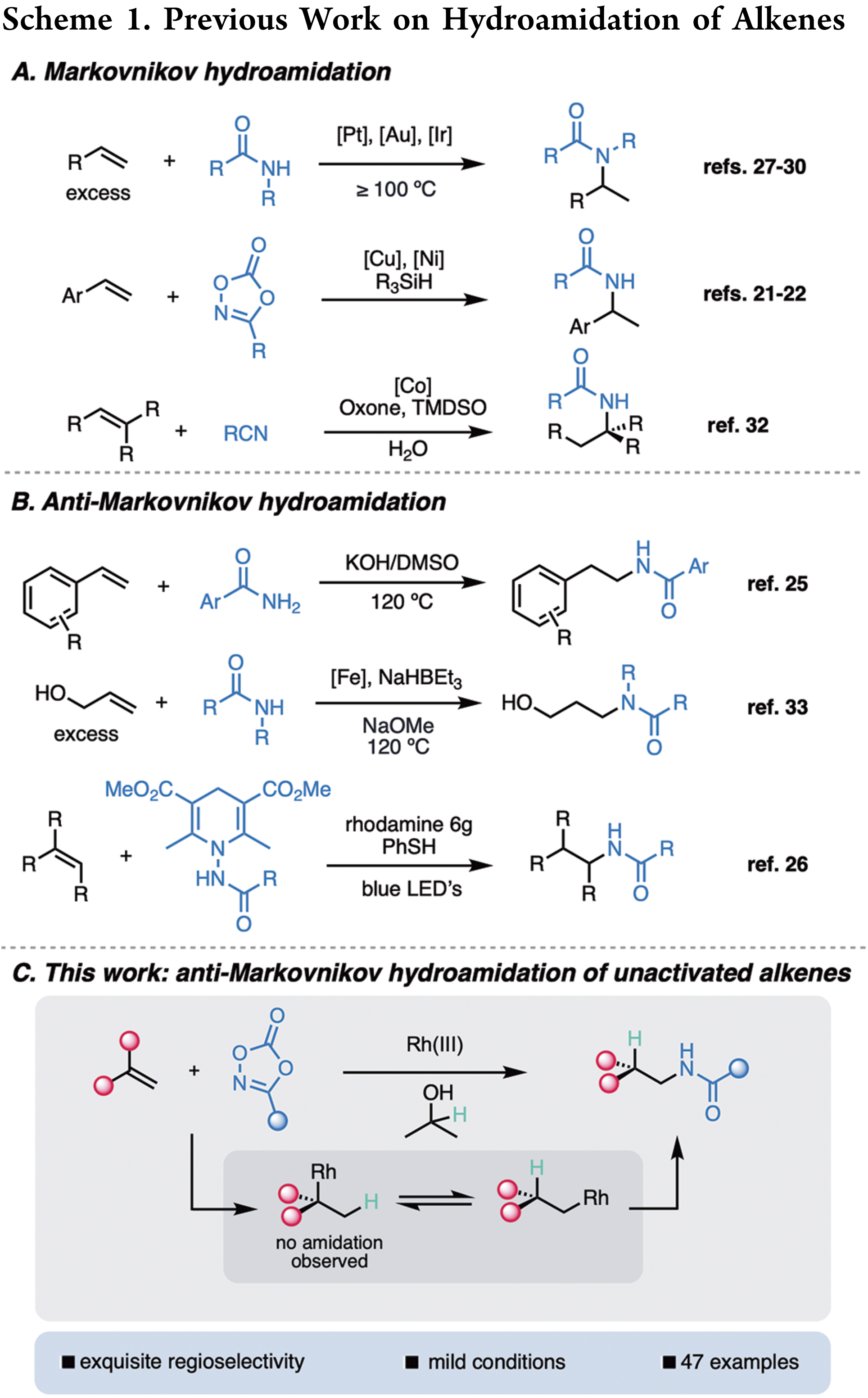
由于酰胺骨架在生物活性分子中广泛存在,因此氢酰胺化的方法令人着迷。根据2006年对领先制药公司的调查,三分之二的候选药物含有酰胺键。2020年,一家制药公司的调查显示,内部进行的所有反应中约有三分之一是酰胺的形成。这些反应中的绝大多数是酸衍生物和胺的传统偶联。另外一种互补的策略,是把廉价易得的烯烃与酰胺或者酰胺类似物结合,实现氢氨化反应。然而,这种策略一定程度上未被开发,可能是因为与脂肪胺相比酰胺的亲核性相对较低。最近的例子,包括这项工作,通过使用二噁唑酮作为亲电酰胺源,通过金属氮宾的形成或酰胺自由基的产生,避开了这一限制。先前关于氢酰胺化的大部分工作主要生成马氏选择性的产物 (Scheme 1a)。Widenhoefer和Hartwig的早期工作使用酰胺亲核试剂和未活化的烯烃,通过铂、金、铱催化实现氢酰胺化,但是通常需要高的反应温度和过量的烯烃。最近,Buchwald课题组使用二噁唑酮作为酰胺试剂和硅烷作为氢源,实现了铜催化类苯乙烯的马氏氢酰胺化反应。南京大学朱少林课题组、香港理工大学Wing-Yiu Yu课题组以及北京大学朱戎课题组分别实现了金属镍、钴催化的烯烃马氏加成的氢酰胺化反应。
目前,烯烃的反马氏选择性的氢酰胺化反应已有报道。例如,Verma课题组实现了非金属催化的苯乙烯的氢酰胺化反应;陕西师范大学王超课题组实现了铁催化选择性氢转移的烯丙醇的氢酰胺化反应;但是上述方法无法兼容非活化烯烃。基于此,作者报道了通过可逆和非选择性的Rh(III)氢物种迁移插入步骤,使用二噁唑酮作为酰胺替代物,异丙醇作为环境友好的氢源,实现了非活化烯烃的反马氏选择性氢酰胺化反应(Scheme 1c)。作者之前的工作揭示了铑(III)催化剂在各种反应中甚至能与简单的烯烃发生反应;Krische和其他人的大量工作已经可以确定转移氢化可以从异丙醇发生。作者设想通过两者的结合,可以通过铑氢实现简单烯烃的官能团化。具体地说,烯烃迁移插入铑氢物种,然后二噁唑酮捕获,随后实现反马氏氢酰胺化。
(图片来源:J. Am. Chem. Soc.)
作者以二噁唑酮和1-癸烯作为模板底物,通过条件优化,作者得到了最优反应条件如Table 1, entry 1 所示。特别值得注意的是,所选择的缺电子的1,2,3,4-四甲基-5-三氟甲基环戊二烯-1,3-二烯基(Cp*CF3),其优于五甲基环戊二烯基(Cp*)配体(Table 1, entry 2)。降低催化剂的电子密度可能有助于烯烃的迁移插入,实现更高的反应性。控制实验表明催化剂铑、i-PrOH和K2CO3都是必需组分(Table 1, entries 4-6)。当二噁唑酮的当量减少到2 equiv时,可以得到51%的产物(Table 1, entry 7),并且当反应不加热时同样得到55%的产率(Table 1, entry 7)。此外,该反应对空气不敏感(Table 1, entry 7)。

(图片来源:J. Am. Chem. Soc.)
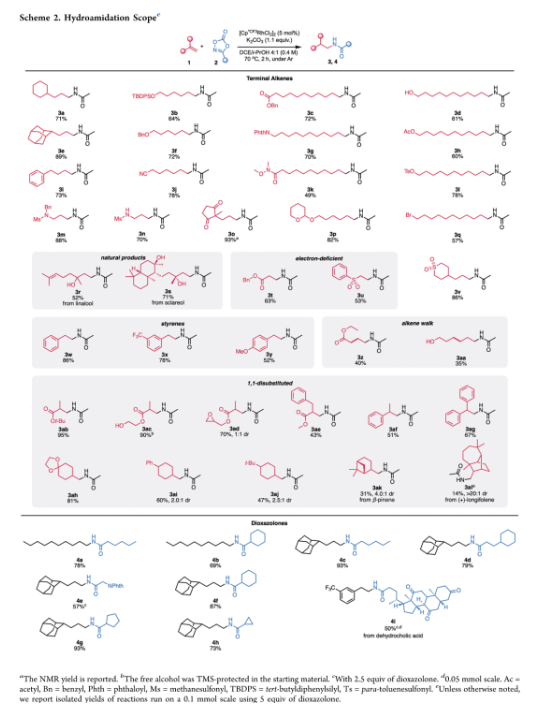
得到了最优反应条件,作者接着对底物范围进行了考察。含有各种官能团的烯烃可以很好地兼容,包括游离和保护的醇(3c、3h、3j、3m、3o、3p、3q、3aa、3ac)、保护的胺(3b、3g、3i、4e)和潜在敏感的离去基团,包括乙酸酯、苯甲磺酸酯和溴(分别为3j、3o和3u)。该催化体系同样兼容其它基团,例如,腈(3l)、Weinreb酰胺(3n)、砜(3r)和环氧化物(3ad)。值得注意的是,在还原金属氢物种的条件下酮(3s,4l)可以保留。更复杂的天然产物芳樟醇(3p)和香紫苏醇(3q)以良好的产率实现氢酰胺化,并且值得注意的是,芳樟醇的三取代烯烃未受影响可能由于位阻较大的原因。除了脂肪族烯烃,苯乙烯(3v-3x)和缺电子烯烃,如丙烯酸酯和乙烯基砜(3s, 3y)也能顺利实现转化。除此之外,作者还能够从内烯烃原料巴豆酸乙酯和反式-3-己烯-1-醇中分离出末端酰胺化的产物3z和3aa,尽管产率较低。这些产物很可能是通过链行走机制将双键异构化到末端位置的烯烃,之后发生氢酰胺化得到。此外,作者很高兴地看到,1,1-二取代烯烃也可以实现氢酰胺化。甲基丙烯酸酯衍生物(3ab, 3ae)在该方法中表现良好。α-取代的苯乙烯(3af,3ag)也以中等收率进行氢酰胺化。取代的亚甲基环己烷(3ah, 3al)也能有效地以中等至优异的非对映选择性得到所需的产物,但发现产率随着取代基空间位阻的增加而降低。例如,从苯基到叔丁基(3ai,3aj)对产率和非对映异构体比例影响很小,但使用明显更大的底物β-蒎烯(3ak)和(+)-长叶烯(3al)会导致产率大幅下降,非对映异构体比例明显更高分别为4:1和> 20:1。作者开始对不同的二噁唑酮底物进行了考察。具有不同长度的线性脂肪链和不同大小的环酰胺都被有效地兼容(4a、4b、4c、4d、4f、4g、4h)。N-邻苯二甲酰甘氨酸和脱氢胆酸衍生的二噁唑酮(4e, 4i)同样以中等的收率(57%, 50%)得到氢酰胺化产物。
(图片来源:J. Am. Chem. Soc.)
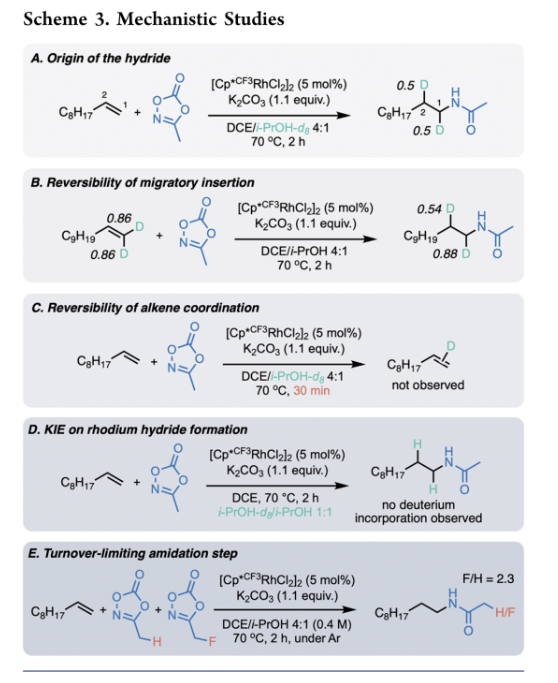
作者接下来将目光转移到反应的机理研究(Scheme 3)。在室温下,将[Cp*CF3RhCl2]2、异丙醇和K2CO3在DCM-d2搅拌1分钟,并通过1H NMR,作者观察到铑氢物种为三重态(-11.18 ppm,J = 20 Hz)。尽管进一步的实验表明观察到的该物种没有催化活性,但这也证明了在该催化条件下可以形成铑氢物种。为了验证铑氢是否具有活性,作者使用Et3SiH作为氢源进行了化学当量实验,生成了少量的活性铑单氢物种,并主要形成了非活性的铑双氢物种。将1-癸烯置于使用Et3SiH代替异丙醇的标准条件下,作者观察到氢酰胺化产物,尽管产率仅为6%。基于这些实验,以及铑氢转移的文献, 作者认为铑氢的形成可能是该机理的第一步。然后,作者试图通过在标准反应条件下使用异丙醇-d8来确认异丙醇是否为氢源,并且确实观察到被氘代的产物(Scheme 3a)。第二个有趣的实验结果是氘同等分布在C1和C2上,作者假设铑氢的迁移插入是完全无选择性的。由于酰胺化仅发生在末端位置,表明迁移插入也是可逆的;为了验证这一点,作者合成了末端被氘代的1-十一碳烯-d2作为底物(Scheme 3b);在产物中,作者观察到在C1结合的一些氘转移到C2,这进一步支持了迁移插入步骤是非选择性和可逆的。为了验证与烯烃配位是否可逆,在标准条件下作者选用1-癸烯作为底物,异丙醇-d8为溶剂,在30分钟后停止反应,使得反应没有实现完全转化(Scheme 3c)。如果烯烃配位是可逆的,作者应该观察到由于铑氘物种的迁移插入形成仲烷基铑物种和随后的β-氢消除而实现烯烃被氘代。然而,在分离出未反应的烯烃时,没有观察到被氘代的烯烃,表明烯烃配位是不可逆的。随后,作者同样选用1-癸烯作为底物,异丙醇-d8与异丙醇1:1为混合溶剂,没有观察到被氘代产物,这意味着在铑氢形成步骤和潜在的后续步骤中存在较大的初级KIE。由于上述实验结果表明酰胺化是决速歩,作者使用氟甲基二噁唑酮和甲基二噁唑酮之间的竞争实验来确定二噁唑酮配位或氮宾的形成是否为决速步骤(Scheme 3e)。尽管甲基二噁唑酮的配位作用更强,但氟甲基二噁唑酮更容易被活化而形成氮宾。该反应的产物比为2.3:1,有利于氟化产物,表明配位更弱的氟甲基二噁唑酮优于甲基二噁唑酮。因此,作者得出结论,决速歩不是二噁唑酮的配位,而是金属氮宾的形成。
(图片来源:J. Am. Chem. Soc.)
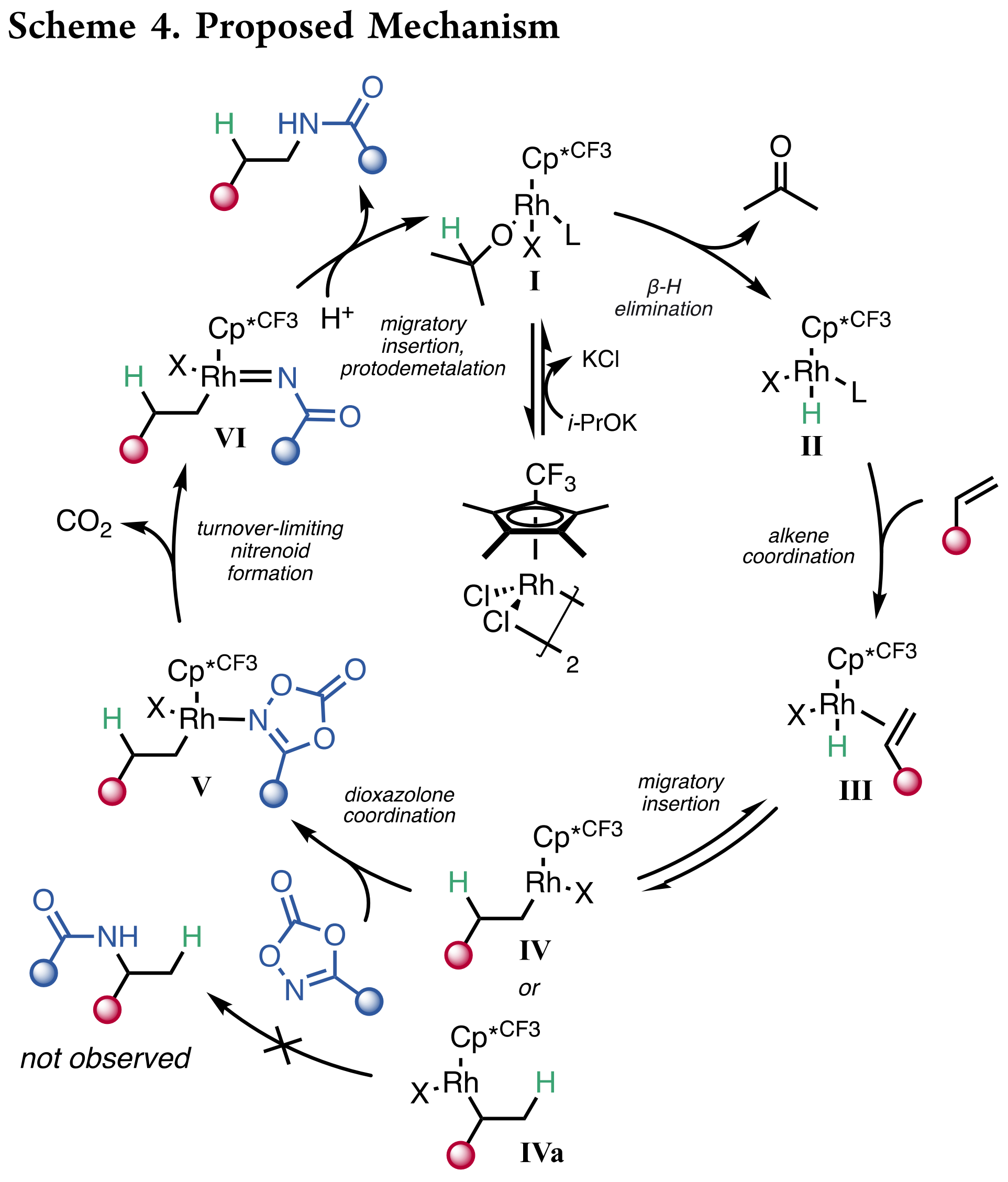
在上述实验的基础上,作者提出了Scheme 4中所示的机理。首先,K2CO3促进了由异丙醇与金属铑结合形成铑醇盐I,然后经历β-氢消除释放丙酮形成铑氢物种II;之后该物种与烯烃的不可逆配位产生物种III,其可以经历可逆的迁移插入,形成烷基铑物种IV或IVa。由于没有检测到支链的区域异构体产物,作者推断只有IV被酰胺化,而IVa经历β-氢消除回到III。在二噁唑酮与IV配位形成V时,之后发生N-O键断裂和释放CO2,形成铑氮宾物种VI。最后生成的N-Rh键的迁移插入和质子化脱金属释放出氢酰胺化产物,并使催化剂再生。
(图片来源:J. Am. Chem. Soc.)
总结
Tomislav Rovis课题组开发了一种新的方法,通过可逆迁移插入进行高选择性Rh(III)-催化的非活化烯烃的反马氏氢酰胺化。该反应在温和的反应条件下具有广泛的底物范围。除了兼容多种官能团外,该反应还适用于不同种类的烯烃,包括缺电子烯烃、苯乙烯和1,1-二取代烯烃。该反应还具有反应时间短、对空气不敏感以及普遍存在的溶剂异丙醇作为氢源等优点。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn