

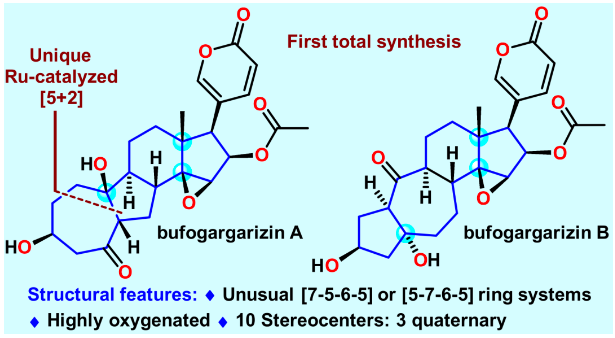
甾体类天然产物由于具有重要且多样的生物活性和丰富的结构,在药物发现和合成化学领域占有着重要的地位。蟾蜍作为一种传统中药材,长期被用来治疗癌症、心力衰竭、牙痛、抗炎等,而甾体类化合物是其主要活性成分。孪生甾体bufogargarizins A和B是暨南大学叶文才教授团队于2010年从中华大蟾蜍的毒液中分离鉴定的具有全新骨架的类固醇天然产物。相比于普通的甾体结构,bufogargarizins A和B分别具有[7-5-6-5]和[5-7-6-5]四环核心骨架,其也是首次于蟾蜍源甾体中发现的具有重排A/B环系的天然产物。有趣的是,生源假说认为bufogargarizin A和B可能来源于相同的生源前体,通过不同的生物途径转化得到,然而其假说尚未得到证实。这些天然产物的自然来源相对匮乏,且尚没有全合成报道,阻碍了其进一步的生物活性研究。因此开发一条高效的全合成路线,进而为生物活性研究和构效关系研究提供物质基础,具有较大的现实意义。从结构上分析,bufogargarizins A和B具有氧化态极高的核心骨架,以及10个手性中心,其中大多数是连续的,并且有三个是季碳中心,其中一个为全碳季碳中心;同时还具有一个极富电子的-吡喃酮环(图1)。这些特征使得bufogargarizins A和B的全合成具有极大的挑战性。由于其潜在的生理活性以及颇具合成挑战的结构,骨架重排的甾体吸引了合成化学界广泛的研究兴趣,国内的杨震、李昂、桂敬汉、马志强等教授团队均做出了重要贡献。然而,目前尚没有这类含有-吡喃酮环的A/B重排甾体的全合成报道。此外,合成这种[7-5-6-5]四环核心骨架的方法也非常有限。2018年,李闯创教授团队报道了一种采用Type [5+2] 环加成反应构建bufogargarizin A核心骨架的方法(Org. Chem. Front. 2019, 6, 22),然而后期的官能团修饰却遭遇了较大的困难。在其后对于这类独特分子不懈努力的合成实践中,李闯创教授团队发展了烯醇醚环丙烷(VECP)—炔的钌催化[5+2]环加成反应作为关键反应,完成了bufogargarizin A和B的首次不对称全合成。
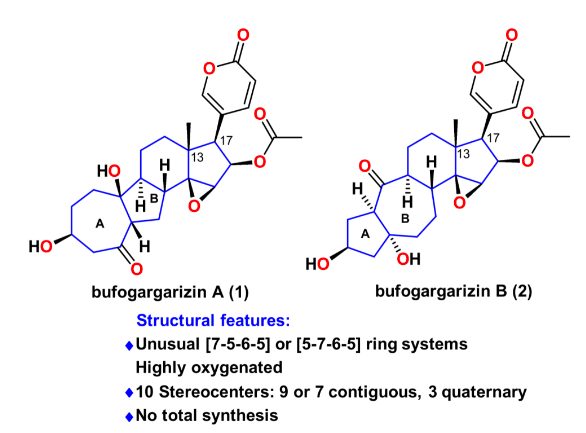
图1. bufogargarizin A和B分子及背景介绍(图片来源:J. Am. Chem. Soc.)
逆合成分析如图2所示,天然产物bufogargarizin A可以通过一系列官能团转化从化合物3合成,这主要包括若干步的C-O键生成反应。从策略上来说这将产生一系列从低到高氧化态的衍生物,有利于将来的构效关系研究。而bufogargarizin B可以通过仿生的retro-aldol/跨环aldol串联反应直接从bufogargarizin A得到。然而其生源途径有待于进一步证实,且跨环aldol反应的区域选择性和非对映选择性难以预测,因此该策略有不小的挑战性。其次bufogargarizin B可以从四环骨架的化合物4得到,该[5-7-6-5]四环骨架可以从[7-5-6-6]四环骨架3通过仿生的环系重整得到,尽管目前没有关于[7-5-X]骨架重整以生成[5-7-X]骨架的例子。受到Wender教授以及Trost教授关于VCP [5+2]环加成反应开创性工作的启发,化合物3可以通过VECP—炔的[5+2]环加成反应得到。该反应区别于传统的VCP [5+2]环加成反应,直接得到高度氧化的产物,可以为后续的修饰提供便利。而其前体5可以由商业可得的便宜原料sitolactone通过几步简单转化得到。
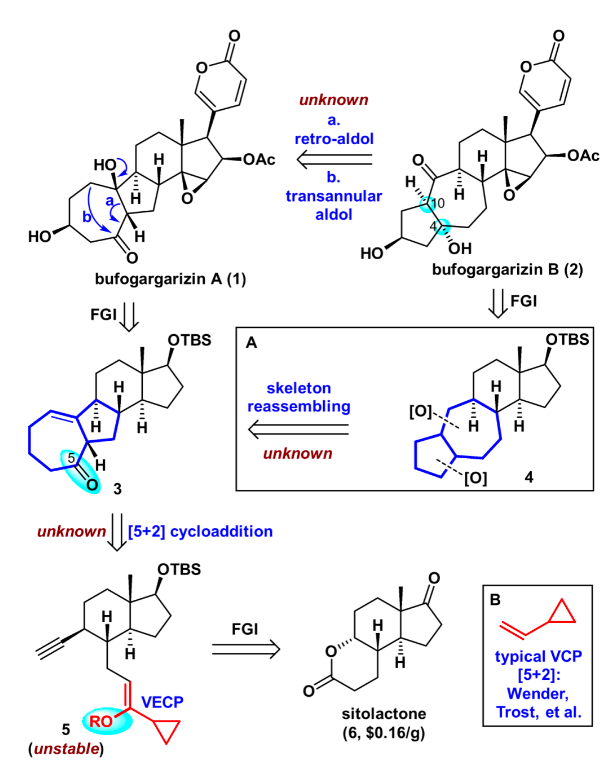
图2. 逆合成分析(图片来源:J. Am. Chem. Soc.)
具体合成路线如图3所示,化合物6通过还原、氧化、上保护等几步转化得到醛酮化合物7,随后醛基选择性的和环丙基格氏试剂加成,一锅法对羟基进行原位保护,以62%产率得到化合物8。利用van Leusen反应对化合物8进行增碳,随后用DIBAL还原氰基成醛(dr=1.5:1, C9),在甲醇/甲醇钠的条件下将C9醛基异构化(>8:1 dr ),所得化合物9,随后和Ohira–Bestmann试剂、碳酸钾在甲醇溶剂下顺利得到[5+2]前体11。
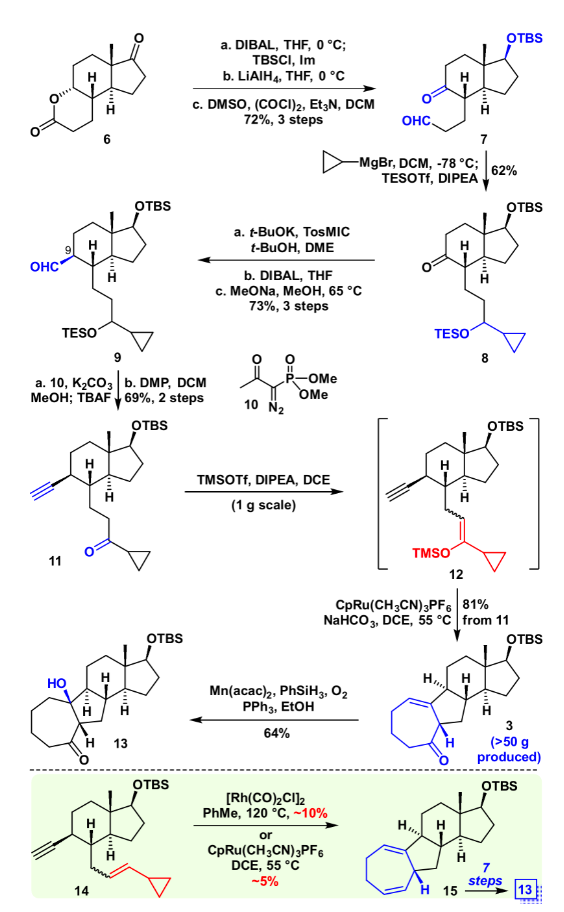
图3. 化合物13的合成(图片来源:J. Am. Chem. Soc.)
将化合物11在TMSOTf、DIPEA作碱的条件下制成烯醇硅醚(Z/E = 2.5:1),随后加入碳酸氢钠中和过量的三氟甲磺酸酯,在DCE为溶剂,CpRu[CH3CN]3PF6作为催化剂,加热至55 ℃的条件下,以一锅81%的产率顺利得到VECP [5+2]产物3。随后在Mukaiyama Hydration条件下,顺利引入相应的叔醇,得到化合物13,其绝对构型通过衍生物的单晶确认。作为对比,底物14(Z/E = 1:1)在传统的铑催化或者钌催化的条件下以很低(5~10%)的产率得到相应的[5+2]产物15,其主要的原因是铑催化剂对端炔不兼容,以及钌催化剂要求VCP的双键为反式。而后续转化成13却需要额外的7步,这证明VECP [5+2]环加成反应的高效性,以及其在全合成后期官能团修饰中的巨大优势。
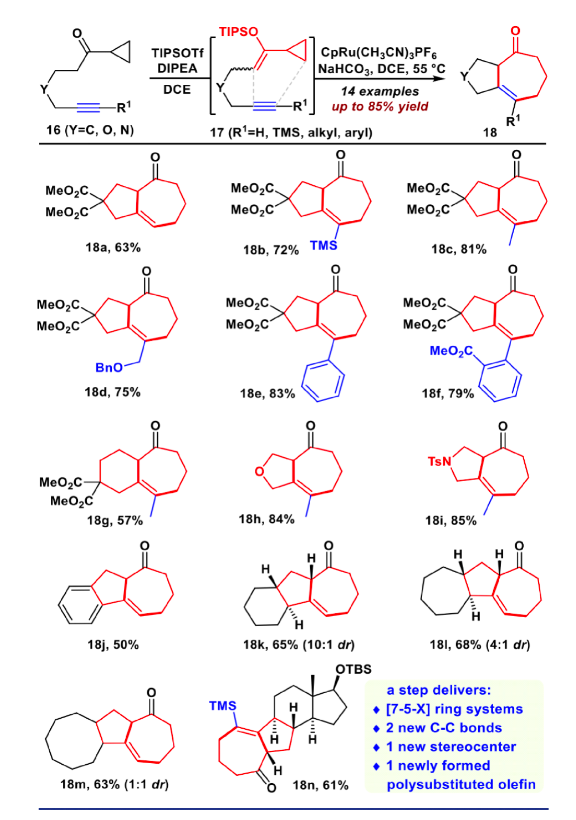
图4. VECP [5+2]环加成反应的底物拓展(图片来源:J. Am. Chem. Soc.)
接下来作者考察了该VECP [5+2]反应的底物适用范围(如图4)。研究发现,该反应对各种炔烃都是兼容的,如端炔、非端炔、TMS、烷基或者芳基取代的炔烃,都得到良好的产率(18a-18f)。甚至对于之前被证明是困难的[7/6]并环产物(18g)也取得了成功。此外,对于氧杂环(18h)和氮杂环(18i)都取得了良好的收率。随后作者进一步尝试构建更加复杂的环系,例如苯并[5-7]环(18j)、[7-5-6]并环(18k)、[7-5-7]并环(18l)、[7-5-8]并环(18m)、以及[7-5-6-5]并环(18n),这些底物均取得中等收率,这再一次证实该VECP [5+2]反应具有广泛的适用性。接下来,作者开始进行bufogargarizin A的全合成。将化合物13用DIBAL还原,并在一锅内用TBAF脱除硅基保护。用DMP同时对C5和C17进行氧化,随后进行双Saegusa氧化,以三步62%的产率得到双不饱和烯酮化合物19。化合物19经过优化的(SiO2, DIPEA , PhCF3)化学选择性双键迁移,立体选择性环氧化,以及Mukaiyama 水合,原位进行双TMS保护,以46%的产率得到化合物20。将20在KHMDS作碱的条件下和Comins试剂反应顺利得到三氟甲磺酸乙烯酯,随后用二碘化钐开环氧,得到C3位的羟基化合物21。将其进行MOM保护,随后DIBAL还原,以及原位TMS保护,以73%的收率一锅得到化合物22。利用Suzuki反应将化合物22与吡喃酮片段23偶联,以85%的收率得到24。随后用m-CPBA对C17=C18进行环氧化,并在加入硼烷二甲硫醚络合物的条件下发生乙烯基还原、开环氧串联反应,得到25。将25进行DMP氧化,随后在DBU的条件下发生β-氧消除,得到C14=C16双键,而此时C17发生了消旋,在LHMDS,-98 ℃的条件下顺利对C17进行动力学的异构化,以两步68%的收率得到化合物26。化合物26尝试过许多还原条件,均立体选择性不佳,最后在标准CBS还原条件顺利得到相应还原产物,并在原位加入DMAP和醋酸酐的条件下乙酰化,以良好产率得到27。最后在NBS和NaOH的条件下立体选择性的环氧化,并在加入TBAF的条件下以46%的收率一锅法脱硅基保护;随后进行DMP氧化,在LiBF4的作用下脱除MOM保护,顺利的完成了bufogargarizin A的不对称全合成。
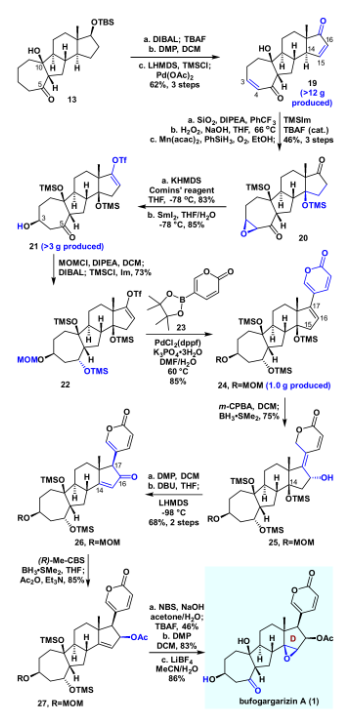
图5. bufogargarizin A的不对称全合成(图片来源:J. Am. Chem. Soc.)
得到bufogargarizin A后,作者开始尝试直接通过仿生的retro aldol/跨环aldol串联反应得到bufogargarizin B。然而尝试许多条件以及数个底物之后,并没有取得令人满意的结果,绝大多数底物伴随着难以避免的副反应。于是作者认为较低的氧化态以及简单的官能团可能对这一转化有利,于是化合物28被设计为retro aldol/跨环aldol串联反应的底物。将化合物13进行Saegusa氧化,随后在双氧水和氢氧化钠的条件下进行立体选择性的环氧化。用二碘化钐开环氧,随后进行MOM保护,以4步47%的收率得到化合物28。化合物28在DBU作碱,THF为溶剂,加热到沸点回流的条件下,顺利实现所设计的retro aldol/跨环aldol串联反应,从而完成从化合物28 的[7-5-6-5]环系到化合物30 的[5-7-6-5]环系直接转化,且立体选择性单一。这一实验结果也通过DFT理论计算验证,化合物30既是动力学优势,也是热力学优势的产物。得到化合物30之后,进一步展开bufogargarizin B的全合成。用DIBAL将其羰基还原,随后加入TBAF脱硅基保护,以一锅65%的产率得到相应的三醇。随后DMP氧化,得到化合物31。后续通过与bufogargarizin A全合成相似的方法,实现了bufogargarizin B的不对称全合成。值得一提的是,经过反复实验,bufogargarizin B亦无法直接转化为bufogargarizin A,因此bufogargarizin A和bufogargarizin B的相互转化被证明是困难的,这或许能为其生源假说提供有用的启发。
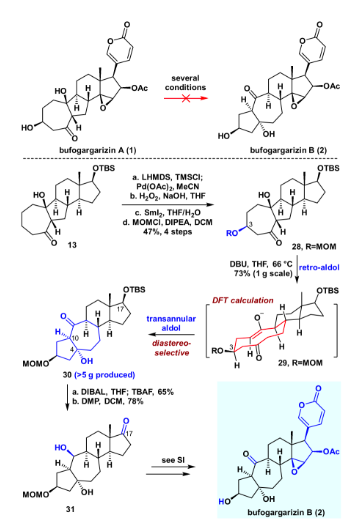
图6. bufogargarizin B的不对称全合成(图片来源:J. Am. Chem. Soc.)
总结
南科大李闯创教授团队,首次利用VECP [5+2]反应高效构建了[7-5-6-5] 四环骨架,并通过一系列的官能团转化,完成了 bufogargarizin A 的首次不对称全合成。同时,通过新颖的retro aldol/跨环aldol串联反应,实现[7-5-6-5]环系到[5-7-6-5]环系的重组转化,进而完成了 bufogargarizin B 的首次不对称全合成。该合成策略可以为今后合成其它具有类似特征的甾体类天然产物提供重要的借鉴。
文献详情:
Li-Ping Zhong, Rui Feng, Jing-Jing Wang, Chuang-Chuang Li*. Asymmetric Total Synthesis of Twin Bufogargarizins A and B. J. Am. Chem. Soc. 2023
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn